过表达甘油激酶三角褐指藻藻株富集油脂的研究
侯兴国, 方 琰, 白 欢, 胡莎莎, 卿人韦, 兰利琼
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室, 成都 610065;2.国网四川省电力公司电力科学研究院, 成都 610072)
1 引 言
随着人类社会发展日益加快,化石燃料消耗也迅速加快,并伴随着燃烧所带来的环境污染问题[1],寻找新的可再生能源已经迫在眉睫[2].生物柴油作为一种新兴能源正在被越来越多的人所研究[3].而微藻生物柴油具有绿色环保等优点,是新一代可再生能源,如何提高其油脂产量,是其重要研究方向[4].
三角褐指藻是一种生长快速、培养简单、油脂含量较高的海洋模式硅藻[5],不仅可以通过光能自养的方式繁殖,而且还可以在添加外源甘油的情况下兼养生长[6].并且其全基因组测序已经完成[7],可以更好地对其基因层面进行分析以及实验,此外其遗传转化体系也很成熟.
甘油激酶作为三角褐指藻同化外源甘油的第一个酶[8],并且是连接碳代谢与脂代谢的关键酶[9],其表达量的差异会直接影响到三角褐指藻对于外源甘油的利用速度.根据构建好的GKOE测得其甘油激酶基因表达量于对数生长期较WT上调,GKRNi中甘油激酶基因表达量则于对数生长期时较WT下调[10],故对GKOE和GKRNi进行了深入研究,探讨其稳定期时油脂含量与脂肪酸成分是否符合生物柴油的开发原则[11],即生物量、油脂含量与中性脂质含量要高,并且脂肪酸组分中C16-18的相对含量要高,而PUFA的含量要低.
2 材料与方法
2.1 材 料
藻种:三角褐指藻野生型(WT)来自于中国海洋大学微藻种质库,编号为MACC/B288.甘油激酶基因过表达藻株(GKOE)与甘油激酶基因干扰藻株(GKRNi)均由四川大学生命科学学院藻类学实验室构建[12].
f/2液体培养基(加入质量分数为3%的海盐):NaNO3(78.4 μg/mL)、NaH2PO4(4.48 μg/mL)、FeC6H5O7·5H2O(3.9 μg/mL)、维生素VB12(0.5 ng/mL)、维生素VB1(100 ng/mL)、维生素VH(0.5 ng/mL)、微量元素若干.
培养条件:接种浓度为2×105个/mL;光照强度2500 lx;光暗比12 h∶12 h;温度22±1℃
尼罗红溶液:称取1 mg尼罗红粉末后加入丙酮,定容至10 mL配制为0.1 mg/mL尼罗红溶液.
酸洗玻璃珠:用1∶20的硫酸溶液浸泡过夜,第二天倒掉酸液用蒸馏水洗涤10遍然后风干.
盐酸甲醇溶液:以浓盐酸为溶质,甲醇为溶剂,配制为1 mol/L的HCl-CH3OH溶液.
脂肪酸甲酯标准品:Sigma公司,并用正己烷配置为浓度为10 mg/mL的脂肪酸甲酯标准品溶液.
内标十五烷酸(C15:0):用正己烷配置为浓度为10 mg/mL的内标溶液
GC-MS:仪器:日本岛津shimadzu;色谱柱号:hp-88.
试剂:均来自四川大学设备科.
2.2 方 法
2.2.1 生长曲线的绘制 将稳定期的GKOE、GKRNi和WT接种至100 mL f/2液体培养基或添加浓度为20 mmol/L外源甘油的f/2液体培养基中,其中培养GKOE与GKRNi藻株的培养基中添加100 mg/L Zeocin.每隔24 h取样检测450 nm处的吸光度(OD450),并用血球计数板计数,绘制生长曲线.
2.2.2 油脂的提取与测定 藻细胞的收集:取100 mL藻液,低温冷冻离心10 000 r/min×5 min收集藻细胞,并用双蒸水重悬洗涤3次;收集藻细胞后真空干燥75 ℃抽真空2 h至恒重称重;
采用溶剂浸提法提取油脂[13]:将烘干的藻细胞放入研钵中研磨;将每种研磨好的藻粉转入干净的1.5 mL离心管中并加入600 μL分析纯石油醚和300 μL无水乙醚,涡旋混匀;25℃条件下浸提5 h,期间涡旋混匀数次;然后向每个离心管中加入300 μL 10% KOH溶液,涡旋混匀,再10 000 r/min×10 min离心;取上清至干净的称重过的1.5 mL离心管中并用相同溶剂抽提原管剩余油脂合并;旋转真空干燥仪中55 ℃烘干称重,计算油脂净重与藻细胞中油脂产量.油脂含量公式如式(1),油脂产量公式如式(2):
油脂含量(%)=油脂重量(mg)/干重(mg)×
100
(1)
油脂产量(mg/mL)=油脂净重(mg)/藻液体
积(mL)
(2)
2.2.3 中性脂质的定性测定 采用尼罗红染色测定中性脂质相对含量[14]:取对数生长期与稳定期藻液各2×106个,12 000 r/min×5 min收集藻细胞;PBS重悬清洗藻细胞后12 000 rpm×5 min,重复三次;然后300 μL PBS悬浮藻细胞并加入10 μL 0.1 mg/mL尼罗红溶液混匀,42 ℃下暗反应10 min;全波长酶标仪检测其在发射波长575 nm、激发波长530 nm处的荧光强度[15].计算中性脂质相对产量公式如式(3):
中性脂质相对产量(au/mL)=中性脂质相对
含量(au/2×106个)×藻细胞浓度(个/mL)
(3)
尼罗红荧光镜检:取对数生长期与稳定期藻液各1 mL,其余步骤如上,只是不通过全波长酶标仪荧光强度的测定而是制成玻片用于显微镜下的荧光拍照.
2.2.4 脂肪酸组成测定 总脂质的提取[16]:藻细胞的收集如2.2.2中所示;藻细胞液氮研磨转入1.5 mL离心管中,加入400 μL氯仿和200 μL甲醇以及1 μL内标C15∶0; 涡旋混匀数次后超声辅助破碎细胞:超3 s,停3 s,22%功率,共6 min(离心管置于冰中);将超声处理的液体转入新离心管内并加入约300 μL酸洗玻璃珠,原管用234 μL氯仿和117 μL甲醇重洗一遍,涡旋数次后洗液同样转入新管;液氮冷却5 min,转入4 ℃,裂解2 h; 4 ℃,12 000 r/min×5 min,上清移入新管;之后加入430 μL 0.9% KCl,涡旋数次;4 ℃,12 000 r/min×5 min,下层氯仿层移入新离心管,原管用500 μL氯仿把KCl重洗一遍,同样涡旋数次后12 000 r/min×5 min,吸出下层氯仿与原先合并;最后真空干燥90 min除去氯仿.
脂肪酸甲酯化[17]:提取的总脂质加350 μL正己烷重溶再转移到小玻璃瓶中后加入875 μL HCl-CH3OH,涡旋混匀;85 ℃,2 h甲酯化后转入-20 ℃,冷却20 min;加350 μL 0.9% KCl,涡旋,静置分层,小心取上层,转入新离心管后原管用200 μL正己烷重新抽提一遍,将两步的正己烷层合并;真空20 ℃干燥,-20 ℃保存.
GC-MS分析:载气:N2;线速:20 cm/s;分流比:10∶1;流量:2.2 mL/min;汽化室温度:250 ℃;程序升温:起始温度100 ℃,保持2 min,升温速率10 ℃/min升温至180 ℃,之后升温速率为4 ℃/min升温至250 ℃,保持5 min;检测器:氢火焰离子化检测器(FID);分析软件:HPCHEM色谱工作站;质谱条件:离子源为EI源,接口温度250 ℃,离子源温度为200 ℃,电子能量70 eV,扫描范围50~500 amu;扫描时间从3 min开始;分析前脂肪酸甲酯用100 μL正己烷重溶,将标准品和样品进行GC分析,上样量1 μL,分析时运用面积归一法分析[18].
3 结果与分析
3.1 藻株生长情况分析
对三角褐指藻细胞浓度与OD450进行线性回归分析(见图1),得到两者之间的线性关系式如式(4):
y=150.6x-2.855 (R2=0.999)
不失一般性,以下也考虑(6)式。为了完成BCST任务,Alice 和Bob合作引入两个辅助粒子s、t,这两个粒子处于初始态|00〉st,并使之与|ω〉34态构成复合系统|ω〉34|00〉st。然后,分别施行以粒子s、t为目标粒子,以粒子3、4为受控粒子的两个受控非门运算,量子态|ω〉34|00〉st变成
(4)
(式中x为光吸收值OD450,y为藻细胞浓度N,单位为1×105个/mL).
由于P<0.01,说明回归模型有意义,所以可以利用藻液的OD450表示三角褐指藻的生长情况.
通过三角褐指藻生长曲线确定培养到第6 d的藻作为对数生长期的藻、培养到第15 d的藻作为稳定期的藻.当培养基中添加外源甘油后,WT、GKOE和GKRNi的生物量均高于同时期正常培养的同种三角褐指藻,这一结果在GKOE中尤为明显(见图2).在稳定期时,甘油兼养的GKOE藻浓度可以达到2.23×107个/mL,远高于WT(1.79×107个/mL)和GKRNi(1.78×107个/mL).
3.2 油脂含量分析
结果显示,每100 mL藻液中藻细胞干重与油脂含量均随培养时间的增长而升高,且甘油兼养的三角褐指藻藻细胞干重与油脂含量均高于正常培养的同种三角褐指藻,故此处仅分析稳定期甘油兼养情况的油脂含量。甘油兼养的GKOE的藻细胞干重可以达到47.2 mg(见图3),与WT(41.1 mg)和GKRNi(42.0 mg)形成了显著差异.通过溶剂浸提法提取油脂显示甘油兼养的GKOE油脂含量可以达到31.73%(见图4),与甘油兼养的WT(27.20%)和GKRNi(26.63%)差异显著.而且甘油兼养的GKOE的油脂产量为0.15 mg/mL,比甘油兼养的WT和GKRNi分别高出35.14%和31.58%.
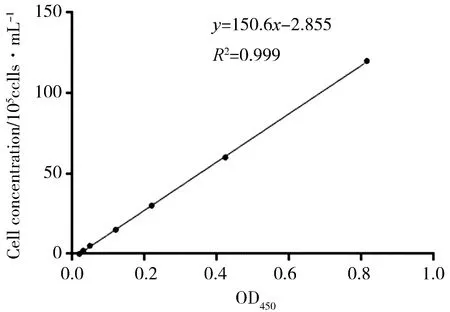
图1 细胞浓度与OD450之间线性关系Fig.1 Linear relationship between cell concentration and OD450
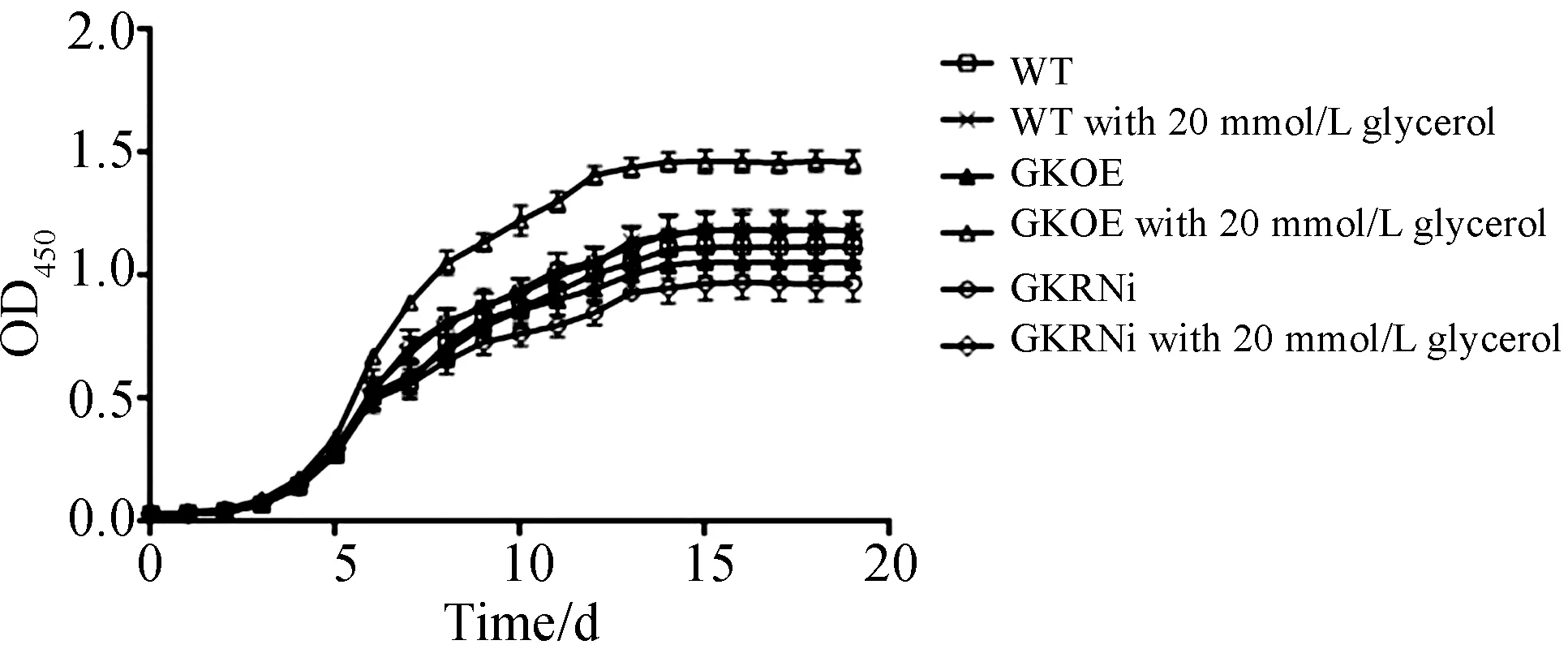
图2 三角褐指藻生长曲线Fig.2 The growth curves of Phaeodactylum tricornutum
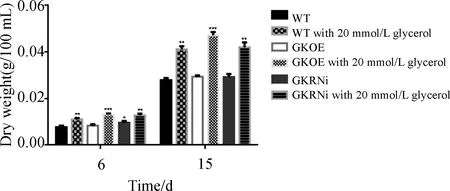
图3 三角褐指藻细胞干重Fig.3 The dry weight of Phaeodactylum tricornutum
3.3 中性脂质定性分析
尼罗红是一种脂溶性荧光染料,能够与细胞中的脂类物质结合,在特定的激发波长下显示强烈的荧光,可通过全波长酶标仪进行荧光强度的测定或者荧光显微镜镜检观察.通过尼罗红的荧光强度测定间接反映中性脂质的含量,从而了解生物柴油的含量.
结果显示,随着培养时间的增长,藻细胞中中性脂质含量逐渐提高,故此处仅分析稳定期中性脂质含量.甘油兼养的三角褐指藻相比正常培养条件下同种藻株的中性脂质含量均显著提高;甘油兼养的GKOE中的中性脂质含量分别比甘油兼养的WT和GKRNi高了16.3%和17.8%(见图5),其中性油脂产量约高了44.8%和47.2%.
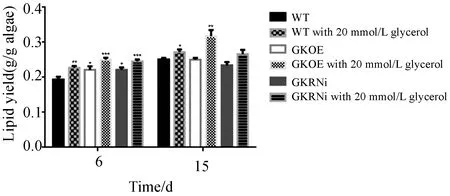
图4 三角褐指藻油脂含量图Fig.4 The lipid yield of Phaeodactylum tricornutum

图5 尼罗红染色荧光强度Fig.5 The fluorescence intensity of Nile red dyed
通过尼罗红荧光镜检发现,在对数生长期时,甘油兼养的三角褐指藻已经开始了油脂的积累,而正常培养的三角褐指藻的油脂积累并不明显;甘油兼养的GKOE在单个藻细胞中油脂积累与甘油兼养的WT和GKRNi相比,油脂滴体积更大,油脂滴数更多(见图6).而处于稳定期的三角褐指藻中的中性脂质都已经积累完成,通过尼罗红荧光镜检无法通过单个藻细胞的油脂滴来区分其含量大小,只能通过藻数来辨别,甘油兼养的GKOE中藻数仍然远大于甘油兼养WT和GKRNi;但WT和GKRNi的中性脂质含量差异却不显著(见图7).
3.4 藻细胞的脂肪酸组成分析
通过样品稳定期GKOE的脂肪酸色谱图可看到(见图9),各组分脂肪酸甲酯均分离良好,且出峰时间与脂肪酸标准品一致,故此GC条件可以用于脂肪酸成分的分析.




图8 脂肪酸甲酯混标气相色谱图Fig.8 GC chromatogram of fatty acid methyl ester mixed standards

图9 稳定期时培养基中添加外源甘油的GKOE脂肪酸甲酯气相色谱图
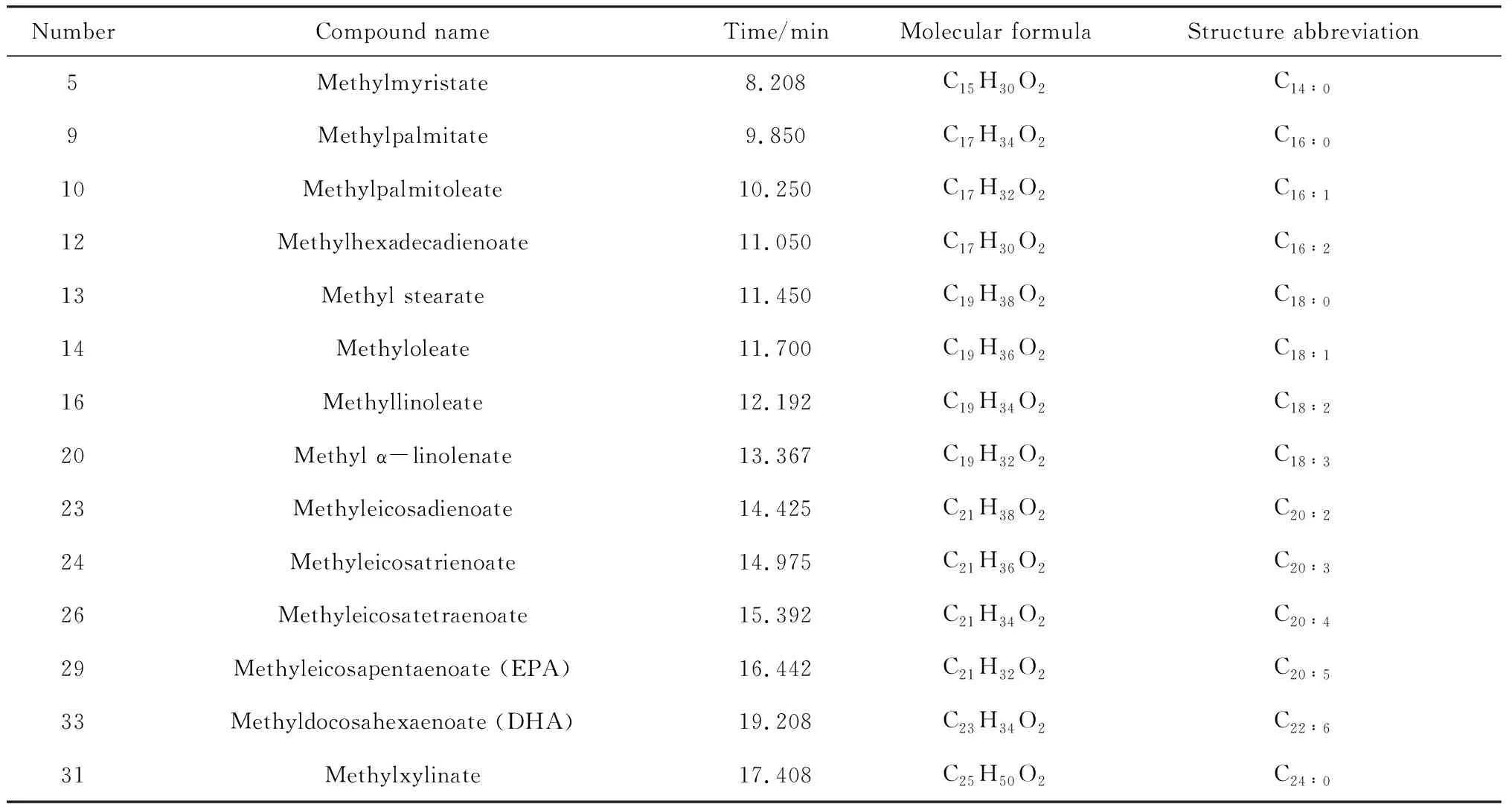
NumberCompound nameTime/minMolecular formulaStructure abbreviation5Methylmyristate8.208C15H30O2C14∶09Methylpalmitate9.850C17H34O2C16∶010Methylpalmitoleate10.250C17H32O2C16∶112Methylhexadecadienoate11.050C17H30O2C16∶213Methyl stearate11.450C19H38O2C18∶014Methyloleate11.700C19H36O2C18∶116Methyllinoleate12.192C19H34O2C18∶220Methyl α-linolenate13.367C19H32O2C18∶323Methyleicosadienoate14.425C21H38O2C20∶224Methyleicosatrienoate14.975C21H36O2C20∶326Methyleicosatetraenoate15.392C21H34O2C20∶429Methyleicosapentaenoate (EPA)16.442C21H32O2C20∶533Methyldocosahexaenoate (DHA)19.208C23H34O2C22∶631Methylxylinate17.408C25H50O2C24∶0
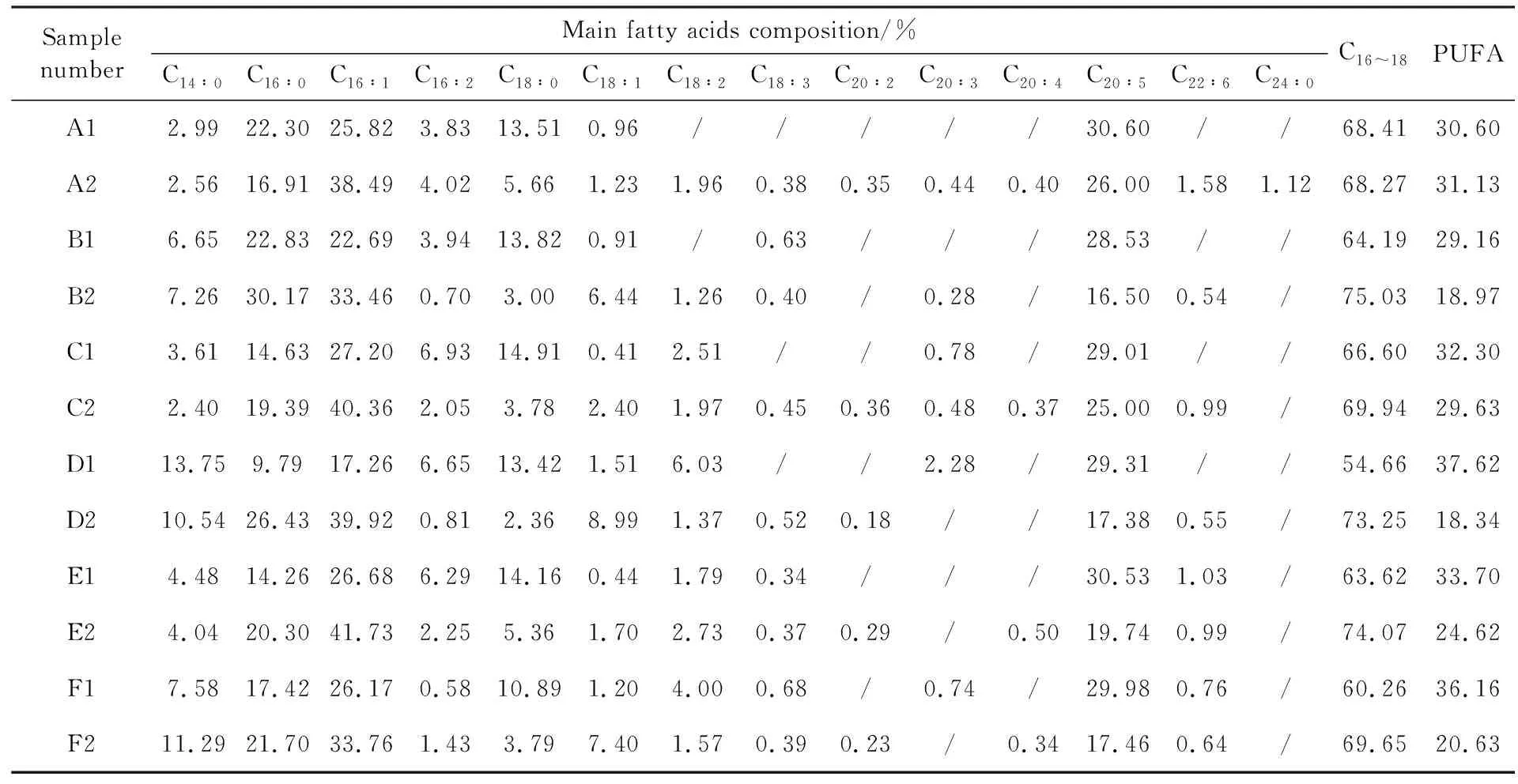
表2 不同处理组三角褐指藻的14种脂肪酸的相对含量
脂肪酸成分的定量分析均采用面积归一法进行分析,将峰面积小于0.05%的峰忽略不计,上述14种脂肪酸甲酯的成分定量分析见表2.结果表明,其中的C14∶0、C16∶0、C16∶1、C18∶0、C18∶2和C20∶5的含量在总的脂肪酸甲酯中占主要部分(均在某一时期含量超过2%),故这6种脂肪酸是三角褐指藻中的主要脂肪酸.
三角褐指藻中C16∶0和C16∶1的含量均会在生长过程中增加,而C18∶0和C20∶5的含量则会大幅减少,这种结果体现为稳定期相较于对数生长期,C16~18含量增加,而PUFA的含量减少,有利于生物柴油相关组分的积累.其中变化最为明显的是甘油兼养的GKOE,从对数生长期到稳定期的过程中,其C16~18的含量从54.66%增加到了73.25%,PUFA的含量则从37.62%下降到18.34%.
由于各脂肪酸甲酯为同系物,取相对校正因子为1,计算总脂肪酸产量公式如式(5):
(5)
稳定期时甘油兼养的GKOE的总脂肪酸产量为0.052 mg/mL,比甘油兼养的WT(0.038 mg/mL)和GKRNi(0.047 mg/mL)分别高了36.84%和10.64%,差异显著.
4 讨 论
本文研究所用的GKOE藻株与GKRNi藻株的构建方法为将过表达载体PtrGKOE-pPhaT1与干扰载体PtrGKRNAi-pPhaT1转化至大肠杆菌后通过基因枪法打入野生型三角褐指藻中.其中过表达载体主要包含fcpA启动子、GK基因的开放阅读框ORF、fcpA终止子、fcpB启动子、博来霉素抗性基因shble、硝酸还原酶终止子;干扰载体主要包含fcpA启动子、GK基因约430 bp碱基正向序列、内含子、GK基因约430 bp碱基反向序列、fcpA终止子、fcpB启动子、博来霉素抗性基因shble、硝酸还原酶终止子.经构建得到的GKOE中GK基因的转录水平较WT上调7.9倍,甘油激酶活性是WT的5.55倍;而GKRNi中GK基因的转录水平相比WT下调53.34%,甘油激酶活性降低52.34%,故三角褐指藻中甘油激酶活性与GK基因转录水平呈正相关关系[12].但在正常培养条件下,WT、GKOE与GKRNi的生物量却并没有明显差距,与本文研究相吻合,证明甘油激酶并不会在正常培养条件下对三角褐指藻的生长产生显著性影响.而甘油兼养的条件下,WT、GKOE与GKRNi的生物量、油脂含量、TAG含量和脂肪酸产量相较正常培养条件下的同种藻株均有显著性的提升,说明外源甘油的添加有利于三角褐指藻的生长与油脂积累,其中同化外源甘油的第一个关键酶则是甘油激酶.
Muto M等在产油硅藻Fistuliferasolaris中过表达了内源性的甘油激酶可以使藻株的甘油利用率增加、脂质合成增强[19],而本研究所呈现的结果表明在甘油兼养条件下,GKOE相比WT以及GKRNi,生物量、油脂含量、TAG含量以及脂肪酸产量都会大幅度增加,说明通过提高GK基因的表达量确实有助于三角褐指藻的油脂积累.此时GKOE中GK基因的表达量与甘油激酶活性相较于WT均升高,结合Abida H[20]、高莉[21]与赵佩佩[22]等的研究发现三角褐指藻在缺氮条件下GK基因表达量上调,且糖酵解途径、三羧酸循环与脂肪酸合成途径相关蛋白表达水平均上调,结果是三角褐指藻藻细胞中油脂含量增加,TAG含量增多.不同于缺氮条件下三角褐指藻的生物量增加缓慢,甘油兼养的GKOE的藻细胞数量也会大幅增加,原因可能是因为在添加外源甘油的情况下GKOE中GK基因表达量的升高更加有利于外源甘油的利用,增加甘油-3-磷酸(Gly3P)的生成,同时增加糖酵解终产物丙酮酸的生成,但是因为有机碳源与氮源充足,此条件下生物量以及油脂含量的增加主要是外源甘油中的碳所贡献的,而非光合作用固定的碳.
而甘油兼养条件下GKRNi相比WT,生物量、油脂含量、中性脂质含量却没有什么明显差异,结合高莉[21]与陈波[10]的研究,此时GKRNi中的甘油激酶活性与GK基因表达量相较于WT均下调,GKRNi对培养基中的外源甘油利用减少,但是光合作用固碳却相较WT增加了,在甘油浓度为20 mmol/L的培养基中,同化的外源甘油与CO2的总量与WT相当,故从生物量、油脂含量以及中性脂质含量看不出显著性差异,随着甘油浓度加大到100 mmol/L,GKRNi的生物量较WT将会出现显著性差异,这也需要后续实验的验证.
通过对脂肪酸成分的分析,发现三角褐指藻从对数生长期到稳定期的过程中会大量积累C16∶0和C16∶1,尤其是甘油兼养的GKOE,其累积量更大,C16~18的含量可以达到73.25%,且PUFA的含量降低到18.34%,而高含量的C16~18与低含量的PUFA正是有利于生物柴油的研发的.虽然各组分含量与甘油兼养的WT差异不大,但是因为GKOE的总脂肪酸产量达到0.052 mg/mL,显著高于WT的0.038 mg/mL,所以相比WT来说更有利于开发生物柴油.

