蜜蜂球囊菌菌丝和孢子的比较转录组分析
蒋海宾,杜 宇,范小雪,王 杰,祝智威,范元婵,熊翠玲,付中民,2,徐国钧,2,陈大福,2,郭 睿,2
(1.福建农林大学动物科学学院(蜂学学院), 福州 350002;2. 福建农林大学蜂产品加工与应用教育部工程研究中心, 福州 350002)
1 引 言
蜜蜂作为最重要的授粉昆虫,在农业生产、生态保护和生物多样性维持等方面具有至关重要的作用.但蜜蜂的群居性特点使其健康易受到多种传播性病虫害的威胁.其中,白垩病是一种由蜜蜂球囊菌(Ascosphaeraapis,简称球囊菌)侵染蜜蜂幼虫而导致的蜜蜂真菌病,现已成为影响养蜂生产的一大顽疾.近期,有研究表明球囊菌对中华蜜蜂(Apisceranacerana)雄蜂和工蜂幼虫[1]、成年熊蜂[2]也具有侵染性.不同性别的球囊菌菌丝通过异宗配合进行有性生殖产生孢子,孢子外部具有一层由几丁质和蛋白构成的致密孢子壁,能够抵御外界不良环境的影响.球囊菌作为寄生蜜蜂幼虫的专性真菌病原,在与宿主的长期协同进化过程形成了特殊的侵染模式.与白僵菌(Beauveria)[3]和绿僵菌(Metarhizium)[4]等子囊菌门的昆虫病原真菌不同,球囊菌不能通过菌丝从宿主体表进行侵染,其孢子经成年蜜蜂的哺育行为被蜜蜂幼虫经口摄入是其侵染宿主的唯一方式,孢子在宿主肠道内环境的刺激下低水平萌发,并生长为具有致病性的菌丝体,期间分泌几丁质酶、蛋白酶、脂酶及次级代谢物等毒力因子共同抑制宿主的免疫防御系统,进而降解围食膜、肠壁和体壁,最终在预蛹期穿透尾部,逐渐蔓延包裹整个虫尸[1].到目前为止,尚缺乏有效治疗白垩病的手段.有关球囊菌菌丝和孢子生长、发育和生殖的分子机理仍不明了.因此,在实验室条件下对球囊菌进行纯培养,通过比较转录组的方法分析孢子和菌丝的共有基因、特有基因和差异表达基因(differentially expressed gene,DEG),并深入探讨上述基因在菌丝和孢子中的潜在作用以及与球囊菌致病性的关系,可为阐明球囊菌菌丝和孢子的生长、发育和生殖的分子机理提供有价值的参考信息和必要的数据基础.
前人对球囊菌的研究涉及培养方法、流行病学、生态学、增殖方式、病理学、疾病防治及免疫防御等方面[5-8].温度、酸碱度(pH)、维生素等营养生态条件显著影响球囊菌的萌发、生长及产孢过程[9].球囊菌是第一个完成基因组测序的的昆虫真菌病原体,Qin等[10]于2006年组装并公布了球囊菌基因组的序列信息,但作者当时未公布基因注释信息.2012年,Cornman等[11]利用Roche 454焦磷酸测序技术对纯培养的球囊菌菌丝和被球囊菌感染的西方蜜蜂(Apismellifera)幼虫体表长出的菌丝进行转录组测序和比较分析,结果显示DEG涉及病原的交配繁殖、应激反应、毒力因子和信号传导等通路.2016年,Shang等[12]对包括球囊菌在内的7种昆虫病原真菌的基因组进行denovo组装和注释,通过系统分析揭示了真菌致病性的演化模式.前期研究中,笔者所在课题组围绕球囊菌开展了一系列的组学和分子生物学研究,基于高质量转录组数据组装和注释了球囊菌的参考转录组,并大规模挖掘了病原的SSR位点[13];利用链特异性建库的lncRNA-seq和small RNA-seq技术对纯培养的球囊菌菌丝和孢子混合样品进行测序,基于高质量的全转录组数据对球囊菌的微小RNA(microRNA,miRNA)[14]、长链非编码RNA(long-non coding RNA,lncRNA)[15]和环状RNA(circular RNA,circRNA)[16]及调控网络进行了全基因组鉴定和分析.近期,Chen等[17]利用PacBio单分子实时测序技术对球囊菌菌丝进行了深度测序,基于全长转录组数据重构了球囊菌的参考转录组,可为球囊菌组学和分子生物学研究的深入开展提供关键数据支撑.
球囊菌的菌丝和孢子是病原的两种不同形态,二者的共有基因、特有基因和DEG与病原的生长、发育、生殖和致病性密切相关.本研究利用链特异性建库的RNA-seq技术对纯培养的球囊菌菌丝和孢子分别进行测序,通过比较转录组分析筛选菌丝和孢子的共有基因、特有基因和DEG,并进行GO分类和KEGG通路富集分析,以期明确球囊菌菌丝和孢子的基因表达差异,挖掘球囊菌生长、发育、生殖及病原致病性相关的重要信息.
2 材料和方法
2.1 供试生物材料
球囊菌菌株[13]由福建农林大学动物科学学院(蜂学学院)蜜蜂保护学实验室分离和保存.
2.2 球囊菌培养及测序样品制备
将实验室保存的球囊菌孢子转接至10块PDA固体培养基上,置于生化培养箱,在33±0.5 ℃条件下培养.为避免样本菌丝和孢子之间的交叉污染,首先在超净台中将培养7 d的培养基表面最上层的白色菌丝小心刮至RNA-free的EP管(共计100 mg),避免接触与孢子囊接触的菌丝,然后进行显微制片和镜检(不含黑色孢子),即为球囊菌的纯净菌丝.将菌丝样品(AaM)放入液氮速冻后迅速移至-80 ℃超低温冰箱保存备用.
利用接种环将覆盖在孢子囊上的薄层菌丝小心刮去,更换接种环并将剩余孢子囊刮至RNA Free的EP管中,加入适量无菌水震荡混匀;7 000 g离心3 min,因球囊菌孢子密度较大而沉在底部,弃上清,无菌水重悬孢子沉淀,重复三次;取少量孢子悬液进行显微制片和镜检,400倍视野下可见较多游离的成熟孢子且未见菌丝,即为球囊菌的纯净孢子;将各管孢子集中于一个RNA Free的EP管(共计100 mg);再将孢子样品(AaS)放入液氮速冻后迅速移至-80 ℃超低温冰箱保存备用.
2.3 RNA提取、cDNA文库构建及深度测序
将上述球囊菌菌丝样品和孢子样品分别置于两个干净的研钵(DEPC水预处理),加入液氮充分研磨.利用RNA提取试剂盒(AxyPrepTM Multisource Total RNA Miniprep Kit)(TaKaRa公司,日本)分别提取AaM和AaS的总RNA,去除其中的核糖体RNA(rRNA),加入Fragmentation buffer将其打断成短片段,再以短片段的RNA为模板,用六碱基随机引物(Random hexamers)合成cDNA第1链,加入缓冲液、dNTPs(dUTP代替dTTP)、RNase H2O和DNA polymerase Ⅰ合成cDNA第2链,经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱经末端修复、加碱基A,加测序接头,然后通过UN(Uracil-N-Glycosylase)酶降解第二条链.用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增.将建好的cDNA文库委托广州基迪奥生物科技有限公司进行双端(paired-end)测序,测序平台为Illumina HiSeq 4000.测序数据已上传到NCBI SRA数据库,BioProject号:PRJNA560452.
2.4 测序数据质控及参考基因组比对
为保证测序数据的质量,对于测序下机的原始读段(raw reads)进行过滤,去除含有接头序列的reads,全部都是A的reads,含未知碱基(N)比例大于10%的reads及低质量的reads(质量值Q≤20的碱基数占整条reads的50%以上),得到有效读段(clean reads).使用短reads比对工具bowtie 2将clean reads比对到核糖体数据库(不允许错配),去除比对上的clean reads;将未比对上的clean reads继续比对球囊菌基因组(assembly AAP 1.0),将比对上的clean reads用于转录本的组装及分析.
2.5 共有和特有基因的筛选及分析
根据FPKM(Fragment Per Kilobase of per Million Mapped Reads)法计算基因表达量,公式为FPKM=Total exon fragment/[Mapped fragment (millions) × exon length (KB)].利用OmicShare在线工具集合(http://www.omichsare.com)对AaM和AaS中的基因进行Venn分析,筛选出共有基因和特有基因.利用WEGO软件对共有基因和特有基因进行GO(Gene Ontology)分类.利用Blast工具将共有基因和特有基因分别映射到KEGG(Kyoto Encyclopaedia of Genes and Genomes)数据库(http://www.kegg.jp),进而统计基因显著性富集的通路(pathway).
2.6 差异表达基因(DEG)分析
利用edgeR软件对AaM vs AaS比较组的DEG进行筛选,筛选标准为P≤0.05且|log2fold change|≥1.按上述方法对分别对DEG进行GO分类和KEGG通路富集分析.
2.7 DEG的RT-qPCR的验证
随机选取6个DEG(5个上调基因和1个下调基因)进行RT-qPCR验证.其中,上调基因分别为:铁载体转运蛋白酶编码基因(KZZ91599.1)、核糖体生物发生蛋白酶编码基因(KZZ88689.1)、核糖体生物合成ATP酶 RIX7编码基因(KZZ97232.1)、ABC转运体编码基因(KZZ88904.1)和Fe3+ABC 转运蛋白底物结合蛋白编码基因(KZZ89047.1);下调基因为:铁载体转录因子SreA酶编码基因(KZZ89485.1).根据所选DEG的序列信息,利用Primer Primer 6软件设计特异性的上游(F)引物和下游(R)引物,委托上海生物工程有限公司进行引物合成.选择球囊菌5.8s rRNA基因(GenBank:U68313.1)作为内参.利用RNA抽提试剂盒(天漠生物,中国)分别提取孢子和菌丝的总RNA,利用oligo(dT)引物进行反转录得到相应的cDNA,作为模板进行RT-qPCR.RT-qPCR反应体系(20 μL)包含:SYBR Green Dye 10 μL,F引物1 μL,R引物1 μL,DNA模板1 μL,DEPC水补至20 μL.进行PCR扩增,反应条件:95 ℃ 1 min,95 ℃ 15 s,55 ℃ 60 s,共40个循环,溶解曲线默认系统程序.采用2-△△Ct法计算DEG在AaM vs AaS比较组的相对表达量.每个反应进行3次生物学重复和3次技术重复.最后利用GraphPad Prism 7软件进行qPCR结果的检验及绘图.本研究使用的引物序列信息详见表1.

表1 RT-qPCR引物信息
3结果与分析
3.1 深度测序数据的质控与评估
球囊菌菌丝(AaM)和孢子(AaS)的RNA-seq分别得到108 614 646和105 675 408条raw reads,经质控得到的clean reads分别为107 780 032和104 621 402条.AaM和AaS两端Q30(99.9%碱基正确率)均在95.78%及以上.此外,AaM和AaS的序列比对参考基因组的mapping率分别为85.81%和84.94%.上述结果共同表明本研究获得的测序数据质量良好,可满足后续分析.
3.2 共有基因和特有基因的GO和KEGG分析
在AaM和AaS中分别检测到7 557和7 640个表达基因.Venn分析结果显示共得到7 835个基因,其中AaM和AaS的共有基因数为7 362个,二者的特有基因数分别为195和278个.
AaM和AaS的共有基因涉及44个功能条目,其中共有基因富集数前10位的条目分别为代谢进程(1 284)、细胞进程(1 284)、催化活性(1 161)、细胞(1 055)、细胞组件(1 054)、单组织进程(977)、结合(836)、细胞器(700)、大分子复合物(395)、定位(320).AaM的特有基因涉及13个条目,包括催化活性(4)、细胞(3)、细胞组件(3)、结合(3)、单组织进程(2)、细胞器组件(2)、细胞器(2)、代谢进程(2)、细胞进程(2)、转运器活性(1)、细胞膜(1)、大分子复合物(1)和定位(1).AaS的特有基因涉及生物学进程和分子功能相关的6个条目,分别为单组织进程(2)、催化活性(2)、多细胞生物进程(1)、发育进程(1)、代谢进程(1)和细胞进程(1).括号内的数字代表富集在该条目的基因数.
此外,AaM和AaS的共有基因涉及21类通路,富集共有基因数最多的是代谢总览(35.9%),其次为代谢的辅助因子和维生素(9.1%)、翻译(8%)、氨基酸代谢(7.5%)、折叠、分类和降解(6.1%)以及运输和分解代谢(5.1%)等(图1).进一步分析发现,上述21类KEGG通路涉及122条通路,其中在次级代谢物的生物合成(362)、内吞作用(79)、甘氨酸、丝氨酸和苏氨酸的代谢(41)和MAPK信号通路-酵母(33)等通路上富集大量基因.AaM的特有基因富集在51条通路,富集特有基因数最多的是代谢途径(13),其次为泛素介导的蛋白水解(4)和内吞作用(4)等.AaS特有的基因富集在55条通路,富集特有基因数最多是代谢途径(16),其次为减数分裂-酵母(5)和嘧啶代谢(5)等.
3.3 DEG的GO和KEGG分析
AaM vs AaS比较组共含有1 664个DEG,包括977个上调基因和687个下调基因.GO分类结果显示,上调基因涉及15条生物学进程相关条目;11条细胞组分相关条目以及6条分子功能相关条目;下调基因涉及12条生物学进程相关条目;12条细胞组分相关条目以及8条分子功能相关条目(图2).
进一步对上述DEG进行KEGG通路富集分析,显著富集在113条通路上,按显著性排序依次为:糖酵解/糖异生(31)、次级代谢物的生物合成(99)、不同环境下微生物代谢(65)、氨基酸的生物合成(45)、丙酮酸代谢(21)、代谢途径(182)、抗生素的生物合成(72)、碳代谢(40)、脂肪酸代谢(14)、苯丙氨酸代谢(9)等(表2).
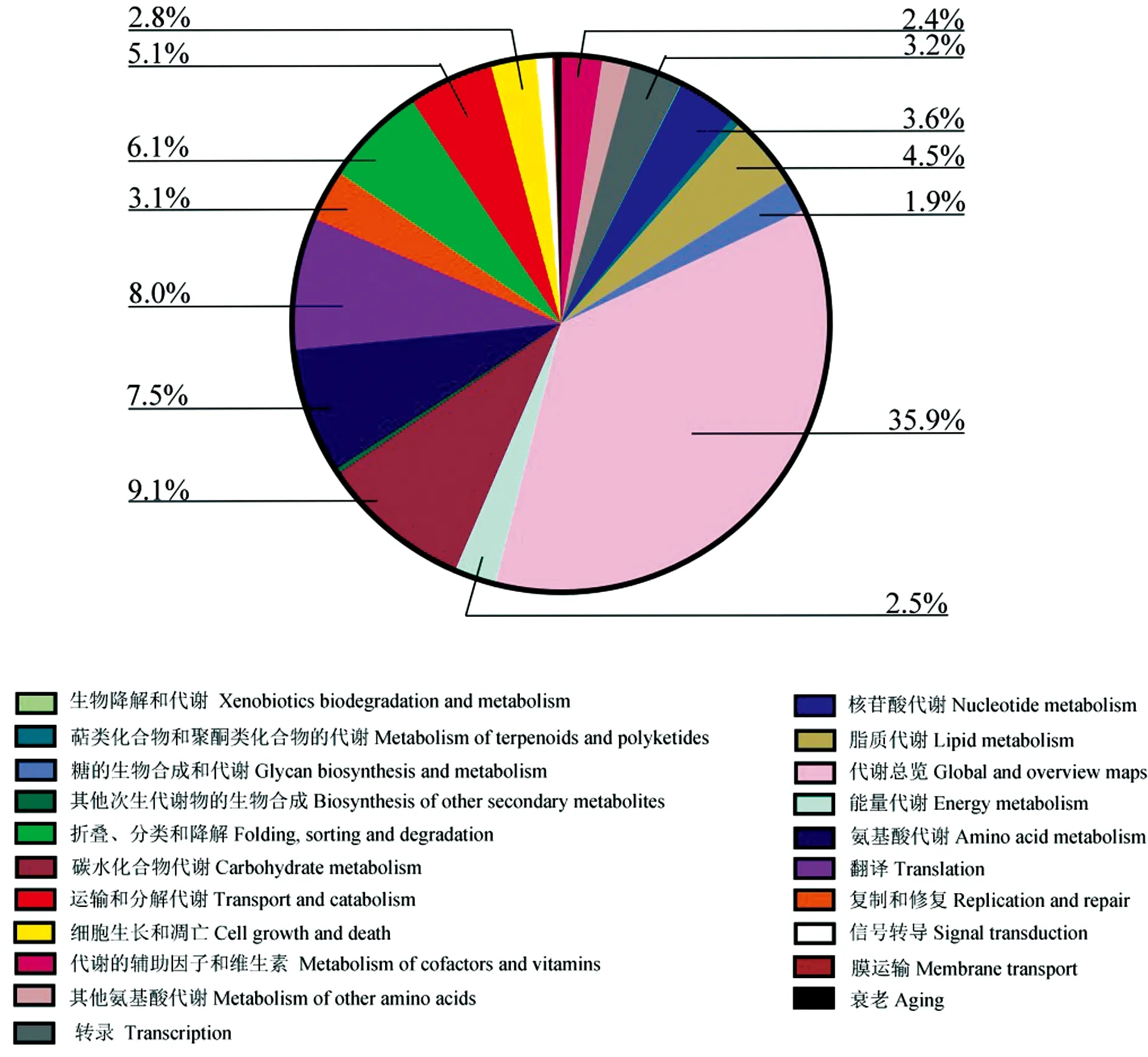
图1 球囊菌菌丝和孢子共有基因的KEGG数据库注释Fig.1 KEGG database annotation of common genes in A.apis mycelium and spore
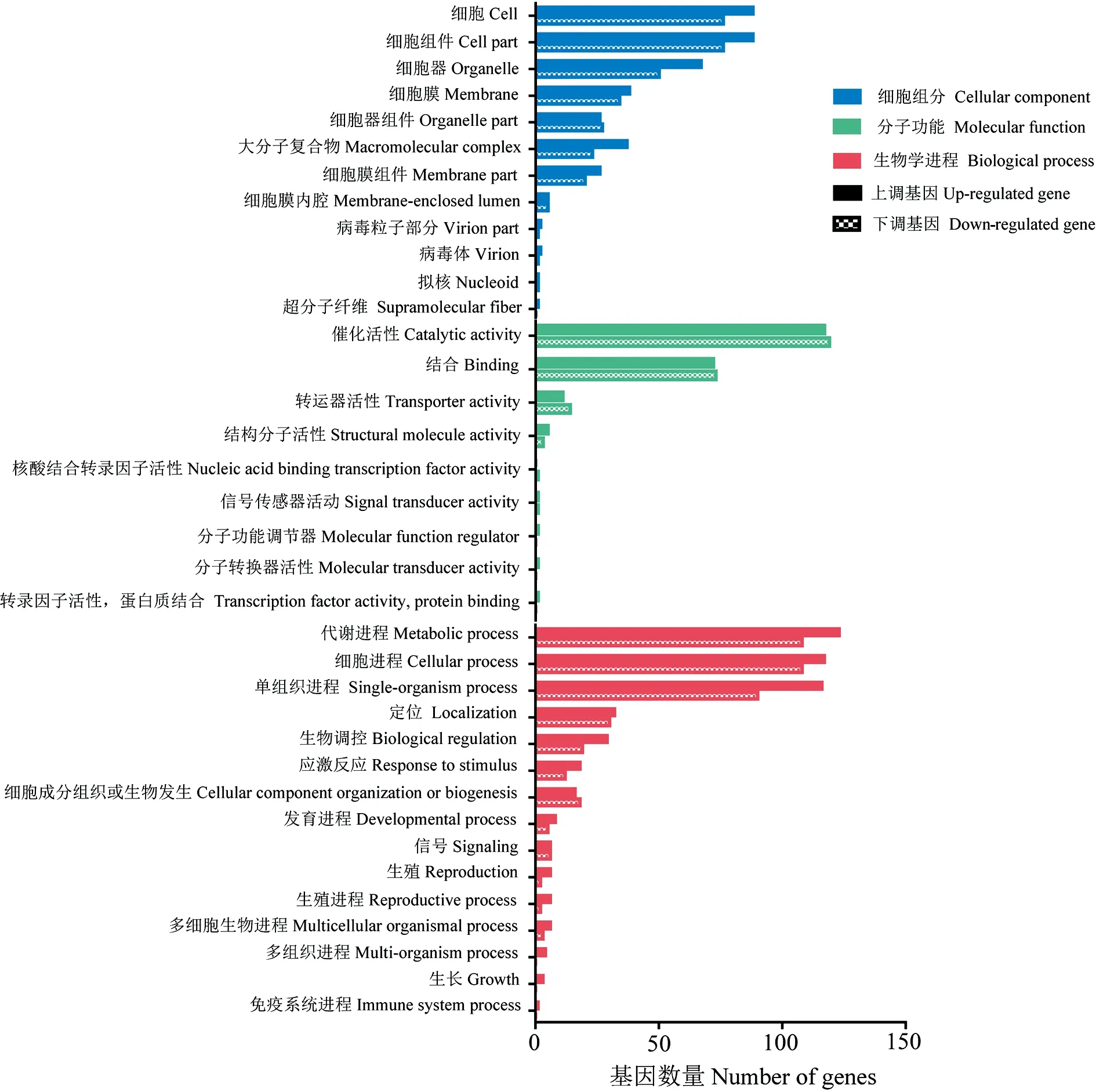
图2 AaM vs AaS比较组中DEG的GO数据库注释Fig.2 GO database annotation of DEGs in AaM vs AaS comparison group
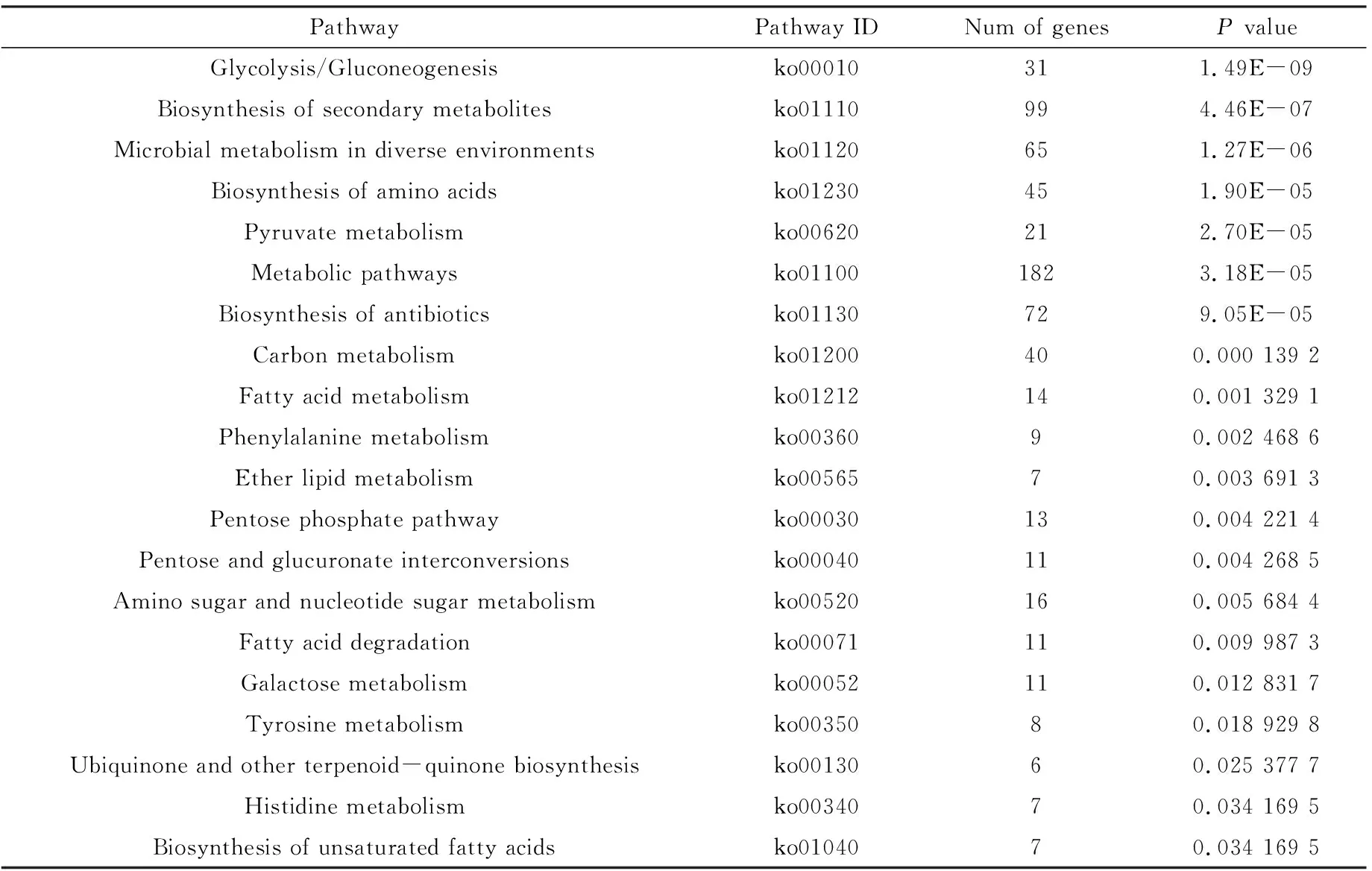
表2 AaM vs AaS比较组中DEG富集数前20位通路
3.4 DEG的通路富集网络构建及分析
根据Nr数据库的蛋白功能注释信息,筛选内吞作用,次级代谢物的生物合成,赖氨酸、丝氨酸和苏氨酸代谢,MAPK信号通路相关的DEG,并利用Cytoscape软件构建及可视化上述DEG与通路之间的富集网络,分析发现KZZ98057.1、KZZ87090.1、KZZ90651.1、KZZ90058.1、KZZ90024.1、KZZ92664.1、KZZ98218.1和KZZ92771.1等8个DEG同时富集在甘氨酸、丝氨酸和苏氨酸代谢及次级代谢物的生物合成,KZZ89869.1同时富集在次级代谢的生物合成与内吞作用,而KZZ96974.1同时富集在内吞作用与MAPK信号通路(图3).
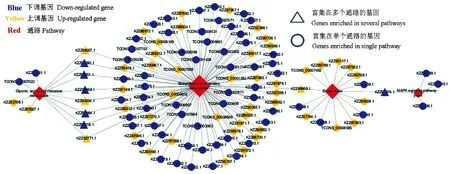
图3 AaM vs AaS比较组中DEG及富集通路的关系网络Fig.3 Relationship network between DEGs and their enriched pathways in AaM vs AaS comparison group
3.5 DEG的RT-qPCR的验证
RT-qPCR检测结果显示6个DEG的表达水平变化趋势与测序数据中相应的表达水平变化趋势一致(图4),证明了本研究中的转录组数据和基因差异表达的可靠性.
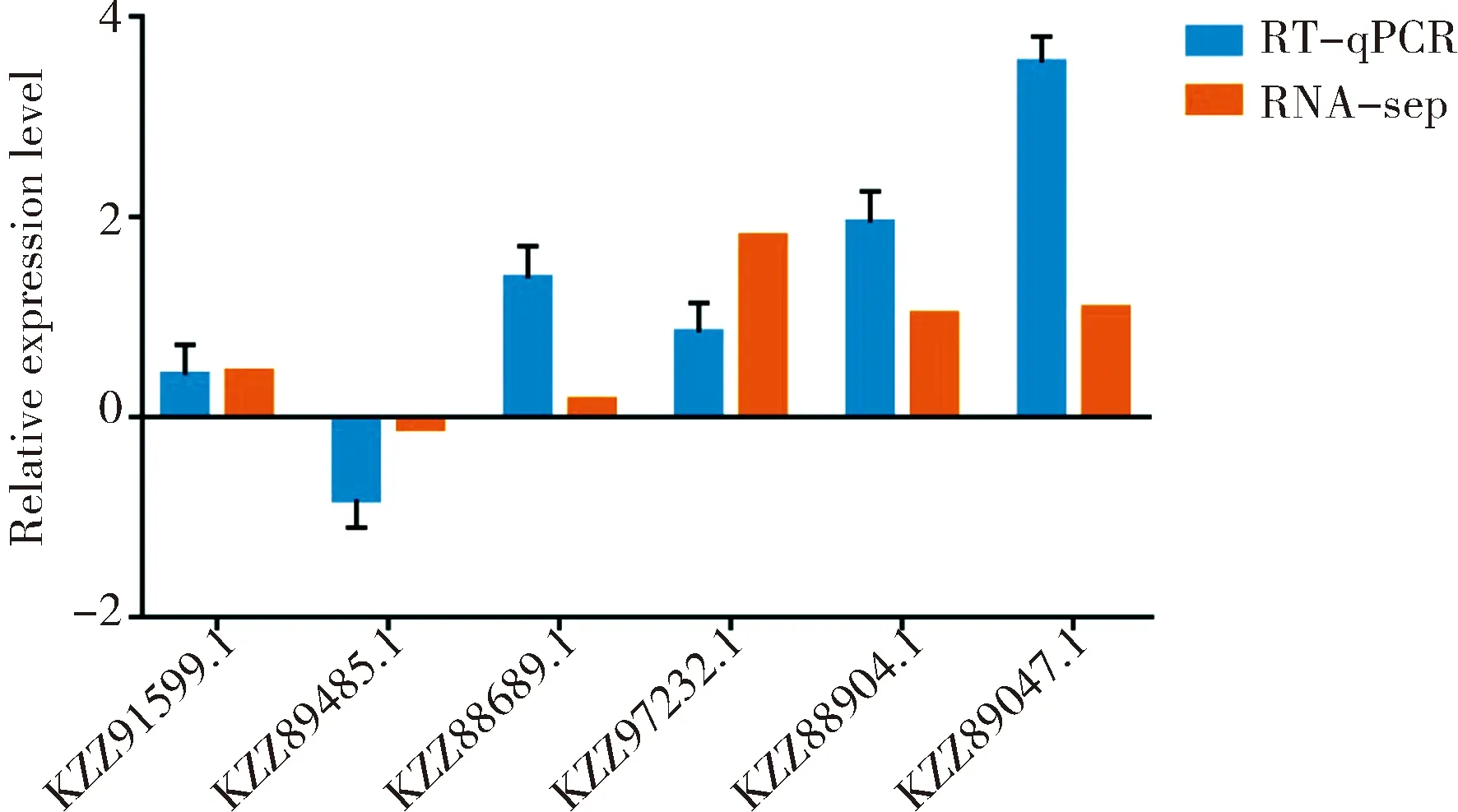
图4 DEG的RT-qPCR验证Fig.4 RT-qPCR validation of DEGs
4 讨 论
为在全基因组水平最大限度鉴定球囊菌的ncRNA,GUO等[14-16]利用链特异性建库的RNA-seq和sRNA-seq技术,对球囊菌菌丝和孢子的混合样品进行了全转录组测序,系统预测、分析和验证了球囊菌的miRNA、lncRNA和circRNA.由于测序数据同时包含菌丝数据和孢子数据,导致无法准确区分仅来源于菌丝的数据或仅来源于孢子的数据,限制了菌丝生长、孢子萌发、有性生殖等方面的数据挖掘和进一步深入分析.本研究通过比较转录组分析和挖掘球囊菌生长、发育、生殖及病原致病性相关的共有基因、特有基因、DEG以及功能条目和通路富集信息,并探讨相关分子机理.
4.1 球囊菌菌丝和孢子的共有基因与特有基因广泛参与球囊菌细胞活动和新陈代谢等诸多生物学过程
真菌孢子应对外界不良环境时处于低代谢水平的休眠态,而适宜条件可刺激孢子萌发生长为代谢旺盛的菌丝体.Aronstein等[5]曾对球囊菌孢子和菌丝的超薄切片进行扫描电镜观察,发现二者的细胞质中均存在大量的核糖体和线粒体.本研究发现,AaM和AaS的共有基因涉及代谢途径(813)、次级代谢物的生物合成(362)、碳代谢(131)、核糖体(126)及氧化磷酸化(70)等122条通路,表明相关共有基因广泛参与和维持了球囊菌菌丝和孢子状态下生存所需的物质和能量代谢.
对于真菌病原,其孢子具有一层由几丁质和蛋白质构成的致密孢子壁,能够有效抵御宿主免疫系统的进攻,而菌丝能够高效利用宿主营养满足自身繁殖所需的物质和能量.几丁质合成酶参与真菌细胞壁的合成过程,并在维持真菌细胞形态、致病性和抗逆性方面发挥关键作用[18].Kong等[19]研究发现几丁质合成酶参与了稻瘟病病原(Magnaportheoryzae)附着胞的形成过程,并能维持病原的生长发育和致病性.球囊菌在侵染意蜂6日龄幼虫肠道过程中,部分几丁质合成酶相关基因差异表达,暗示它们与球囊菌的致病性存在潜在联系[20].本研究中,AaM和AaS的13个共有基因涉及几丁质的合成过程,包括几丁质合成酶-1编码基因TCONS_00003150(log2fold change=0.37,P=8.40E-12)、真菌几丁质合成酶基因KZZ93915.1(log2fold change=-13.98,P=6.71E-99)、几丁质合成酶VI类编码基因KZZ93066.1(log2fold change=2.10,P=1.04E-09)等,推测上述几丁质酶合成相关基因在球囊菌孢子和菌丝的生长、发育、致病性以及细胞形态维持等方面具有一定功能.
本研究中,AaM的特有基因有195个,包括细胞极性蛋白编码基因KZZ92240.1(log2fold change=-14.22,P=3.57E-215)、P型ATP酶编码基因KZZ94064.1(log2fold change=-14.72,P=3.60E-225)和细胞极性蛋白编码基因KZZ92240.1(log2fold change=-14.22,P=3.57E-215)等,可富集到代谢途径(13)、泛素介导的蛋白水解(4)、内吞作用(4)、次级代谢物的生物合成(4)、核糖体(4)等51个通路;AaS的特有基因为278个,包括葡萄糖苷酶编码基因KZZ93178.1,(log2fold change=15.07,P=2.18E-134)、二烯内酯水解酶编码基因TCONS_00000462(log2fold change=16.08,P=2.90E-84)和含FHA结构域蛋白编码基因KZZ90006.1(log2fold change=14.70076481,P=2.33E-72)等,可富集到代谢途径(16)、减数分裂-酵母(5)、嘧啶代谢(5)、次级代谢物的生物合成(5)、MAPK信号通路-酵母(3)等55个通路.上述结果表明菌丝和孢子的特有基因在球囊菌的不同生长阶段发挥不同的作用,并通过调节物质和能量合成及代谢、生殖相关通路满足菌丝和孢子的生长、发育和生殖过程的物质和能量需求.
4.2 球囊菌菌丝和孢子的DEG参与信号转导及次级代谢产物的等关键途径
球囊菌孢子和菌丝的DEG参与调控代谢进程、细胞进程、应激反应以及催化活性等过程,其中多糖分解进程(GO:0000272)、长链脂肪酸代谢进程(GO:0001676)、氨基酸跨膜转运(GO:0003333)等GO条目显著富集.另一方面,KEGG通路富集分析发现DEG显著富集在糖酵解/糖异生,次级代谢物的生物合成以及氨基酸的生物合成等关键通路,并参与甲烷代谢、氧化磷酸化、氮代谢等能量代谢途径,以及脂代谢、磷酸戊糖途径、氨基酸代谢等物质代谢途径.
昆虫的病原真菌可通过分泌丝裂原活化蛋白激酶(MAPK)、丝氨酸/苏氨酸蛋白激酶和金属蛋白酶等蛋白酶,配合各类脂酶以及次级代谢产物共同抑制或降解宿主防御分子,并维持真菌的细胞壁完整性、杂交产孢以及毒力水平[21].当病原真菌受到外界刺激后,其MAPK信号级联反应可引起下游靶基因的表达变化,从而调控真菌的交配繁殖和孢子的形成过程[22].本研究发现,丝裂原活化蛋白激酶MKC1编码基因KZZ86589.1(log2fold change=2.25,P=6.36E-13)、Db1结构域蛋白编码基因KZZ92335.1(log2fold change=1.22,P=3.82E-40)、Phox/Bem1p编码基因KZZ92336.1(log2fold change=1.35,P=4.24E-50)和小GTPase超家族编码基因KZZ96974.1(log2fold change=13.89,P=5.15E-15)富集在MAPK信号通路且均显著上调表达,说明上述4个基因在球囊菌的生长发育过程中被显著激活,进而通过调节MAPK信号通路影响球囊菌的生长、发育和生殖.丝氨酸/苏氨酸蛋白激酶作为真菌细胞生长、代谢和自噬的关键调控因子,主要通过调节核糖体生物合成、营养摄入和代谢进程以维持真菌细胞内稳态[23].李远东等[24]在M.robertsii中发现敲除丝氨酸/苏氨酸蛋白激酶Ark1基因可抑制其毒力水平并降低其产孢量.本研究中,天冬氨酸激酶结构域蛋白编码基因KZZ98218.1(log2fold change=1.39,P=1.22E-112)、丝氨酸羟甲基转移酶编码基因KZZ92664.1(log2fold change=1.05,P=8.80E-57)和色氨酸合成酶编码基因KZZ87090.1(log2fold change=1.02,P=2.87E-23)等12个DEG富集在甘氨酸、丝氨酸/苏氨酸通路,暗示丝氨酸/苏氨酸代谢途径对球囊菌的孢子形成、菌丝生长具有调控作用,与球囊菌的毒力和致病性存在潜在关联.
次级代谢产物能显著影响真菌病原的形态分化、孢子萌发和致病性过程[25].前人研究发现玉米赤霉烯酮作为禾谷镰刀菌(Fusariumgraminearum)的次级代谢产物,可诱导F.graminearum分生孢子周围菌落的产生过程.拟幼虫芽孢杆菌(Paenibacilluslarvae)是一种严重威胁西方蜜蜂幼虫健康的致死性革兰氏阳性菌,可导致传染性极强的美洲幼虫腐臭病.P.larvae可合成与分泌非核糖体肽和肽-聚酮混合物等次级代谢产物对其他细菌和真菌产生抑制,从而在宿主营养物质的争夺中占据绝对优势[26].本研究中,葡萄糖苷酶编码基因KZZ93178.1(log2fold change=15.07,P=2.18E-134)、组氨醇磷酸酶编码基因KZZ90682.1(log2fold change=11.72,P=3.01E-06)和核糖/半乳糖异构酶编码基因KZZ87542.1(log2fold change=2.54,P=8.13E-143)等99个DEG富集在次级代谢产物的生物合成通路,表明上述DEG通过表达水平的调节对葡萄糖苷酶、组氨醇磷酸酶和丙酮酸激酶等各类次级代谢产物的合成进行调节,从而调控球囊菌菌丝形态分化和孢子萌发;上述次级代谢产物相关DEG与球囊菌的致病性存在潜在联系,并在其与其他病原微生物的种间竞争中可能扮演特定角色.需要强调的是,本研究的转录组数据来源是实验室条件下获得的球囊菌纯培养,从中挖掘出的相关信息仅能推测与病原致病性和毒力的潜在关联.下一步将基于球囊菌侵染蜜蜂幼虫肠道的全转录组数据,通过连续比对核糖体数据库、宿主基因组和病原基因组可获得处于侵染状态的球囊菌的组学数据,基于该组学数据分析得到的病原致病性和毒力相关信息更为真实可靠.
根癌农杆菌介导(AtMT)的真菌遗传转化为真菌基因的分离克隆和功能研究提供了新的途径.因其具有成本低、效率高、操作易和重复性好等优点,而广泛应用于白僵菌、绿僵菌和蜡蚧轮枝菌(VerticilliumLecanii)等昆虫病原真菌的基因功能研究[27].WANG等[28]利用根癌农杆菌介导技术对稻瘟病菌的致病基因MoCPS1进行研究,发现MoCPS1可显著影响稻瘟病菌的产孢及分生孢子的形态发生过程.目前,球囊菌的分子生物学研究相对滞后,其遗传转化技术体系还未建立起来,严重限制了球囊菌的基因功能研究.本研究筛选出的共有基因、特有基因和DEG的数量依然较多,下一步将结合球囊菌菌丝、孢子的miRNA、lncRNA、circRNA组学数据构建ncRNA与mRNA之间的调控网络,并根据本研究关注的重点通路及富集基因进一步构建和分析局部调控网络,筛选出若干居于核心位置的关键基因以及球囊菌菌丝和孢子的特异性表达基因,进而利用根癌农杆菌介导的真菌遗传转化技术深入开展相关功能研究.
综上所述,本研究通过比较转录组分析揭示球囊菌菌丝和孢子的共有基因、特有基因和DEG可能通过调节细胞活动,甘氨酸、丝氨酸和苏氨酸代谢,次级代谢产物合成,MAPK信号通路,以及内吞作用等关键途径参与球囊菌菌丝和孢子的生长、发育和生殖过程,研究结果为探明相关分子机制提供了基础.

