围垦对滨海稻田土壤N2O还原潜力的影响
汪方圆,张耀鸿,饶旭东,谢晴,贾仲君
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心/江苏省农业气象重点实验室,南京210044;2.中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京210008)
氧化亚氮(N2O)是三大温室气体之一,根据IPCC的评估报告,单位质量N2O 的百年尺度增温潜势是单位质量CO2的265 倍,对全球变暖的贡献约为6%[1]。目前大气中N2O 浓度为324 μg·L-1,并在过去30 a 中以0.73 μg·L-1·a-1的速度稳定增长,对全球气候和大气环境造成严重威胁,引起了人们对其源和汇的高度关注。研究发现,农业土壤是全球范围内最主要的N2O 来源,占人类活动排放量的44%[2]。迄今,有关不同地域、不同作物类型及不同农艺措施下的农田土壤N2O 排放通量方面已有大量研究报道[3]。然而,排放通量中的N2O 是土壤中N2O 产生过程和还原过程综合作用的动态净变量,反映不出土壤的N2O 还原潜力。因此,充分了解农田土壤N2O 最大还原潜力及影响因素对于全球N2O的减排具有重要意义。
N2O的生物合成途径以硝化和反硝化过程为主,而N2O的还原消耗过程却只有一个,即土壤微生物在氧化亚氮还原酶基因(nosZ)的催化下将N2O还原为N2的生物过程[4]。以往的研究发现,完全反硝化细菌具有将NO-3还原为N2的全部基因,包括nosZ基因,其呼吸过程是N2O消耗的主要原因。近来的研究显示,一些非反硝化细菌和古菌具有以N2O为唯一电子受体而生长的能力,表明具有N2O还原能力的微生物不局限于反硝化细菌范围,远比人们预期要丰富得多[5]。Sanford 等[6]和Jones 等[7]报道,除了存在于完全反硝化细菌的典型nosZ 基因(简称为nosZ Ⅰ)之外,还存在一种新型的非典型nosZ 基因(简称为nosZ Ⅱ),普遍存在于各种生态系统土壤生境中。与携带nosZ Ⅰ的完全反硝化微生物相比,具有nosZ Ⅱ基因的微生物在分类学上更加多样化,且绝大部分为非完全反硝化微生物,即只具有N2O还原能力而缺失N2O 产生功能[6-7],表明它们是一个更为广泛的微生物类群,这些微生物可能在全球N2O还原过程中发挥着重要作用。
围垦是一种重要的土地利用方式,将滨海滩涂围垦改为农田是解决我国土地问题的有效途径之一。根据中国国家海洋局的海洋功能区划报告,2011—2020 年间中国东部沿海地区围垦面积达到2 469 km2。崇明东滩湿地是我国长江口发育最完善的河口型滩涂湿地;自解放初至今,开展了多次围垦造田工程,形成了一系列不同围垦年限的围垦稻田。围垦后的湿地不再受潮汐的影响,与近海间的物质能量交换基本消失。其后的农业生产使围垦区生境发生显著变化[8-9]。这种土地利用方式改变了土壤生物地球化学过程,对土壤N2O 还原潜力可能会产生深刻影响。尽管有关该滨海湿地的反硝化过程研究已有大量报道,但是从N2O 净还原潜力角度研究滨海土壤N2O“源”或“汇”的报道十分鲜见。围垦改稻田后土壤中携带nosZ Ⅰ或nosZ Ⅱ基因的两类微生物如何变化?其对N2O 还原潜力有何影响?这些科学问题的探索对于深入了解围垦工程的生态效应至关重要。
基于此,本试验选取崇明东滩区域不同围垦年限的稻田为研究对象,以空间替代时间变化的方法,研究不同围垦年限条件下土壤N2O 还原潜力的空间变异特征,分析功能基因的数量特征,探明其与N2O 还原潜力的相关性,为合理评估我国沿海地区围垦造田的生态效应提供参考依据。
1 材料与方法
1.1 样品采集
土样采自上海市崇明岛东滩湿地和围垦区稻田(121.80° E,31.60° N),所属气候是典型的亚热带季风气候,年平均气温为15.3 ℃,降水量为1 004 mm。崇明岛东滩湿地位于崇明岛最东端,保护区内为自然湿地,保护区以西为一系列不同围垦种稻年限的稻田。本研究选取保护区内低位光滩自然湿地,作为围垦0 a 的原生态样点,以WK0 表示。在围垦区选取4处不同围垦年限,即围垦种稻19 a(WK19)、27 a(WK27)、51 a(WK51)、86 a(WK86)的稻田进行研究。不同围垦年限样点根据相关参考文献选取[10]。该区域农田为稻麦轮作方式,农田管理措施基本一致。2017年7月中旬采集样品,在每个围垦稻田样区中先选取50 m×50 m 的采样区,然后在采样区内以S形走线,沿线按照10~15 m 的间隔在水稻行间确定6个采样点,以提高样品的代表性。用土钻取0~20 cm耕层鲜土,将该6 个采样点的土壤均匀混合成1 个样本,重复3 次。土样装入冰盒内迅速转移至实验室,储存于4 ℃冰箱备用。
1.2 土样理化性质测定
土壤总有机碳采用浓硫酸-重铬酸钾消煮-硫酸亚铁滴定法测定;土壤全氮含量采用半微量凯氏定氮法测定;土壤铵态氮和硝态氮用2 mol·L-1KCl溶液浸提后,采用AA3 流动分析仪测定;土壤pH 采用水土比为2.5∶1提取后,用数字酸度计测定;土壤硫酸根含量采用离子色谱法测定;土壤可溶性盐度(EC)采用电导法用EC计测定。
1.3 N2O还原速率测定
采用厌氧培养试验进行测定。称取2.00 g 鲜土放入12 mL 的Labco 顶空瓶后加入2 mL 过0.45 m 滤膜的灭菌去离子水,用高密橡胶塞密闭瓶口,振荡5 min 形成均匀泥浆。用真空泵抽真空后置换高纯氩气,反复操作3 次以达到严格厌氧状态。预培养3 d,以尽可能去除瓶内残余氧的影响。预培养结束后,再进行抽真空-充氩气3 次,然后在顶空气体中置换500 μL N2O,室温25 ℃避光条件下厌氧培养6 d,期间从0时刻开始每24 h用100 μL微量采样器采气,气体样品采集后立即补入相同量的高纯氩气以保证瓶内气压平衡。采集的气体用装有电子捕获检测器(ECD)的气相色谱仪(Agilent 7890)分析N2O 浓度。根据不同时间点的瓶内顶空N2O 浓度值进行线性回归,计算出厌氧培养期间的平均N2O还原速率。
1.4 相关基因丰度测定
将野外采集的原状鲜土冷冻干燥后,采用FastDNA Spin Kit for Soil 试剂盒(MP Biomedicals,美国)提取土壤微生物基因组DNA。称取0.5 g土样,按照说明书的步骤提取土壤微生物总DNA,溶解于100 μL 无菌TE 缓冲液(10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,pH 8.0)。通过微量紫外分光光度计(Nano⁃Drop ND-1000,美国)测定DNA 浓度和纯度,并利用1%的琼脂糖凝胶电泳检测DNA的完整性,满足条件后用于qPCR分析。
实时PCR 扩增所用仪器为CFX96 Real-Time PCR System(Bio-Rad 公司)。标准曲线分别用含16S rRNA 、nosZ Ⅰ和nosZ Ⅱ基因的质粒为模板,并将其连续稀释8 个数量级配制。定量PCR 扩增反应体系为20 μL,包括:10 μL 的SYBR Premix EX TaqTM,1.0 μL 土壤总DNA 模板,上、下游引物(10 pmol·μL-1)各0.5 μL,加灭菌水至20 μL。16S rRNA 基因和nosZ 基因PCR 引物及qPCR 的循环条件见表1。所有样品重复3次,并采用灭菌双蒸水代替DNA作为反应模板设置阴性对照。
1.5 数据处理
采用SPSS 21.0 软件进行数据的统计分析。N2O还原速率、基因拷贝数的差异性比较采用单向方差分析和最小差值法。N2O 还原速率与功能基因丰度、土壤理化性质的关系采用线性回归分析拟合。图形制作采用Excel 2016和Origin 9.5软件完成。
2 结果与分析
2.1 土壤理化性质变化特征
围垦稻田土壤总有机碳含量(TOC)在9.54~18.34 g·kg-1,显著高于未围垦的光滩湿地,且随围垦年限增加而显著增加(表2)。围垦19.51 a,稻田与光滩湿地的土壤总氮含量(TN)没有达到显著差异。围垦27、51 a 和86 a 的稻田土壤含量显著高于围垦19 a的稻田和光滩湿地(P<0.05)。围垦稻田土壤含量在8.86~18.67 mg·kg-1,随围垦年限增加而显著增加(P<0.05)。光滩湿地土壤pH 值浓度和EC 值均显著高于围垦稻田(P<0.05),且在围垦稻田中这些指标均随围垦年限增加而呈逐渐下降的趋势。

表1 qPCR引物及循环条件Table 1 List of primers and thermal cycling conditions used for16S rRNA and nosZ clade Ⅰand Ⅱgenes
2.2 土壤N2O还原速率
本培养试验中,培养瓶密闭气体中N2O 的起始浓度约为6×104μmol·mol-1,如此高浓度的气体底物可以反映出土壤的最大N2O 还原潜力。随后,水稻土上层密闭空间中的N2O 浓度随着厌氧培养时间的延长均呈现明显的下降趋势。将气体浓度变化与培养时间进行回归分析,可计算出培养时间内的平均N2O 还原速率。结果显示,土样WK0、WK19、WK27、WK51和WK86 的N2O 消耗速率分别为16.08、21.16、23.08、22.46 μg N2O·g-1·d-1和25.47 μg N2O·g-1·d-1(图1)。与光滩湿地(WK0)相比,围垦植稻86 a 的稻田土壤N2O 消耗速率增加了58.4%,显著高于光滩湿地(P<0.05)。围垦19、27、51 a 的稻田N2O 消耗速率无显著差异,但均显著高于光滩湿地(P<0.05),分别比光滩湿地N2O消耗速率高出31.6%、43.5%和39.6%。
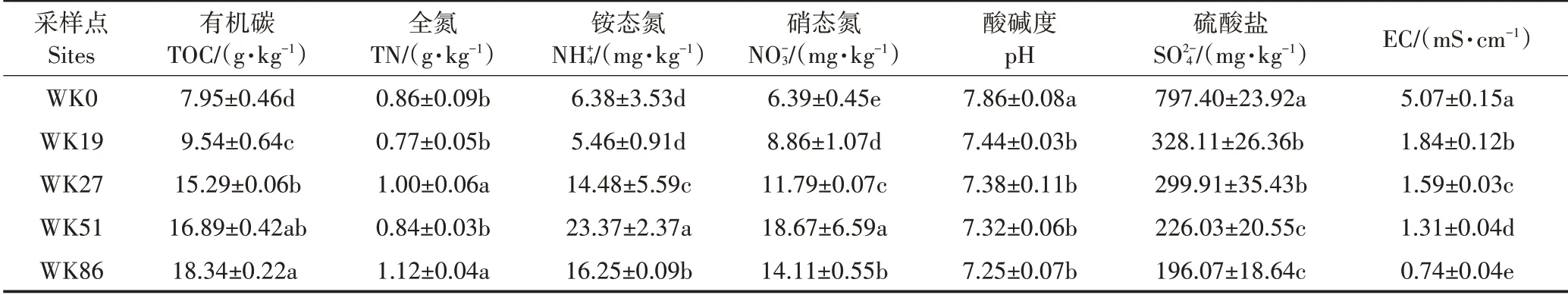
表2 不同围垦年限土壤的理化性质Table 2 Physicochemical properties of soils with different reclamation years
2.3 功能基因nosZ及细菌16S rRNA丰度变化
图2 显示,N2O 还原功能基因nosZ Ⅰ拷贝数随围垦年限增加而显著增加(P<0.05),其中围垦86 a的稻田土壤nosZ Ⅰ拷贝数为1.72×108copies·g-1,比光滩湿地(WK0)和围垦19 a 的稻田(WK19)高出一个数量级。nosZ Ⅱ基因拷贝数在光滩湿地和围垦19 a土样之间差异不显著,且均显著低于围垦27、51 a和86 a稻田土壤(P<0.05),其中围垦86 a的稻田土壤nosZ Ⅱ拷贝数为4.36×108copies·g-1,比WK0和WK19土壤高出一个数量级。进一步分析发现,5 个土样的nosZ Ⅰ/nosZ Ⅱ比值范围为0.39~3.03,表明两种类型的功能基因在各个土样中所占比例各异,但基本处于同一个数量级。不同围垦年限水稻土的细菌16S rRNA 基因丰度均存在显著差异,表现出随围垦年限增加而增加的趋势,其中围垦86 a 的稻田土壤16S rRNA 基因拷贝数最高,为7.88×1010copies·g-1。
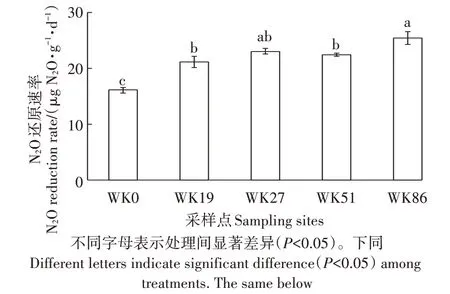
图1 不同采样点土壤N2O还原速率Figure 1 N2O reduction rate of different treatments
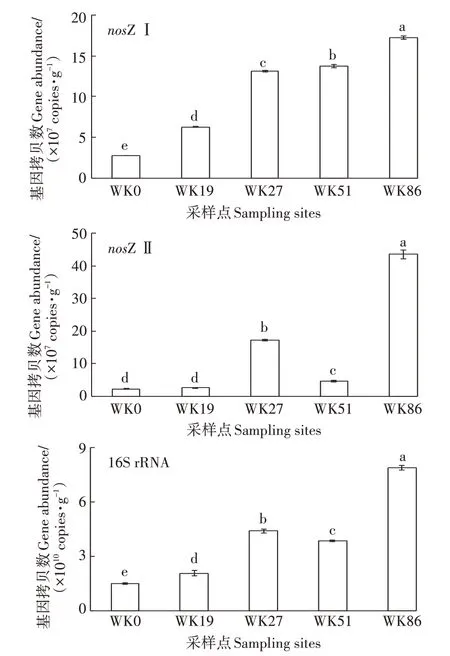
图2 不同土样中nosZ Ⅰ、nosZ Ⅱ和16S rRNA的基因丰度差异Figure 2 nosZ Ⅰ,nosZ Ⅱand 16S rRNA gene abundance in different soil samples
2.4 功能基因nosZ与N2O还原速率的相关性分析
对功能基因nosZ Ⅰ、nosZ Ⅱ与N2O 还原速率进行相关分析,结果表明,N2O 消耗速率与这两种基因拷贝数均呈正相关关系(图3),说明相关微生物的功能基因丰度很大程度上决定了土壤N2O 消耗能力。其中功能基因nosZ Ⅰ拷贝数与N2O 消耗速率的相关性达到显著水平(P<0.05),表明功能基因nosZ Ⅰ的丰度可能是土壤N2O 消耗能力的决定性因素。进一步分析发现,功能基因nosZ Ⅰ、nosZ Ⅱ拷贝数随围垦年限增加而明显增加,其增加速率分别为1.6×106copies·g-1·a-1和4.4×106copies·g-1·a-1,功能基因nosZⅡ表现出更高的增长速率。
2.5 土壤N2O还原速率与土壤性质的回归分析
土壤N2O 还原速率与土壤TOC 的回归方程达到显著水平,说明土壤TOC是影响N2O还原速率非常重要的环境要素(表3)。相反,土壤TN、却与N2O还原速率没有达到显著水平,可能与本试验中提供高浓度的N2O 底物,进而不再受土壤本底N 水平影响有关。值得注意的是,土壤pH、EC与N2O还原速率呈负相关,且回归方程均达到了极显著水平。这3 项土壤指标均为海洋性特征指标,随围垦植稻年限增加而明显下降,而N2O还原速率却显著增加,说明围垦植稻生态工程极大促进了围垦土壤的N2O还原潜力。
2.6 冗余分析
采用冗余分析(RDA)反映基因丰度与土壤理化性质之间的关系。排序图前两轴分别解释了基因丰度变异程度的51.4%和13.2%(图4)。5 个土样处于不同的位点,土壤pH、EC、SO2-4均与TN 呈负相关。nosZ Ⅰ、nosZ Ⅱ和16S rRNA基因丰度与土壤TN表现为正相关,其中nosZ Ⅱ基因丰度与土壤TN 的相关性最高。这3 个基因的丰度均与土壤pH、EC、SO2-4呈负相关,表明这些功能基因随着土壤海洋性特征指标逐渐减小,随围垦植稻年限增加而明显增加。
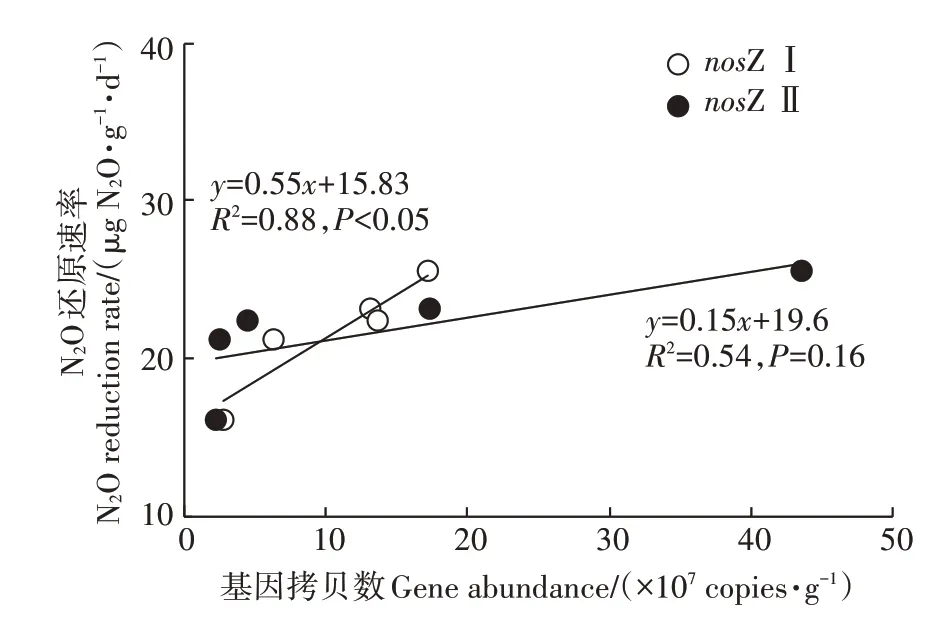
图3 N2O还原速率与功能基因丰度的关系Figure 3 Relationship between N2O reduction and gene abundance

图4 环境因子对基因丰度影响的冗余分析Figure 4 Redundancy analysis between soil properties and gene abundance
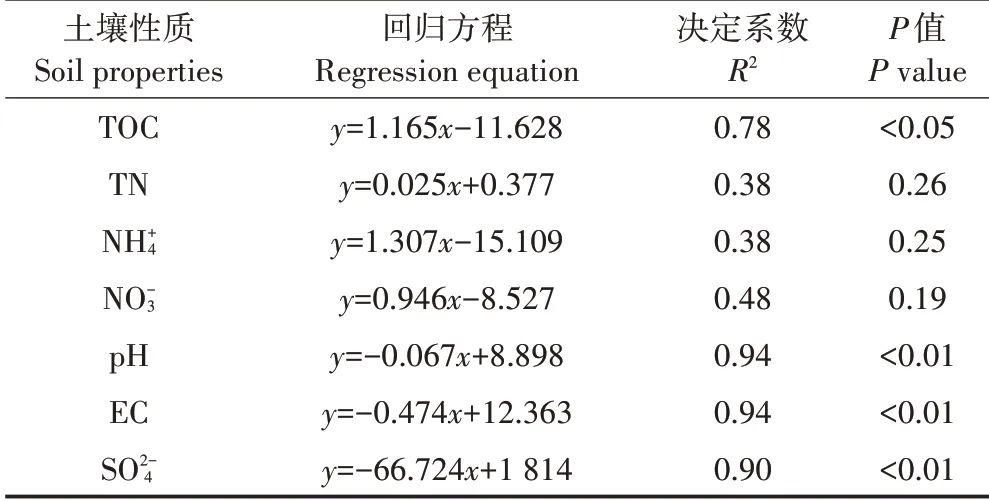
表3 土壤N2O还原速率与土壤理化性质的回归方程Table 3 Regression relationship between N2O reduction rate(y)and soil characteristics(x)
3 讨论
围垦造田的土地利用方式对滨海表层土壤的理化性质产生了深刻的变化。本研究发现,表层土壤的pH 值、浓度和EC 值均表现为滨海自然湿地显著高于围垦稻田(P<0.05),且随围垦年限增加而呈逐渐下降趋势。围垦之后围垦区土壤不再受到海水潮汐的影响,其脱盐化过程加速,这种现象在本试验区和杭州湾滨海区均有报道[10-11];而且受到农业施肥的影响,围垦区土壤pH 值下降明显。Chen 等[12]报道杭州湾滨海湿地被围垦造田700 a 后土壤pH 值下降至6.3,与本研究结果的变化趋势一致。另一方面,围垦区土壤TOC 显著高于光滩湿地,且随围垦年限增加而显著增加。Davidson 等[13]认为滨海湿地土壤的有机碳不易被土壤矿物质所固定,导致在干湿交替过程中被快速分解。相反,围垦之后的农田土壤,土壤孔隙水动力学发生改变,且有大量农作物有机碳输入土壤中,易形成土壤团聚体或有机-矿物交联体,可通过物理保护、化学固定方式提高土壤有机碳的固持作用[14]。在此过程中,土壤的全N 和活性N 也会相应增加。这种围垦造田进程中土壤理化性质的变化可能会显著影响该区域湿地土壤的N2O还原过程。
本研究发现,培养瓶顶空气体中N2O 浓度随着培养时间延长而出现明显的下降,表明所试土样都具备还原消耗N2O 的能力,与王玲等[15]的报道一致。本试验的培养条件为淹水厌氧培养,厌氧反硝化作用可能是调控土壤N2O 还原消耗的重要过程。在此过程中,活性碳源供应可促进反硝化微生物的呼吸作用,进而促进土壤N2O 的还原消耗过程[16-17]。相关性分析发现,土壤N2O 还原潜力与土壤pH、EC 值和浓度呈极显著负相关(P<0.01),而与土壤TOC呈显著正相关(P<0.05),表明围垦引起的土壤理化性质的改变可能是导致N2O 还原潜力发生演替性变化的重要原因。而且,土壤N2O 还原潜力随围垦年限增加而显著增强,表明围垦造田提高了滨海湿地土壤的N2O 还原潜力,可能成为大气N2O的汇。
参与N 循环的微生物类群中能够产生N2O 的途径有很多,然而只有nosZ 基因编码的氧化亚氮还原酶才能催化将N2O 还原成N2的过程[18]。典型的nosZ基因(nosZ Ⅰ)主要存在于完全反硝化菌类群中,以变形细菌为主,它们的反硝化基因链完整,具有产生N2O 的基因(nirS/nirK)[19]。而新近发现的非典型nosZ基因(nosZ Ⅱ)存在于更为多样的微生物类群中,如Firmicutes、Bacteroidetes、Chloroflexi门和变形细菌等,绝大多数为非完全反硝化微生物,缺少nirS/nirK 基因,目前被普遍认为是消耗N2O 的更为广泛的贡献者[4]。本试验定量PCR 结果发现,还原N2O 的功能基因nosZ Ⅰ和nosZ Ⅱ拷贝数为2.2×107~4.36×108copies·g-1,随着围垦年限增加而明显增加,说明功能基因nosZ 数量增加是土壤N2O 还原潜力增大的微生物学机理之一。相关性分析发现,功能基因nosZ Ⅰ丰度与土壤N2O 还原速率呈显著正相关(P<0.05),表明功能基因nosZ Ⅰ对N2O 消耗还原能力演替性变化的贡献可能高于nosZ Ⅱ。Francisco 等[20]对荷兰Schiermonnikoog 岛上一系列不同发育时间的滨海湿地土壤进行分析,发现nosZ Ⅰ基因的丰度比nosZⅡ高出10 倍左右,是消耗N2O 的主要贡献者。他们还发现nosZ Ⅰ基因丰度变化与滨海湿地土壤的化学性质(SOC、TN、)高度相关,而nosZ Ⅱ基因丰度则与土壤物理性质(砂粒、粉粒、黏粒)显著相关。本试验中,nosZ Ⅰ和nosZ Ⅱ基因丰度均表现为与土壤pH、EC、呈负相关,而与土壤TN 呈正相关且相关度最大。推测TN可能是调控其空间变异的最主要因素,说明在滨海湿地N 水平相对匮乏的环境中,土壤N 库及活性N 供应可能是导致N2O 还原微生物数量发生演替变化的决定性因素。Kearns 等[21]对长期遭受N 负荷的Sippewissett 滨海湿地进行研究,发现外源N 高输入区的nosZ Ⅰ基因拷贝数比对照区高出一个数量级,且nosZ Ⅰ基因的多样性指数(Shannon Index)和丰富度指数(Chao 1 Richness)随着N 供应的增加而显著增加。而且有研究认为,携带nosZ Ⅰ基因的完全反硝化菌更偏好于定殖在植物根区微域[22]。这暗示了本试验中围垦区水稻生长可促进nosZ Ⅰ型反硝化微生物的定殖生长,从而促使nosZ Ⅰ基因在围垦区稻田N2O还原过程中发挥更重要的作用。
也有研究发现nosZ Ⅱ基因在滨海湿地环境中分布广泛,且丰度远高于nosZ Ⅰ基因[23],在N 转化过程中发挥更重要的作用。而且,nosZ Ⅱ型微生物的N2O半饱和常数(Ks)明显低于nosZ Ⅰ微生物,表现出对N2O 更强的还原能力,在控制N2O 排放方面可能更为突出[24]。Domeignoz-Horta 等[25]发现,与nosZ Ⅰ种群相比,nosZ Ⅱ群落丰度及N2O转化率更容易受到农田耕作制度和管理措施的影响。本试验中,围垦植稻背景下,nosZ Ⅱ功能基因丰度的年增长率为nosZ Ⅰ功能基因的2.8 倍,说明nosZ Ⅱ功能基因对围垦植稻的响应度更高,在围垦区稻田土壤的N2O 还原消耗过程中可能也发挥着重要作用。值得注意的是,DNA 水平上的nosZ 基因数量并不能完全代表土壤微生物的N2O 还原活性,为探明nosZ Ⅰ和nosZ Ⅱ两类基因对土壤N2O 消耗能力的贡献,可以从mRNA 水平上进行深入研究。
需要指出的是,稻田土壤N转化过程及相关微生物群落结构会受到许多因素的影响,如耕作制度、施肥量及种类、水稻发育期、秸秆还田等。本研究结果仅能代表特定稻区内特定生长发育期的耕层土壤N2O 还原潜势与功能菌群变化。在此基础上,需要通过设置更加细化的田间试验和室内模拟培养,进行深入研究围垦区典型稻田土壤N转化的关键过程,为科学评估滨海围垦造田的生态效应和我国稻田温室气体减排提供科学依据。
4 结论
(1)潮滩湿地围垦造田的土地利用方式,显著增加了耕层土壤TOC和含量,降低了土壤pH值、EC值和含量,促进了土壤的N2O还原潜力。
(2)随着围垦植稻年限的增长,土壤N2O 还原的功能基因nosZ Ⅰ和nosZ Ⅱ数量大幅度增加;其中,功能基因nosZ Ⅰ是耕层土壤N2O 还原速率发生演替性变异的主要贡献者。
致谢:在本试验的野外采样过程中,上海崇明东滩湿地自然保护区给予了大力支持和协助,在此表示衷心感谢!

