黄边灵芝多糖的结构鉴定及免疫活性的研究
宋志强,钱 叶,丁 祥,朱 淼,唐 贤,侯怡铃*
(1.西华师范大学 生命科学学院,西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.西华师范大学 环境科学与工程学院,四川 南充 637009)
0 引言
灵芝(GanodermaLucidum)为灵芝属真菌的总称,作为我国具有悠久历史的名贵中草药和食用菌,近年来,已被各国学者广泛研究。灵芝多糖多来源于灵芝的子实体、菌丝体孢子粉中分离得到,是灵芝中的有效生物活性成分[1]。研究发现,灵芝多糖一般由葡萄糖、甘露糖、岩藻糖、阿拉伯糖、鼠李糖、半乳糖等成分所组成[2-6],糖苷键链接形式大多为β-(1→3)键、β-(1→4)键、β-(1→6)键和α-(1→6)键等[7-9]。
大量药理研究结果表明,灵芝多糖具有免疫调控作用,青海雪灵芝多糖与东莞紫芝多糖能够促进小鼠腹腔巨噬细胞的吞噬活性、NO释放量,同时,东莞紫芝多糖还能促进小鼠巨噬细胞中TNF-α和IL-6的表达[10-11]。不同地区的黑灵芝多糖在促进小鼠T、B淋巴细胞的增殖的过程中具有不同程度的作用,相较于赣南的黑灵芝多糖,江西赣州的黑灵芝多糖对于提高血清中 IL-2 和 TNF-α含量发挥着重要作用[12-13]。同时,灵芝多糖也具有抗氧化、抗肿瘤作用,海南赤芝灵芝多糖具有较强的抗氧化能力[14];安徽产灵芝多糖能显著抑制肿瘤细胞的增殖,诱导其凋亡[15]。以上研究表明,不同产地,不同品种灵芝多糖的结构和生物活性有一定的差异,在免疫调节、抗氧化、抗肿瘤等方面有不同程度的疗效。
四川省小金县地处川西北高原,是长江、黄河源区的重要组成部分,地理位置独特、生态战略地位十分重要[16]。该地区地属大陆性季风高原型气候,草甸和灌木丛繁茂,植被覆盖面积较大,独特的自然环境,造就了其生态环境、药用植物资源物种及遗传性状的多样性[17-18],成为藏医药发展的重要摇篮[19]。采自于四川小金县的野生灵芝子实体小,呈半圆形、近扇形或略圆形,表面呈暗褐色,有漆样光泽和纵皱纹,有同心环纹但不明显,木栓质至木质部位,呈浅黄至黄褐色。根据卯晓岚[20]主编的《中国大型真菌》一书对其进行形态学鉴定为黄边灵芝(G.luteomarginatum)(图1)。目前,关于四川省小金县野生黄边灵芝的多糖结构及免疫活性方面的研究还未见报道。

图1 四川小金县野生黄边灵芝Fig.1 Wild Ganoderma luteomarginatum in Xiaojin County, Sichuan Province
本研究以四川小金县野生黄边灵芝为研究对象,采用热水浸提技术、乙醇醇沉法、柱层析技术分离纯化灵芝多糖,通过高效凝胶渗透色谱(HPGPC),红外光谱技术(IR),核磁共振谱(1H NMR和13C NMR)等对小金县野生灵芝多糖的结构进行初步表征并探究灵芝多糖的免疫调控能力。通过此研究有助于开发利用四川小金县野生黄边灵芝多糖资源,并且为进一步研究其免疫调控机制以及药理作用方面提供理论参考的依据。
1 材料和方法
1.1 主要材料与仪器
1.1.1 主要材料与试剂
灵芝,四川省阿坝藏族羌族自治州小金县采集,经西华师范大学环境工程与环境科学学院丁祥教授根据《中国大型真菌》一书进行鉴定;T淋巴细胞、B淋巴细胞、小鼠巨噬细胞RAW264.7,中国科学院上海生命科学研究院生物化学与细胞生物学研究所;氯化钠,成都市科龙化工试剂厂;DEAE纤维素,生兴生物技术(南京)有限公司;无水乙醇,安徽安特生物化学有限公司;CCK-8细胞计数试剂盒(cell counting kit-8),上海碧云天生物技术研究所;PBS缓冲液,本实验室提供;RPMI1 640培养基、无酚红,美国gibco公司;0.5% Trypsin-EDTA,美国gibco公司;胎牛血清,Clark Bioscience;实验药品均为分析纯。
1.1.2 主要实验仪器
3 100 系列CO2恒温培养箱,美国Thermo公司; Epoch酶标仪,美国基因有限公司;96孔微量培养板,康宁生命科学(吴江)有限公司;AR 2130电子天平,奥豪斯仪器(上海)有限公司;LD4-2A型离心机,青岛海尔股份有限公司;RE-2 000A旋转蒸发仪,上海亚荣生化仪器厂;HHS型恒温水浴锅,上海光地仪器设备有限公司;DMI 3 000徕卡倒置荧光显微镜,徕卡显微系统(上海)贸易有限公司。
1.2 方法
1.2.1 灵芝粗多糖的提取
称取干燥的灵芝子实体250 g粉碎,以粉碎后灵芝子实体与蒸馏水1∶3的比例的在90 ℃条件下水浴6 h,煮3次;收集上清液,使用旋转蒸发仪将灵芝多糖浓缩至200 mL,加入4倍体积的无水乙醇醇沉,对其进行离心收集絮状沉淀,沉淀反复冻融后除去不溶解杂质,并采用sevage法脱去其中含有的蛋白,烘干后得到灵芝多糖的粗多糖[21-23]。
1.2.2 灵芝粗多糖的分离纯化
精密称取灵芝多糖的粗多糖10 mg,溶于10 mL蒸馏水中,将其在4 ℃,12 000 rpm的转速下离心10 min,收集上清液,经DEAE cellulose-52色谱柱[24]及SePHACE-S300凝胶柱[25]反复纯化后,收集纯化后的多糖溶液,用旋转蒸发仪浓缩至5 mL,透析,烘干后得到的多糖命名为灵芝多糖。灵芝多糖得率 =(灵芝多糖重量/子实体总重量)×100%
1.2.3 灵芝多糖的分子量测定
称取5 mg灵芝多糖样品,用1 mL蒸馏水溶解,使用高效凝胶渗透色谱法对灵芝多糖的分子量进行测定[26]。测得的数据经GPC软件分析得到分子量[27]。
1.2.4 灵芝多糖的红外光谱分析
称取灵芝多糖样品5 mg,与烘干后的KBr粉末一起充分研磨,压片,用傅里叶红外光谱仪在4 000~400 cm-1[28]的检测范围内扫描检测。
1.2.5 灵芝多糖的核磁共振分析
称取灵芝多糖样品20 mg溶解于D2O中,保存并在核磁共振仪上进行测定, 600 MHz条件下测定1H NMR谱和13C NMR谱[29]。
1.2.6 灵芝多糖对T、B细胞和RAW264.7细胞的增殖作用
本实验采用CCK-8试剂盒(cell counting kit)法测定灵芝多糖对T、B细胞和RAW264.7细胞增殖实验的影响[30]。配制质量浓度为1 mg/mL的灵芝多糖母液并加入细胞培养液稀释,配制成质量浓度为(2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL)的灵芝多糖溶液。配制质量浓度为1 mg/mL的LPS母液并加入细胞培养液稀释,并配制成质量浓度为10 μg/mL的LPS溶液。
取T、B细胞和RAW264.7细胞,并用培养液稀释至2×105细胞/mL,配制成细胞悬浮液。为了消除边缘效应,向96孔板的四周加入PBS缓冲液。再向其余的孔中分别加入100 μL的细胞稀释液。在37 ℃、5% CO2的恒温培养箱中培养24 h后,依次加入100 μL细胞培养液(空白对照)、LPS(质量浓度10 μg/mL,阳性对照)以及质量浓度为(2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL)的灵芝多糖溶液,在37 ℃、5% CO2的培养箱中继续培养24 h。培养完成后,每孔加入5 μL的CCK-8溶液,孵育3 h,在酶标仪450 nm的波长下测定OD值,记录并拍照、作图。
1.2.7 统计与分析
实验数据采用社会科学统计项目(Statistical Program for Social Sciences)SPSS 22.0软件进行统计学处理,与空白对照组对比显著用*表示,P<0.05,极显著用**表示,P<0.01。
2 结果与分析
2.1 黄边灵芝多糖得率
本研究从250 g黄边灵芝子实体中提取到56 g的灵芝粗多糖,将灵芝粗多糖进一步分离纯化后,提取到灵芝多糖1.44 g,在黄边灵芝子实体总量中的得糖率为0.576%。
2.2 高效凝胶渗透色谱(HPGPC)检测结果
凝胶色谱技术作为一种快速而又简单的分离分析技术,主要用于高聚物的相对分子质量分级分析以及相对分子质量分布测试。本实验采用高效凝胶渗透色谱法(HPGPC)测定灵芝多糖的分子量。结果如图2所示,在14 min左右出现单一峰,曲线呈近似对称分布的曲线。
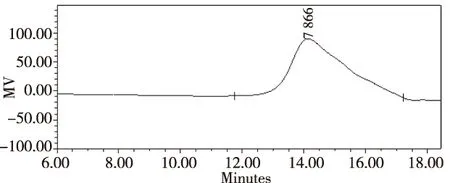
图2 黄边灵芝多糖的高效凝胶渗透色谱图Fig.2 The high performance gel permeation chromatogram of Ganoderma luteomarginatum polysaccharide
多糖作为一种大分子高聚物,灵芝多糖的生理活性与分子量大小及分子量的分布密切相关。如图3所示,通过高效凝胶渗透色谱测得的四川小金县野生黄边灵芝多糖的重均分子量Mw约为7. 96×103Da,是一种分子量较低的灵芝多糖。数均分子量Mn约为1. 05×103Da,分子量分布指数a为7.57,多分散系数为5.30,说明分子量的分布较宽。
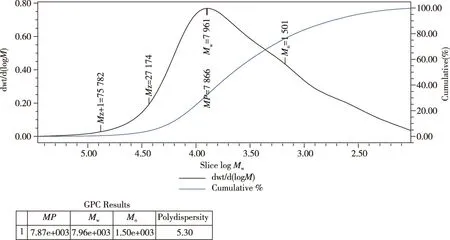
图3 黄边灵芝多糖的分子量Fig.3 The molecular weight of Ganoderma luteomarginatum polysaccharide
2.3 黄边灵芝多糖的FTIR谱分析
本研究采用傅里叶红外光谱技术(FTIR)在4 000~400 cm-1范围内测定灵芝多糖的红外吸收,并处理分析灵芝多糖的红外光谱。如图4所示,波数在3 438.90 cm-1处出现了一处宽吸收峰,并将此吸收峰指定为糖醇羟基O-H的伸缩振动吸收峰;1 637.54 cm-1的吸收峰则指定为羰基C=O 非对称伸缩振动吸收峰;1 401.20 cm-1附近的吸收峰是糖醇羟基-C-OH的面内弯曲振动,综上描述了灵芝多糖在4 000~1 400 cm-1范围内的特征吸收峰。在1 250~1 000 cm-1指纹峰区域范围内的一组峰是由醚键C-O伸缩振动引起的,即在1 108.62 cm-1处所出现的吸收峰;在600~650 cm-1范围内的吸收峰可用来确定吡喃糖环的骨架结构,因此根据619.33 cm-1峰的存在,我们可以推断灵芝多糖中有吡喃糖作为其基本骨架[31],红外光谱结果还显示此多糖成分均一,无其他结构特征峰,是一种均一多糖。
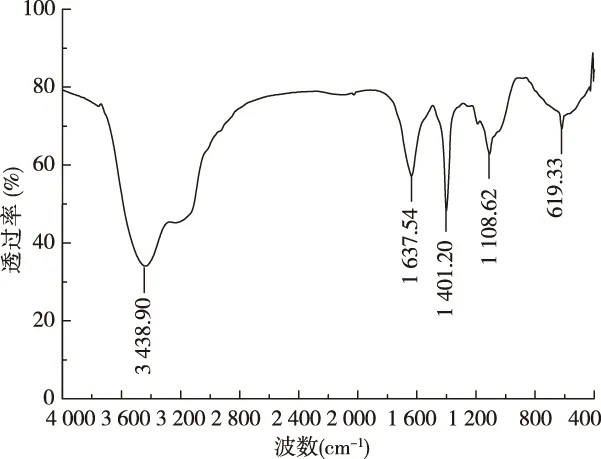
图4 黄边灵芝多糖的傅里叶红外光谱分析Fig.4 Fourier transform infrared spectra of Ganoderma luteomarginatum polysaccharide
2.4 黄边灵芝多糖的1H-NMR图谱分析
四川小金县野生黄边灵芝多糖的1H-NMR谱如图5所示:在1H-NMR核磁共振谱中,灵芝多糖含有3个异头氢信号,分别为δ4.98、δ4.91、δ4.44。表明灵芝多糖由3种单糖组成。δ4.98、δ4.91处的氢信号指示为α-吡喃糖残基,而δ 4.44处的异头氢信号指示为β-吡喃糖残基[31],积分曲线显示两种α-吡喃糖残基与β-吡喃糖残基比为2∶2∶1,所以四川小金县野生黄边灵芝多糖以α-型糖苷键为主链,β-型糖苷键为侧链,主链与侧链之比为4∶1。在δ3.20~ 4.12处的吸收峰为2~6位碳上氢信号的重叠峰。
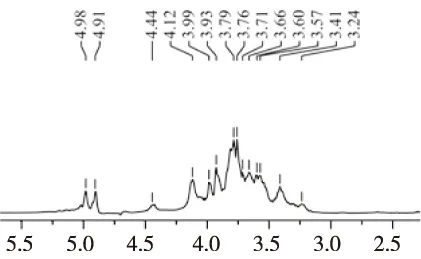
图5 黄边灵芝多糖的1H-NMR谱数据Fig.5 1H-NMR spectra of Ganoderma luteomarginatum polysaccharide
2.5 黄边灵芝多糖的13C-NMR谱分析
四川小金县野生黄边灵芝多糖的13C-NMR谱如图6所示:δ102.48、δ101.43、δ97.74处有异头碳信号,δ102.48、δ101.43处表明四川小金县野生黄边灵芝多糖具有α构型,且δ97.74处表明四川小金县野生黄边灵芝多糖具有β构型。同时根据文献[32],δ97~104 之间的区域的碳信号,即δ102.48、δ101.43、δ97.74处的共振信号归为D型吡喃型单糖的异头碳原子,该灵芝多糖在异头碳δ100~103之间的区域中,δ102.48、δ101.43可归属于α-D-糖残基的C1;δ97.74可归属于β-D-糖残基的C1。13C-NMR谱的碳信号与氢谱的1H-NMR氢信号结果相吻合。
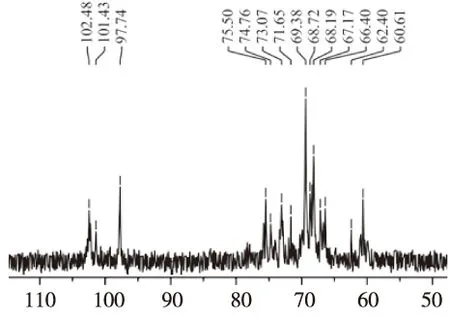
图6 黄边灵芝多糖的13C-NMR谱数据Fig.6 13C-NMR spectra of Ganoderma luteomarginatum polysaccharide
2.6 黄边灵芝多糖对T淋巴细胞的增殖作用
T淋巴细胞来源于骨髓的多能干细胞,骨髓中的一部分多功能干细胞或前T细胞迁移到胸腺内,在胸腺激素的诱导下分化成熟,成为具有免疫活性的T细胞。成熟的T细胞与靶细胞特异性结合,破坏靶细胞膜,直接杀伤靶细胞,或者释放淋巴因子,从而发挥免疫调节等功能。由图7可知,当灵芝多糖的终质量浓度为1.25~10 μg/mL时,随着药物浓度的增加,T细胞的增殖效果也逐渐增强,并且当终质量浓度为10 μg/mL,促进 T 淋巴细胞增殖的效果最好,相比于空白对照组具有极显著性差异(P<0.01)。值得注意的是,当终质量浓度为20 μg/mL时,相比于空白对照组呈现增殖效果,具有极显著性差异(P<0.01),但效果弱于1.25~10 μg/mL实验组与LPS阳性对照组,提示低浓度的灵芝多糖促进 T淋巴细胞增殖的效果较好, 且在1.25~10 μg/mL的浓度范围内,与T淋巴细胞增殖效果呈正相关。
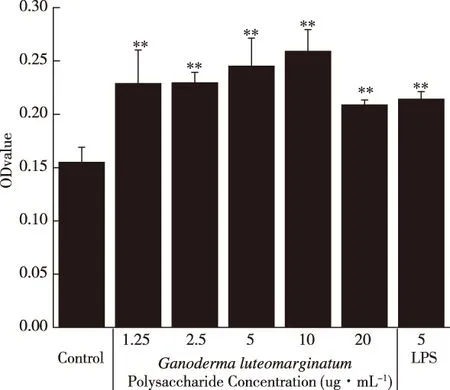
*. 与空白组相比差异显著(P<0.05);**. 与空白组相比差异极显著(P<0.01)。图7 黄边灵芝多糖对T淋巴细胞增殖的影响Fig.7 Effects of Ganoderma luteomarginatum polysaccharide on proliferation of T cells
本实验的T淋巴细胞增殖形态图如图8所示,结果显示,空白组的T淋巴细胞生长状态良好,细胞形态为圆型,多为成团生长,且以10个细胞左右成团,加入四川小金县野生黄边灵芝多糖刺激后,细胞成团量变大,细胞量逐渐增多,可达到几十甚至上百个细胞成团。当用10 μg/mL浓度的四川小金县野生黄边灵芝多糖刺激T淋巴细胞时,T淋巴细胞的成团量最大。并且当同等浓度(5 μg/mL)的四川小金县野生黄边灵芝多糖和LPS刺激T淋巴细胞时,四川小金县野生黄边灵芝多糖组相较于LPS组对于T淋巴细胞数量及成团量刺激也较好。
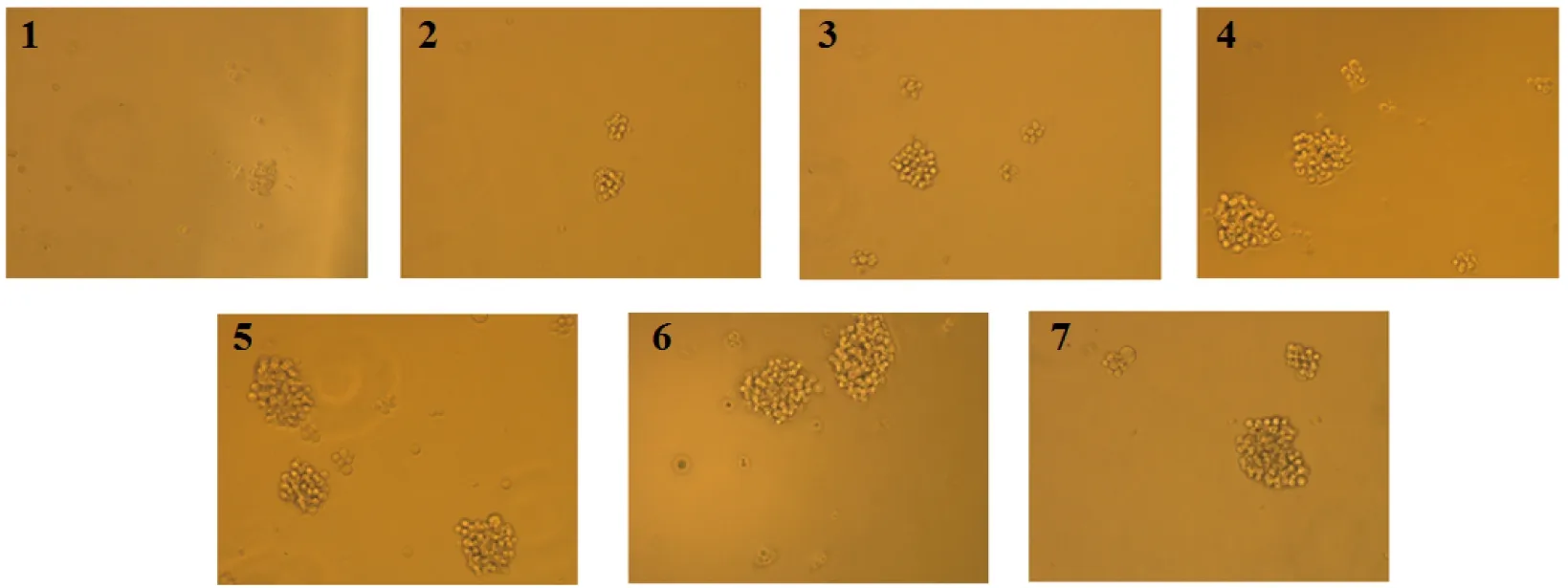
注:1为空白组,2-6为黄边灵芝多糖实验组,其质量浓度分别为1.25 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL,7为LPS组(5 μg/mL)。图8 黄边灵芝多糖对T细胞形态的影响Fig.8 Effect the cell morphology of T cell by Ganoderma luteomarginatum polysaccharide
2.7 黄边灵芝多糖对B淋巴细胞增殖的影响
成熟的B淋巴细胞主要定居于淋巴结皮质浅层的淋巴小结和脾脏的红髓和白髓的淋巴小结内。B淋巴细胞在抗原刺激下可分化为浆细胞,浆细胞可合成和分泌抗体,从而发挥细胞免疫及免疫调节等功能。由图9可知,当四川小金县野生黄边灵芝多糖的终质量浓度为2.5~10 μg/mL时,随着药物浓度的增加,B淋巴细胞的增殖效果也逐渐增强,并且当终质量浓度为10 μg/mL,促进B淋巴细胞增殖的效果最好,相比于空白对照组具有极显著性差异(P<0.01);但当终质量浓度为1.25 μg/mL时,相比于空白对照组没有明显的增殖效果;值得注意的是,当终质量浓度为20 μg/mL时,相比于空白对照组呈现增殖效果,具有显著性差异(P<0.05),但效果弱于2.5~10 μg/mL实验组,高于LPS阳性对照组。提示中等浓度的四川小金县野生黄边灵芝多糖促进B淋巴细胞增殖的效果较好,且在2.5~10 μg/mL的浓度范围内,与B淋巴细胞增殖效果呈正相关。
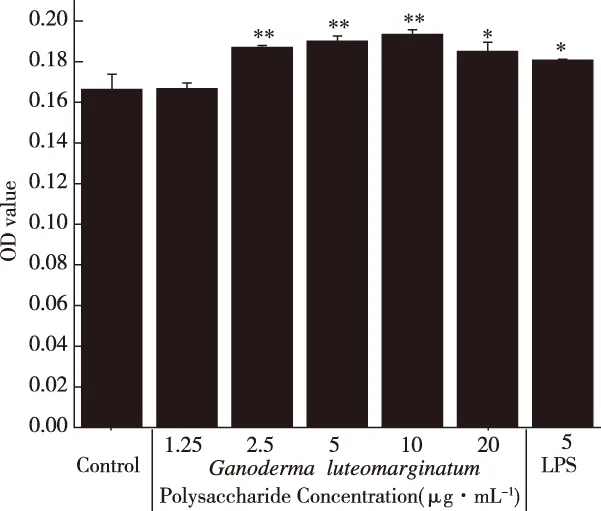
注:*.与空白组相比差异显著(P<0.05);**. 与空白组相比差异极显著(P<0.01)。图9 黄边灵芝多糖对B细胞增殖的影响Fig.9 Effects of Ganoderma luteomarginatum polysaccharide on proliferation of B cells
本实验的B淋巴细胞增殖形态图如图10所示,结果显示,空白组的B淋巴细胞生长状态良好,细胞形态为圆形,多为成团生长,且以10个细胞左右成团,加入四川小金县野生黄边灵芝多糖刺激后,细胞成团量变大,细胞量逐渐增多,可达到几十甚至上百个细胞成团。当用10 μg/mL浓度的四川小金县野生黄边灵芝多糖刺激B淋巴细胞时,B淋巴细胞的成团量最大。并且当同等浓度(5 μg/mL)的四川小金县野生黄边灵芝多糖和LPS刺激B淋巴细胞时,四川小金县野生黄边灵芝多糖组相较于LPS组对于B淋巴细胞数量及成团量刺激也较好。
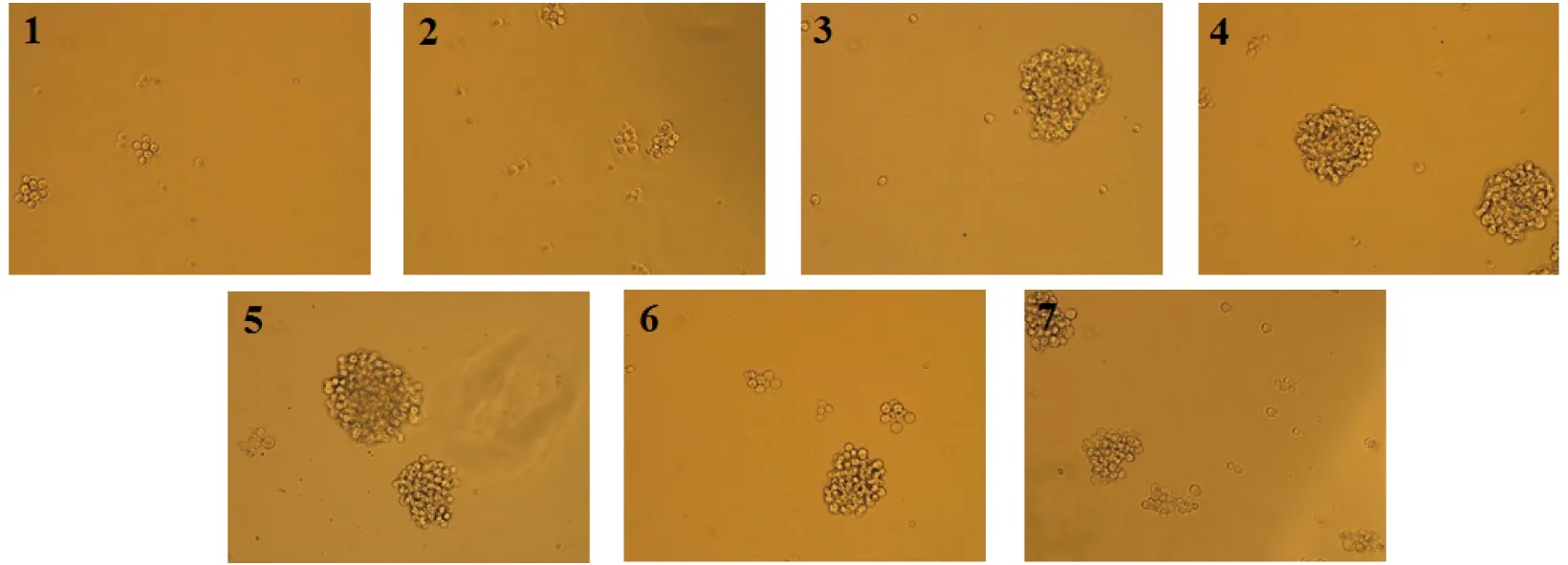
注:1为空白组,2-6为黄边灵芝多糖实验组,其质量浓度分别为1.25 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL,7为LPS组(5 μg/mL)。图10 黄边灵芝多糖对B细胞形态的影响Fig.10 Effect the cell morphology of B cell by Ganoderma luteomarginatum polysaccharide
2.8 灵芝多糖对RAW264.7巨噬细胞增殖的影响
RAW264.7 是由 Abelson 鼠白血病病毒诱导 BALB/c小鼠产生肿瘤后收集小鼠腹水单核样巨噬细胞得到的细胞株,具有很强的黏附和吞噬抗原的能力,在免疫调节中发挥着重要作用[33]。如图11所示,四川小金县野生黄边灵芝多糖的终质量浓度为2.5~10 μg/mL时,随着药物浓度的增加,RAW264.7巨噬细胞的增殖效果也逐渐增强,并且当终质量浓度为10 μg/mL,促进巨噬细胞增殖的效果最好,相比于空白对照组具有极显著性差异(P<0.01);提示低浓度的四川小金县野生黄边灵芝多糖促进巨噬细胞增殖的效果较好,且在1.25~10 μg/mL的浓度范围内,与RAW264.7巨噬细胞增殖效果呈正相关。

注:*.与空白组相比差异显著(P<0.05);**. 与空白组相比差异极显著(P<0.01)。图11 黄边灵芝多糖对巨噬细胞细胞增殖的影响Fig.11 Effects of Ganoderma luteomarginatum polysaccharide on proliferation of Macrophages cells
本实验RAW264.7巨噬细胞增殖形态如图12所示。结果显示,空白组的RAW264.7巨噬细胞为高折光圆形及部分细胞伸出伪足的状态,贴壁生长。在四川小金县野生黄边灵芝多糖的刺激下,RAW264.7巨噬细胞伸出伪足,进行分裂,且细胞量逐渐增加。当用10 μg/mL浓度的四川小金县野生黄边灵芝多糖刺激RAW264.7巨噬细胞时,增殖效果最好,细胞数量增殖最多。并且当同等浓度(5 μg/mL)的四川小金县野生黄边灵芝多糖和LPS刺激RAW264.7巨噬细胞时,四川小金县野生黄边灵芝多糖组相较于LPS组对RAW264.7巨噬细胞增殖作用也较好。
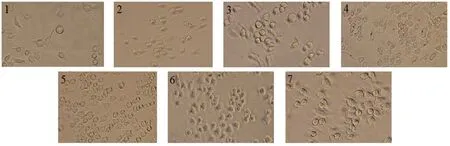
注:1为空白组,2-6为黄边灵芝多糖实验组,其质量浓度分别为1.25 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL,7为LPS组(5 μg/mL)。图12 黄边灵芝多糖对巨噬细胞形态的影响Fig.12 Effect the cell morphology of Macrophages cell by Ganoderma luteomarginatum polysaccharide
3 讨论
本研究从小金县野生黄边灵芝中提取到一种糖成分,重均分子量Mw约为7.9×103Da,数均分子量约为1.05×103Da,分子量分布指数a为7.57,多分散系数为5.30,是由50个左右的单糖所组成的均一多糖。结构分析显示,该多糖结构特征明显,由3种单糖构成,具有α-D -吡喃糖主链,β-D-吡喃糖侧链结构,且主链与侧链比为4∶1,是一种结构新颖的均一多糖。
结构决定理化性质,并且多糖的结构和理化性质都与其活性紧密相关,然而两者并非单独地影响多糖的活性。分子量的大小是多糖具备生物活性的必要条件,根据文献报道,一般多糖分子量大于10 kDa才具有较强的活性,小于该值则活性很低或没有[7]。例如何晋浙等[34]从赤灵芝子实体中提取到分子量为8×104~2×105Da的灵芝多糖;刘艳芳等[35]从“沪农灵芝1号”品种子实体中获得分子量为2.28×106Da的灵芝多糖均具有较强的生物活性。而我们从四川小金县野生黄边灵芝中提取到的多糖分子量约为7.9×103Da,小于10 kDa,但该多糖免疫活性实验结果显示,四川小金县野生黄边灵芝多糖仍然具有较强的生物活性。
除此之外,目前研究发现,大部分灵芝多糖以β-(1→3)糖苷键构成主链,以β-(1→6)及β-(1→4)糖苷键构成侧链。刘艳芳[36]研究表明,从赤灵芝子实体中提取到的大分子量的β-(1→3)葡聚糖,具有较强的刺激巨噬细胞释放TNF-α和IL-6等细胞因子的活性。王琪[37]研究表明,从灵芝子实体及水提物提取到主要由葡萄糖、半乳糖、甘露糖、糖醛酸以2∶4∶1∶2组成的多糖LZ5-S和主要由半乳糖、葡萄糖、木糖和糖醛酸以2∶2∶1∶1组成的多糖LZ5-W-2-A具有刺激巨噬细胞产生NO的作用,并存在浓度依赖性。毛健[38]等研究发现,灵芝多糖具有β-(1→3)和1→6的主链结构,并且具有提高细胞免疫及体液免疫的作用。向俊宇[2]等研究发现,灵芝多糖具有β-(1→3)的主链结构,并且具有免疫调节作用。
不同品种的灵芝多糖不仅结构会影响细胞的免疫活性方面,不同品种的灵芝多糖的浓度对免疫细胞增殖的效果也有所差异。连紫菀[39]等研究表明,在浓度范围为25~100 μg/mL的雪灵芝多糖能够促进小鼠腹腔巨噬细胞的增殖,显示出显著的浓度依赖性刺激作用。顾菲菲[40]等研究表明,赤灵芝多糖在25~100 μg/mL的质量浓度范围内都具有较高免疫调节活性。张丽霞等[41]研究表明,灵芝孢子粉多糖在50~100 μg/mL的质量浓度范围内促进腹腔巨噬细胞产生的 TNF-α效果较好,并产生剂量依赖效果。
与不同品种的灵芝多糖的构效和量效比较后发现,四川小金县野生黄边灵芝多糖不仅具有α主链结构,同时具有β侧链结构。同时多糖分支度与其生物活性有一定的关联度,但并不呈线性关系。四川小金县野生灵芝多糖的主链与侧链比为4∶1,提示每四个单糖就有一个分支,分支较多。免疫活性实验显示,四川小金县野生灵芝多糖在1.25~20 μg/mL的质量浓度范围内能够有效地促进T淋巴细胞、B淋巴细胞、RAW264.7巨噬细胞的增殖,发挥其免疫调节作用。并且,当灵芝多糖终质量浓度为10 μg/mL时,促进T淋巴细胞、B淋巴细胞、巨噬细胞RAW264.7的成团增殖的效果最好。我们的研究结果表明β构型的主链结构并不是多糖活性的必需基团,α构型的主链结构也具有较强的免疫活性。并且与其它品种的灵芝多糖相比较发现,本研究中的黄边灵芝多糖在较低浓度范围内促进免疫细胞增殖的效果最好。
综上研究为开发和利用四川小金县野生黄边灵芝提供了一定的科学依据,但关于四川小金县野生黄边灵芝多糖的精细结构鉴定及免疫调控作用的相关分子机制还有待于进一步研究。

