不同干燥温度对花生营养品质和发芽特性的影响
杜 琪 赵新华 耿雷跃 邹 拓 左永梅 李欣明张 薇,* 于海秋,*
(1 河北省农林科学院滨海农业研究所,河北 唐山 063299;2 沈阳农业大学农学院,辽宁 沈阳 110866)
花生(ArachishypogaeaL.)是世界上重要的油料作物。据FAO(2018)数据显示,世界上花生总种植面积为2.76×107hm2,总产量为4.40×107t[1]。我国是重要花生出口国,总产量居世界第一。花生从田间收获时含水率一般在50%左右,需要降至8%以下才能安全贮藏和运输[2-3]。收获后的花生若未能及时干燥,易腐败变质,滋生大量霉菌,特别是黄曲霉菌等[4]。随着花生收获、摘果机械化进程的快速推进,我国原有的花生收获量与产地之间的协调平衡已逐渐被打破。花生收获期日趋集中,而晒场资源越显不足,及时将花生降至安全贮藏含水率显得愈发困难。目前,世界主要花生种植国家,如中国、印度和尼日利亚等地区,仍以田间自然晾晒的方式进行花生荚果的干燥,该法干燥效率低,劳动强度大,而且对天气情况依赖性极大;而美国在花生获后使用干燥车进行集中干燥,该过程简单高效,降低了花生霉变发生的概率[2]。因此,研发适合我国农业生产中经济、高效的花生快速干燥技术与工艺对花生产业的发展具有重要作用。
干燥后的花生主要为食用和种植,应保持原有加工品质和发芽能力。温度和风速是影响花生干燥的主要因素[5-6]。研究表明,风速对种子品质和发芽率无显著影响,但高温能够显著降低其品质和发芽率[7-9]。杨潇[10]研究表明高温可引起花生油脂过氧化,酸价和过氧化值显著增加,降低其加工品质和食味。同时,高温干燥会破坏种胚细胞膜脂结构,导致胚组织细胞死亡,降低发芽率[11-12]。目前,干燥技术已在玉米[13]、水稻[7]等粮食快速干燥中广泛应用,而对花生干燥研究较少。本研究通过对收获后鲜花生在不同温度下进行干燥,分析花生品质性状和发芽参数等指标的变化,以期为花生干燥工艺以及设备研发提供理论支撑。
1 材料与方法
1.1 试验材料
供试材料为大粒形花生品种花育22(HY22),中粒形花生品种花育20(HY20)和小粒形花生品种农花16(NH16)。HY22和HY20由山东省农业科学院花生研究所选育,NH16由沈阳农业大学花生研究所选育。收获时HY22、HY20和NH16的荚果体积和百仁重如表1所示。

表1 收获时HY22、HY20和NH16的荚果体积和百仁重Table 1 Pod volume and 100-kernel weight of HY22, HY20 and NH16 at harvest stage
1.2 主要仪器与设备
DHG-9037A烘箱,上海精宏实验设备有限公司;Infratec Nova多功能谷物近红外分析仪,丹麦FOSS;BSG-400人工气候箱恒温培养,上海博迅医疗生物仪器股份有限公司;分析天平(0.001 g),瑞士Mettler-Toledo。
1.3 试验方法
1.3.1 试验设计 试验地点为沈阳农业大学实验基地,于2017年5月10日播种,9月22日收获。花生种植密度为15万株·hm-2,每小区6垄,垄长10 m,行距0.6 m。分别施用磷酸二铵150 kg·hm-2、过磷酸钙300 kg·hm-2、硫酸钾150 kg·hm-2为基肥。
将新收获的HY22、HY20和NH16花生荚果表面杂质清理干净,分别挑选饱满花生荚果约200.00 g装入纱网袋中。将各烘箱风速调整为0.5 m·s-1,并设置烘箱温度分别为40、50、60和70℃,以自然晾晒花生为对照(CK)。试验设置3次重复,分别将各处理纱网袋平铺于干燥室内中心位置,干燥方式为薄层干燥。当花生含水率低于8%时停止干燥,取出冷却后放入保鲜袋中密封室温保存,用于花生营养品质和发芽指标等参数的测定。
1.3.2 花生含水率测定 取100.00 g新鲜采收后花生荚果,将花生荚果的果仁和荚皮分别称重。然后置于烘箱中110℃杀青30 min,之后80℃烘干至恒重,计算花生荚果、仔仁和荚皮含水率。
1.3.3 营养品质测定 将干燥后的花生剥壳后选取大小均一且完整的果仁,使用多功能谷物近红外分析仪测定其蛋白质、脂肪、软脂酸、硬脂酸、油酸、亚油酸和氨基酸含量等参数。
1.3.4 花生酸价和过氧化值测定 油脂提取参考李慧丽等[14]的方法。取50.00 g研磨后的花生仁样品,置于250.0 mL具塞三角瓶中,加入200.0 mL石油醚浸提过夜。然后将浸提液用滤纸过滤,转入旋转蒸发仪进行减压回收石油醚,将蒸发后得到的油脂进行酸价和过氧化值分析。酸价和过氧化值测定参照GB/T 5009.37-2003[15]的方法。
1.3.5 花生种子质膜透性测定 采用电导率仪法[16]。分别取各处理花生仔仁20粒并称重,用去离子水冲洗,然后用滤纸吸干,置于三角瓶中。然后向各瓶中加入100 mL去离子水,并迅速测定电导率值A1。然后放入20℃恒温箱中浸泡种子,每隔12 h测定溶液电导率值A2。48 h后置于沸水浴中30 min,冷却后再次测定水溶液电导率值A3。按照公式计算相对电导率:
相对电导率=(A2-A1)/A3×100%
(1)。
1.3.6 花生发芽势和发芽率的测定 参考白冬梅等[17]的方法。选取成熟饱满、种皮完整、大小一致的种子50粒。常温下浸种8 h后排列于湿润滤纸,设置3次重复,置于28℃人工气候箱恒温培养,培养湿度95%,光强0 μmol·m-2·s-1。分别于培养后第3和第6天测定种子发芽数,并按照公式计算发芽势和发芽率:
发芽势=培养3 d时发芽种子数/供试种子数×100%
(2)
发芽率=培养6 d时发芽种子数/供试种子数×100%
(3)。
1.3.7 胚芽长度和胚芽重量测定 将1.3.6中培养6 d 后的花生用刀片将白色胚芽切下,使用直尺(0.1 mm)量取每根胚芽长度并记录,然后将每个重复的胚芽用千分之一天平称重记录。
1.4 数据分析
采用Origin 9.0软件进行数据处理和作图;并用SPSS 19.0软件进行差异性检验,LSD0.05法进行多重比较,数据均以平均值±标准误表示。
2 结果与分析
2.1 花生荚组成和含水率
由表2可知,收获时HY22、HY20和NH16花生的荚果含水率差异较大,HY22的荚果含水率显著高于HY20(6.58个百分点)和NH16(5.31个百分点)的含水率(表1)。HY22果仁含水率显著高于HY20(26.13个百分点)和NH16(5.38个百分点)的含水率;HY22荚皮含水率与HY20和NH16无显著差异。HY22的荚皮/荚果比重分别显著高于HY20(20.84%)和NH16(25.91%);NH16和HY20果仁/荚果比重显著高于HY22。
2.2 干燥温度对花生营养品质的影响
由表3可知,不同温度处理下HY22和HY20花生的蛋白质、脂肪、硬脂酸、油酸、亚油酸和氨基酸含量变化幅度较小。HY22花生的软脂酸含量经50℃和60℃ 烘干后,与CK相比分别显著降低0.47和0.46个百分点。与CK相比,NH16花生的脂肪含量经50℃、60℃和70℃干燥后,分别显著增加了0.92、1.25和2.09个百分点,硬脂酸含量显著增加了0.30、0.27和0.60个百分点。与CK相比,HY20花生经过40℃和70℃干燥后蛋白质含量分别显著增加0.39和0.70个百分点,氨基酸含量分别显著增加0.55和0.40个百分点,硬脂酸含量仅在70℃干燥后显著增加了0.31个百分点,表明HY20花生营养品质不易受干燥温度的影响。
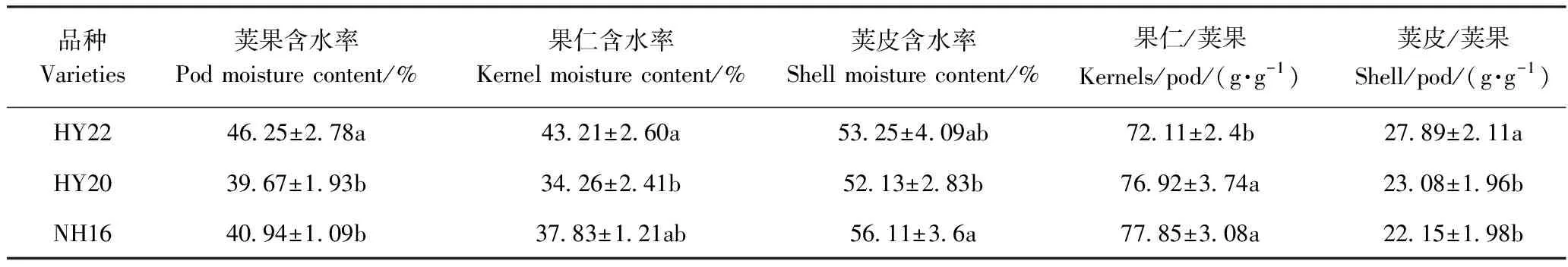
表2 花生荚果组分分析Table 2 Analysis of peanut pod components
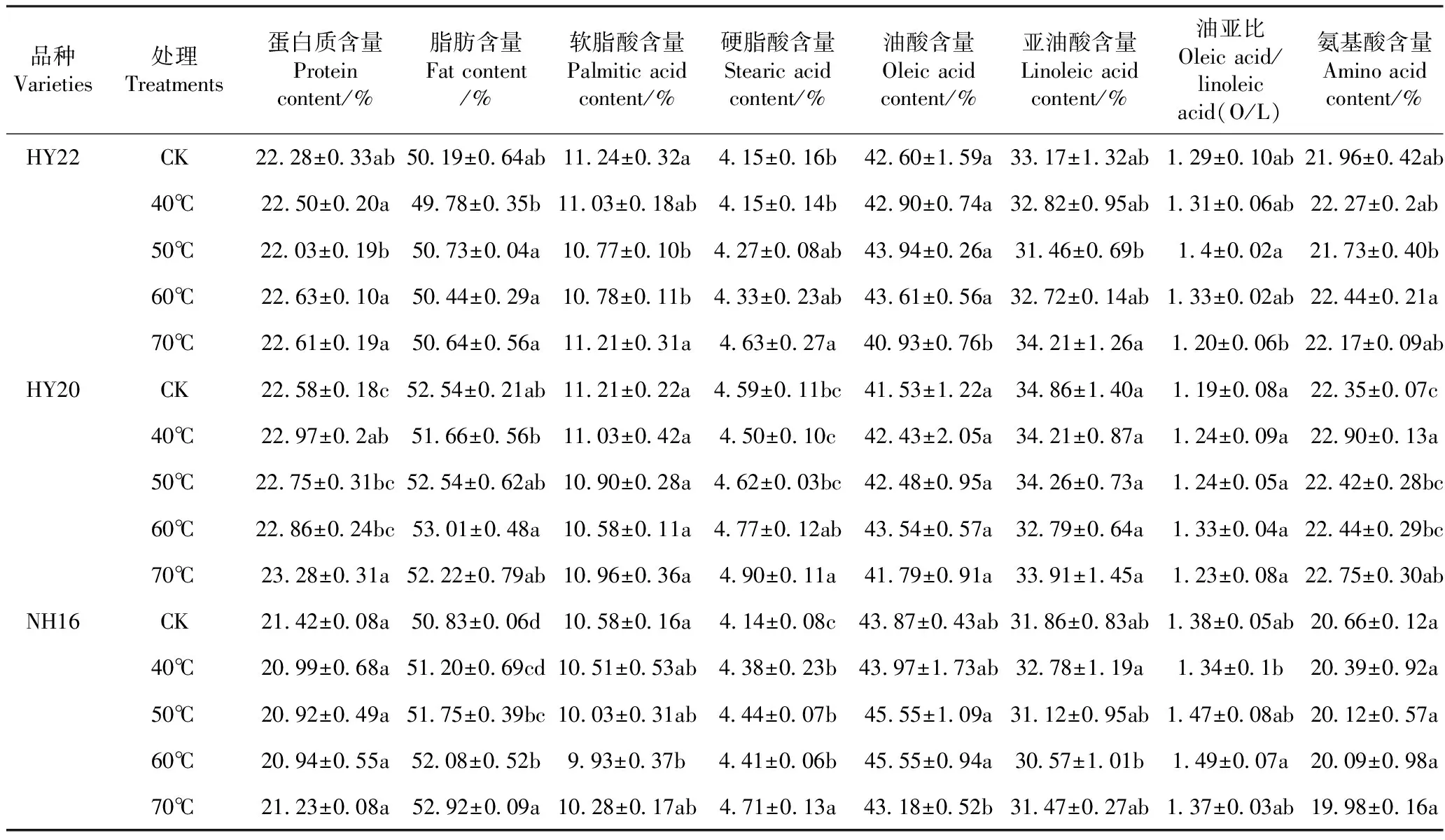
表3 不同干燥温度下HY22、HY20和NH16花生的营养成分变化Table 3 Variation of nutritional ingredient in peanut of HY22、HY20 and NH16 at different drying temperatures
2.3 干燥温度对花生酸价和过氧化值的影响
由表4可知,随着干燥温度的升高,HY22、HY20和NH16花生的酸价和过氧化值均呈增大的趋势。经40℃干燥处理后,HY22、HY20和NH16花生的酸价和过氧化值与CK相比无显著差异;而经50℃、60℃和70℃干燥处理后,HY22花生的酸价较CK分别显著增加了34.88%、65.12%和97.67%,HY20分别显著增加了21.95%、53.65%和75.61%,NH16分别显著增加了28.57%、57.14%和87.80%。经50℃干燥处理,HY22花生的过氧化值显著高于CK,HY20和NH16则与CK差异不显著。与CK相比,经60℃和70℃干燥处理后,HY22花生的过氧化值分别显著增加了34.69%和54.81%,HY20分别显著增加了25.74%和44.08%,NH16分别显著增加了24.63%和52.23%。表明高温干燥促进了花生油脂的氧化酸败,导致花生品质下降。
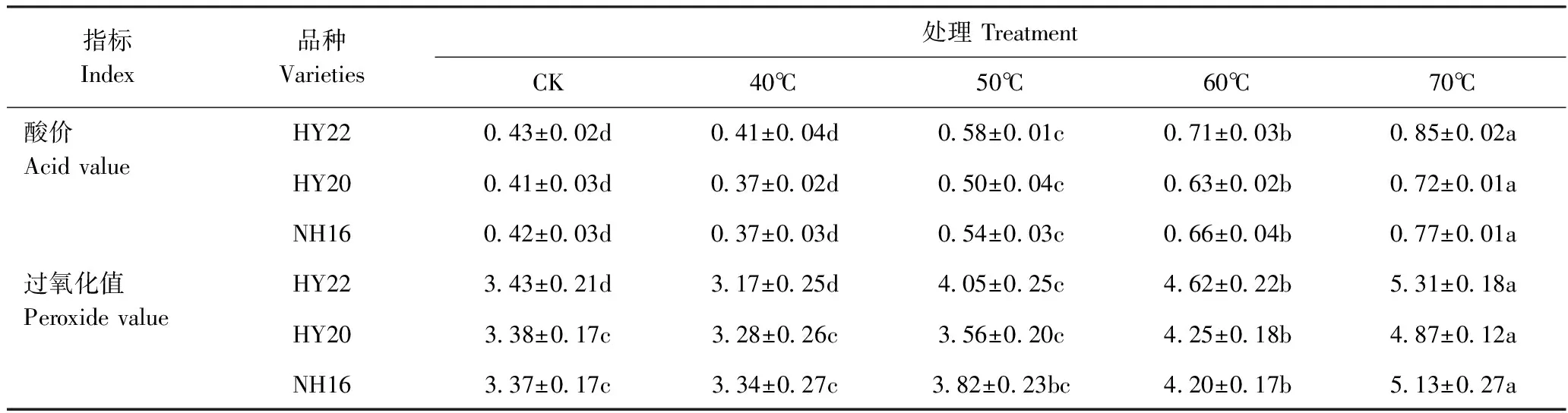
表4 不同干燥温度下HY22、HY20和NH16花生的酸价和过氧化值变化Table 4 Variation of acid and peroxide value in peanut of HY22,HY20 and NH16 at different drying temperatures
2.4 干燥温度对花生发芽特性的影响
2.4.1 质膜透性 由图1可知,随着干燥温度的升高,HY22、HY20和NH16花生的相对电导率值均逐渐增加。当干燥温度为40℃时,HY22花生在浸泡12、24、36和48 h后相对电导率值均显著高于CK,分别是其CK的1.98、1.77、1.64和1.54倍(P<0.05)(图1-A), HY20和NH16的相对电导率与CK差异不显著(P>0.05)(图1-B和1-C)。当干燥温度为50℃时,HY22花生的相对电导率分别是CK的2.40、2.11、1.93和1.84倍,HY20花生相对电导率分别是CK的1.61、1.46、1.40和1.44倍,NH16花生相对电导率分别是CK的3.12、2.71、2.37和2.40倍。当干燥温度为60℃和70℃时,HY22花生种子在浸泡48 h后,其相对电导率分别是CK的3.92和5.68倍,HY20的相对电导率分别是CK的3.87和5.44倍,NH16的相对电导率分别是CK的4.32和5.47倍。说明干燥温度越高,HY22、HY20和NH16花生的相对电导率越大。
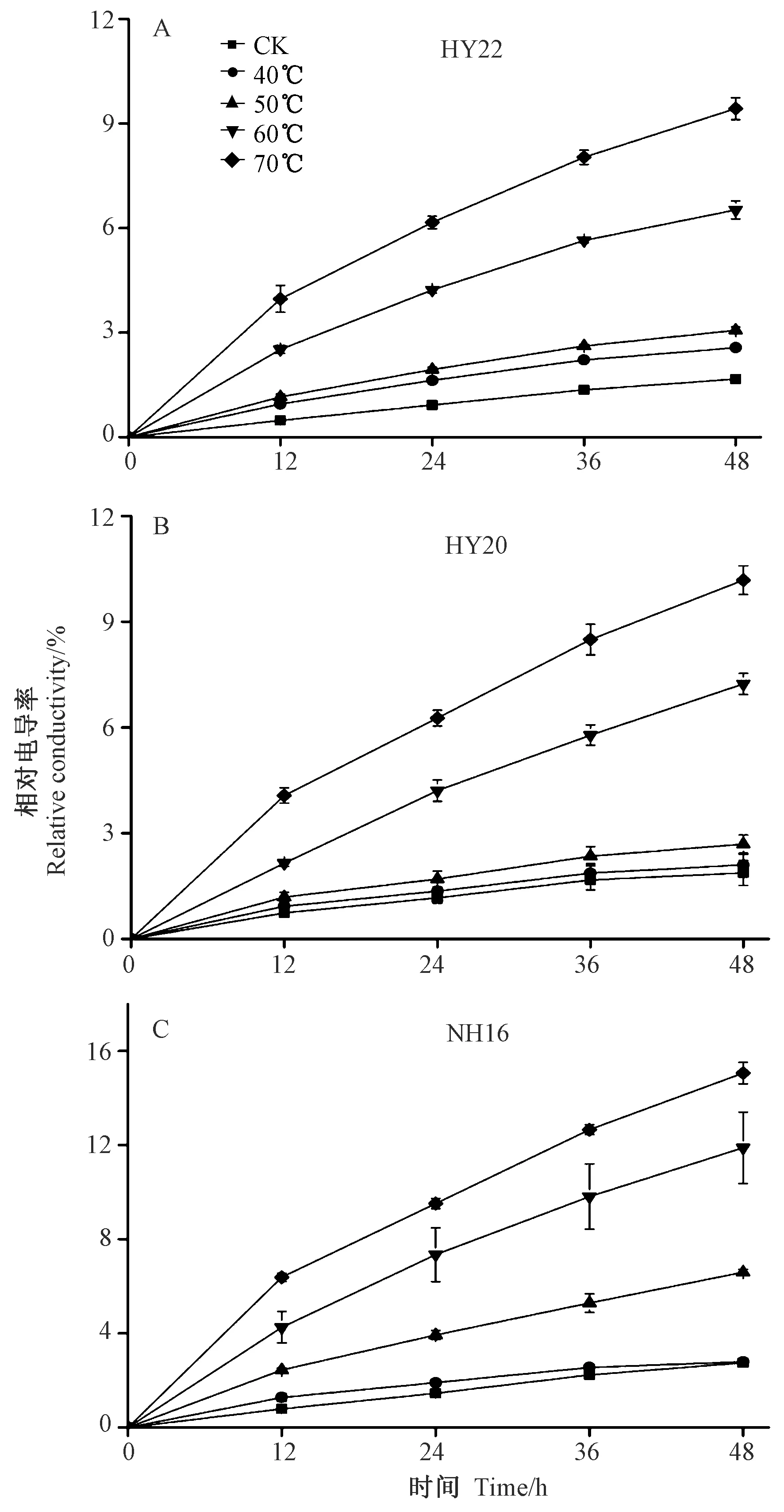
图1 不同干燥温度下HY22、HY20和NH16花生的质膜透性变化Fig.1 Variation of membrane permeability in HY22、HY20 and NH16 at different drying temperatures
2.4.2 发芽势和发芽率 由图2可知,随着干燥温度的升高,HY22、HY20和NH16花生的发芽势和发芽率均呈下降趋势,不同花生品种在同一干燥温度下发芽势和发芽率表现出较大差异。当干燥温度为40℃时,HY22、HY20和NH16花生的发芽势和发芽率均与CK无显著差异。当干燥温度为50℃时,HY22花生的发芽势和发芽率分别比CK显著降低了24.30和6.25个百分点,NH16花生的发芽势比CK显著降低了16.25%个百分点,但对HY20花生的发芽势和发芽率影响不显著。当干燥温度为60℃时,HY22、HY20和NH16的发芽势分别较CK显著降低了81.80、63.75和40.00个百分点,发芽率分别显著降低了83.75、61.25和27.50个百分点。当干燥温度为70℃时,HY22、HY20和NH16的发芽势和发芽率均降为0。表明干燥温度的升高能够抑制花生种子的萌发。
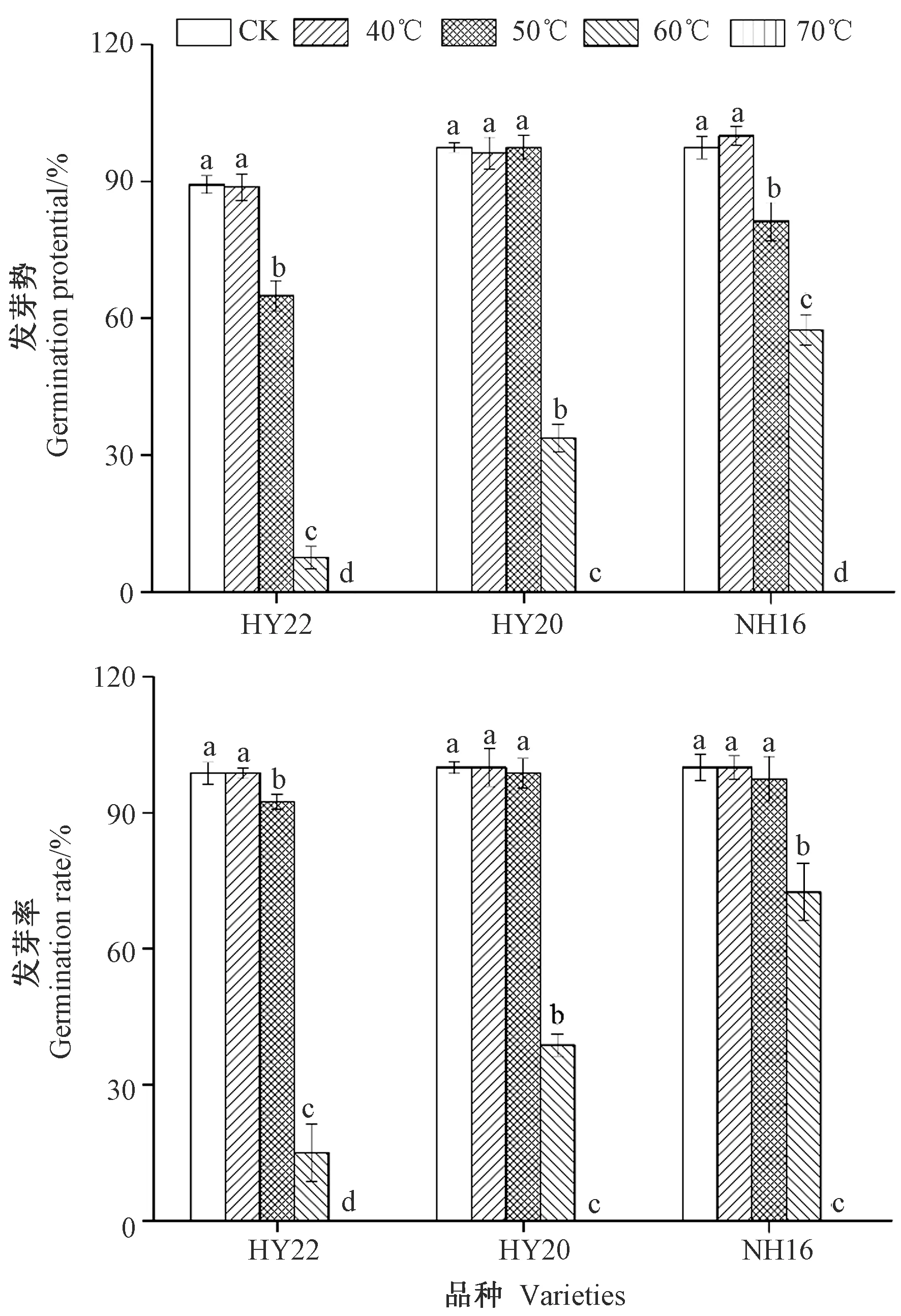
注:不同小写字母表示同一品种不同干燥温度间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level among different drying temperature in the same variety. The same as following.图2 不同干燥温度下HY22、HY20和NH16花生的发芽势和发芽率变化Fig.2 Variation of gemination potential and rate in HY22、HY20 and NH16 at different drying temperatures
2.4.3 胚芽长度和重量 由图3可知,随着干燥温度的升高,HY22、HY20和NH16花生的胚芽长度和胚芽重量均呈下降趋势。当干燥温度为50℃时,HY22的胚芽长度和重量分别比CK显著降低了25.21%和24.61%,NH16花生的胚芽重量显著降低了22.17%,HY20的胚芽长度和重量均与CK差异不显著。当干燥温度为60℃时,HY22、HY20和NH16花生的胚芽长度分别较CK显著降低了89.33%、83.71%和79.43%,胚芽重量分别较CK显著降低了66.17%、77.83%和82.82%。表明干燥温度升高能够抑制花生胚芽的生长。
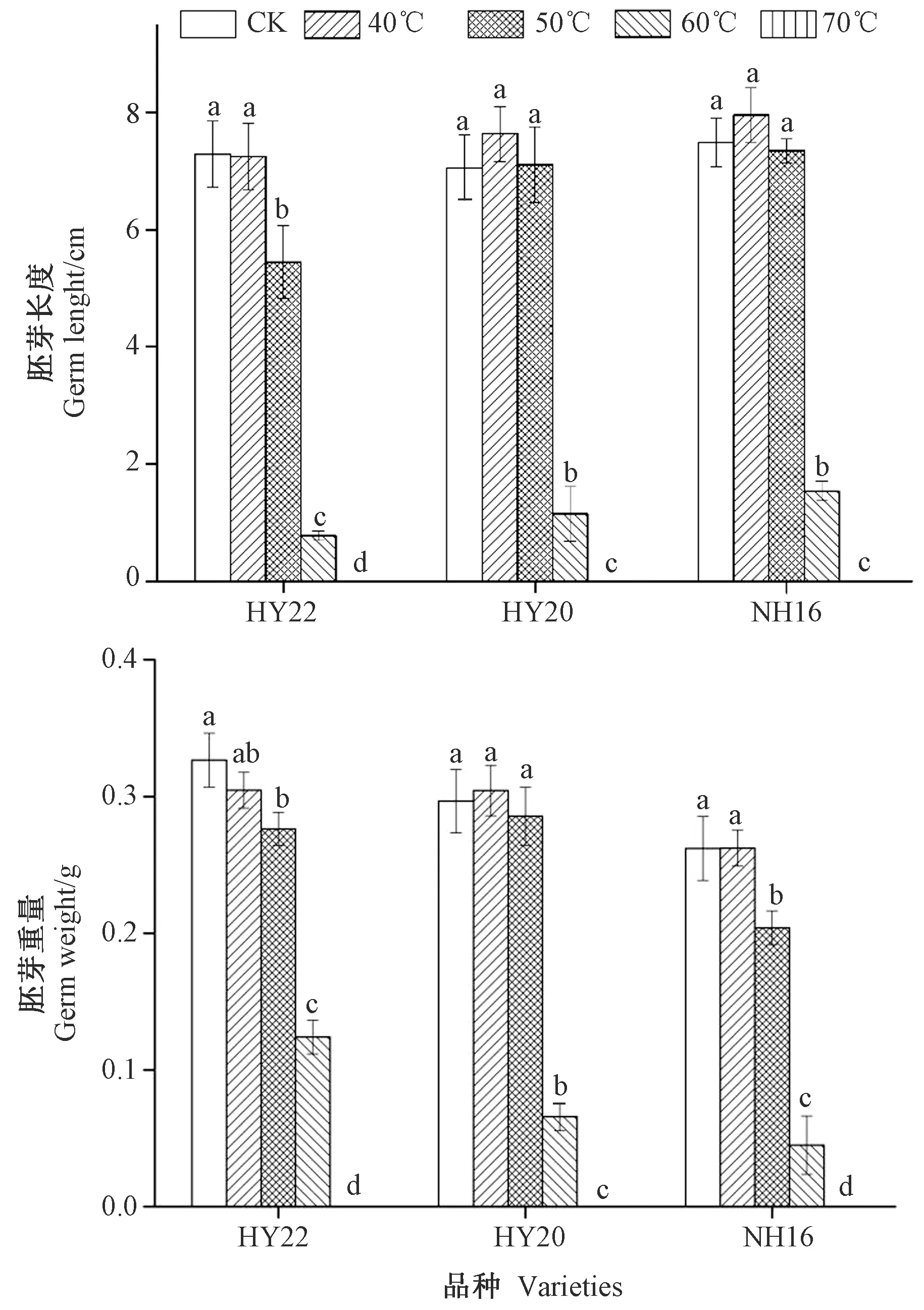
图3 不同干燥温度下HY22、HY20和NH16花生的胚芽长度和重量变化Fig.3 Variation of germ length and weight in HY22、HY20 and NH16 at different drying temperatures
3 讨论
3.1 干燥温度对花生营养品质的影响
花生营养品质指标是衡量花生产品优劣的重要参数。干燥后的花生果仁中,蛋白质和脂肪是主要物质,蛋白质含量一般可达24%~36%,脂肪质含量高达44%~52%,两者共占花生果仁的80%左右[18]。花生果仁中富含不饱和脂肪酸,受到高温时易产生酸败现象,降低花生的品质。酸价值和过氧化值可用来衡量脂肪酸败的程度[19]。本研究发现不同干燥温度下HY22、HY20和NH16花生油脂的酸价和过氧化值均有所增加,增幅为HY22>NH16>HY20,蛋白质、油酸、亚油酸和氨基酸等组分的含量受影响较小。有研究表明,自然晾晒和40℃热风干燥处理方式下花生果仁的粗蛋白和脂肪含量无明显差异[3],干燥温度为64℃时,花生感官品质发生显著变化,花生果仁出现断裂现象[10]。高温热风干燥可引起蛋白质和脂肪变性分解,降低品质和发芽率[20-22],还可降低油脂中不饱和脂肪酸含量[23]。酸价和过氧化值的的升高表明高温促进了花生果仁中脂肪酸水解,产生了大量的过氧化物,促进了果仁中油脂的酸败。高温干燥后花生品质的降低可能是由于脂肪酸败和蛋白质变性所致。
3.2 干燥温度对花生发芽特性的影响
植物细胞代谢活动中,质膜系统起着重要作用,能够调节细胞物质的交流和运输,影响代谢过程中酶的活性。而高温干燥会破坏质膜结构,增加质膜透性,增大细胞浸提液浓度,影响种子内的酶活性,从而降低种子的发芽率[24-25]。本研究发现,随着干燥温度的增加,HY22、HY20和NH16花生的相对电导率均呈增加趋势,发芽势、发芽率、胚芽长度和胚芽重量整体呈现降低趋势。Seyedin等[11]研究表明高温能够造成细胞膜的损伤,引起细胞内电解质和糖分泄露,导致种子发芽率降低,与本研究结果相似。Nautiyal等[26]研究也表明在种子高温干燥过程中,质膜的完整性遭到破坏,可造成种子发芽率下降。此外,高温干燥可使种子细胞间闭塞,细胞内油脂外溢,蛋白质颗粒变性交联,导致种子发芽率降低[12, 27],且干燥脱水后的种胚细胞中同心圆膜状结构的内质网数量增多、面积增大且出现多泡体,回水后不能使其恢复[28]。可见高温干燥破坏了细胞膜脂结构,导致花生种子不能正常萌发。
4 结论
本研究结果表明,干燥可导致大粒形HY22、中粒形HY20和小粒形NH16花生营养品质和发芽性能降低,不同花生品种之间存在一定差异。高温干燥引起HY22、HY20和NH16花生果仁脂肪酸氧化,降低花生的营养品质,但蛋白质、油酸、亚油酸和氨基酸等各组分的含量变化较小。高温干燥过程中HY22、HY20和NH16花生种子质膜结构遭到破坏,引起种子质膜透性增加,同时降低了种子的发芽势和发芽率,抑制了种子萌发和胚芽生长。因此,若干燥后花生留作种用,大粒形HY22干燥温度不宜高于40℃,中粒形HY20和小粒形NH16干燥温度不宜高于50℃;若用于食品加工,HY22、HY20和NH16适宜干燥温度需进一步深入研究。

