基于HOXB8基因的结直肠癌预后模型及列线图的建立与验证
池强伟,赵 畅,李绍堂
池强伟,赵畅,李绍堂,温州医科大学附属第一医院结直肠外科 浙江省温州市 325000
0 引言
结直肠癌(colorectal cancer,CRC)是世界范围内最常见的消化道恶性肿瘤之一,其发病率及病死率仍居高不下,每年有接近140万人的新发确诊病例和70万人的死亡病例[1].尽管近年来多种抗癌策略的发展改善了CRC的治疗效果,但仍有很高比例的患者最终出现局部复发或远处转移,预后非常差[2,3].目前,有一些血清标记物已广泛用于CRC的预后监测,如癌胚抗原、糖类抗原等,但其对CRC的预后价值仍不理想[4-6].因此,鉴定一个敏感的分子标志物来早期发现预后较差的CRC患者对CRC的治疗和预后监测具有重要意义.
Homeobox B8 (HOXB8)基因属于Homeobox基因家族的成员之一,位于17号染色体,其编码的蛋白质是一种参与胚胎发育的序列特异性转录因子[7].据报道,HOXB8在CRC细胞中表达显著上调[8],并且这种情况在CRC发展的各个阶段都有出现[9].然而,目前还没有证据表明HOXB8可以作为一个敏感的生物标记物来预测CRC患者的预后.
本研究基于肿瘤基因组图谱(the cancer genome atlas,TCGA)数据库,收集和分析了CRC患者的HOXB8的mRNA表达信息和相关临床预后资料,探索HOXB8与CRC临床病理特征及预后的关系,建立了具有良好预后判断价值的列线图,为CRC的研究开拓新的思路.
1 材料和方法
1.1 材料 数据来源和处理:从TCGA数据库(http://portal.gdc.cancer.gov)下载临床和生存资料完善的RNA测序数据,包括538个CRC患者样本和44个正常组织样本[10].使用R软件(R version 3.6.0)读入下载的mRNA数据,并将每个mRNA的readcounts值转化成TPM值以便后续进行表达水平比较,接着对探针进行基因名称注释,最终提取HOXB8的mRNA的表达量和相应临床数据.对HOXB8在CRC患者中的表达进行统计分析,并初步评估HOXB8与CRC患者的预后关系.此外,以HOXB8的中位表达量为分组依据将538个CRC样本分为HOXB8高表达组和低表达组,收集并统计其临床基线资料.
1.2 方法 单因素和多因素COX回归分析:首先,我们使用Cox回归模型对CRC患者的相关临床病理因素进行单因素生存分析,包括诊断时的年龄(>65岁,≤65岁)、性别、肿瘤位置、HOXB8表达水平、是否接受放疗、TNM分期(AJCC标准),生存时间包括总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS).接着,将单因素COX分析中有统计学意义的变量纳入多因素COX分析筛选预后相关的风险因素.
1.3 列线图的构建与评价 基于上述建立的多因素COX分析模型,我们使用R软件的survival包和rms (Regression Modeling Strategies)包将预后相关的风险因素可视化建立列线图.接着我们使用一致性指数(concordance index,C指数)、标准曲线[11]和临床决策曲线(decision curve analyses,DCA)[12]来评价列线图的区分度、准确性和临床实用性.
统计学处理所有的统计分析均在R 3.6.0软件中完成,包括HOXB8表达比较、生存分析、单因素和多因素的COX分析、列线图构建、一致性指数的计算、标准曲线和DCA的绘制.HOXB8的mRNA表达量使用log2(TPM+1)表示,两组组间比较采用Wilcoxon检验.临床基线特征的组间差异采用卡方检验.HOXB8的生存分析采用Kaplan-Meier法和Log-rank检验进行分析.P<0.05认为有统计学差异.
2 结果
2.1 CRC患者的临床特征资料和HOXB8的表达情况我们一共统计了538例患者资料,其临床特征资料收入表1.统计分析显示HOXB8高表达与CRC的肿瘤位置(P<0.001)、T分期(P=0.050)相关(表1).HOXB8的表达分析显示HOXB8在CRC肿瘤组织(P<0.001)、右半CRC(P<0.001)、晚期T分期(P=0.024)、M1分期(P=0.0074)中均存在不同程度的表达上调(图1).如图2所示,生存分析显示HOXB8的高表达与CRC患者更差的PFS的相关(P=0.0019).
2.2 单因素和多因素COX分析 在单因素分析中,年龄[HR:2.214 (1.449-3.381),P<0.001]、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、总分期(P<0.001)与CRC患者的OS相关;而HOBX8的高表达[HR:1.742(1.222-2.482),P=0.002]、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、总分期(P<0.001)则与PFS相关(表2).接着我们将单因素分析中有统计学意义的变量如年龄、T、N、M分期纳入OS的多因素COX分析,同时把HOBX8表达水平、T、N、M阶段纳入PFS的多因素COX分析(为避免多重共线性,均没有将总分期与TNM共同纳入多因素分析).在多因素分析中,年龄[HR:2.508 (1.628-3.864),P<0.001]、T阶段(P=0.016)、N阶段(P<0.001)、M阶段(P<0.001)与CRC患者的OS相关;而HOBX8的高表达[HR:1.539 (1.066-2.221),P=0.021]、T阶段(P=0.016)、N阶段(P=0.004)、M阶段(P<0.001)则与CRC患者的PFS相关(表3).
2.3 列线图的构建 经过单因素和多因素COX分析,我们发现HOXB8的表达水平及TNM分期与CRC的PFS相关.为了更好的预测CRC患者的预后情况,我们通过rms包和survival包将上述多因素COX模型可视化建立了列线图(图3).
2.4 列线图的评价 为了评估所建立的列线图的价值,我们计算和构建了C指数、标准曲线和DCA.该列线图C指数的计算结果为0.735,大于0.7提示该列线图的区分度较好.标准曲线的结果显示列线图在估计3年和5年PFS预测值与实际观测值之间展现了较好的可接受的一致性(图4),提示该列线图的准确度较好.另外,DCA分析显示列线图预测3年和5年PFS在较广的阈值概率范围内均表现出良好的净效益,说明该列线图的临床实用性和可靠性较好(图5).
3 讨论
HOX基因是一段长度约183 bp的核苷酸序列,编码高度保守的61个氨基酸的同源结构域.目前,已鉴定出39种人类HOX基因,将其分为HOXA,HOXB,HOXC,HOXD四个簇,分别位于7p15、17p21、12q13和2q31染色体上[13,14].HOXB8是Hox基因家族的一员.近年来越来越多的证据表明HOXB8在人类癌症中表达失调,与多种恶性肿瘤的发生、发展和转移密切相关,包括胃癌,结肠直肠癌和卵巢浆液性癌等[15-17].在CRC中HOXB8能通过激活STAT3诱导上皮细胞-间充质转化(epithelialmesenchymal transition,EMT),进而参与CRC细胞的发生,发展和进展[17].同时,也有研究发现HOXB8的过表达与CRC细胞化疗耐药也存在密切相关[18].Shen等[19]的实验证明miR-196通过上调HOXB8的表达使CRC患者对术前新辅助化疗FOLFOX4方案的治疗反应变差,从而影响患者预后.Lu等[20]的研究中利用HOXB8等7个基因建立了预测肝转移的CRC患者对FOLFOX4化疗方案治疗敏感性的预测模型,并且表现出很好的预测能力.以上发现提示HOXB8有希望成为一个潜在的生物标记物,用于CRC治疗反应检测和预后评估.

表1 来源于肿瘤基因组图谱数据库的538例结直肠癌患者的临床特征资料
TCGA是一个具有里程碑意义的癌症基因组学计划,收集了33种不同癌症类型、11000多个人类肿瘤样本的临床病理数据以及多平台分子图谱,其对于癌症的研究有着不可估量的价值[10].本研究基于TCGA数据库,获得HOXB8的mRNA的表达量数据和相应临床数据并进行统计分析,探索HOXB8在CRC种表达和预后判断价值.
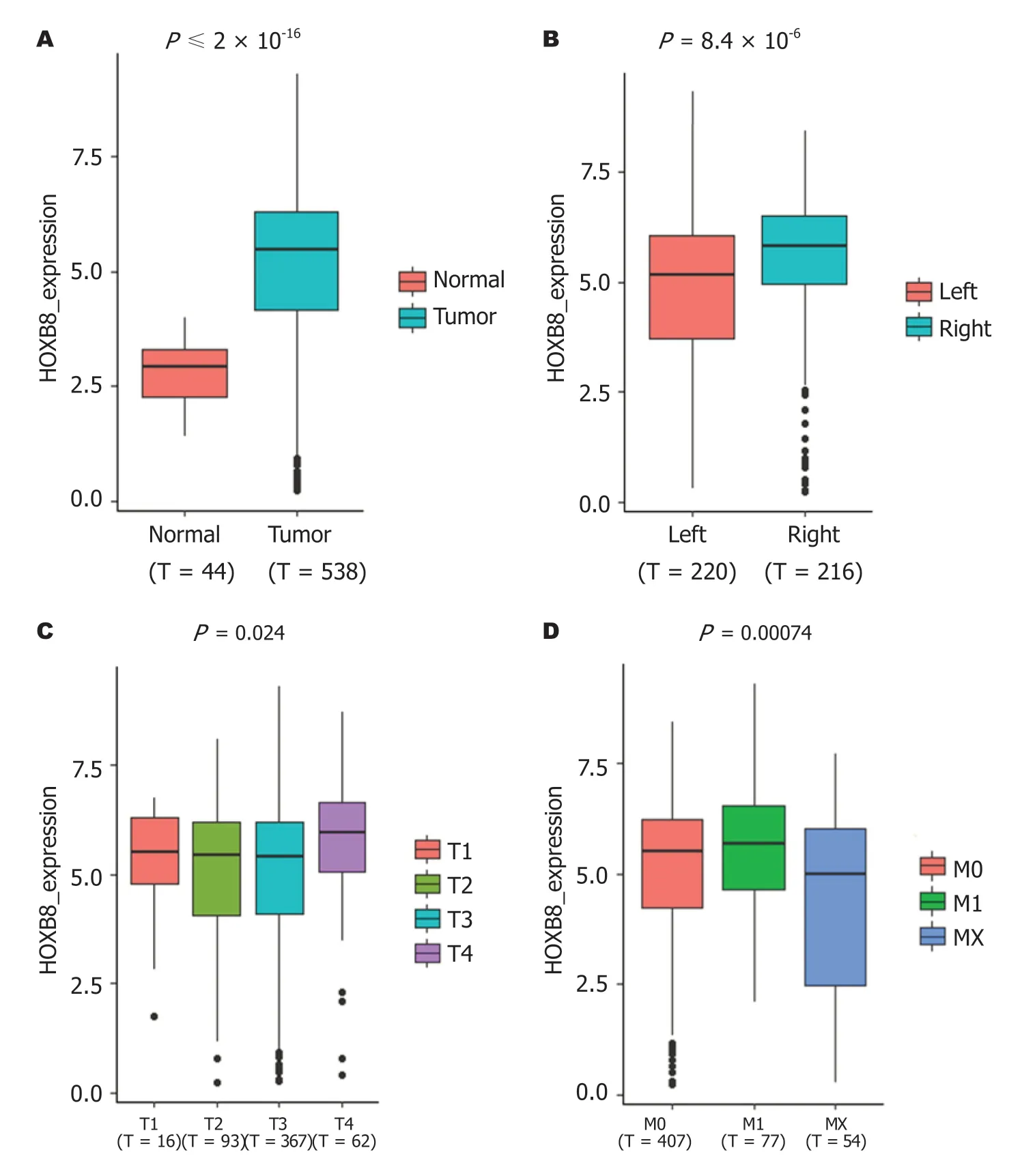
图1 HOXB8在结直肠癌中的表达.A:肿瘤与正常组织;B:左右半结直肠癌;C:T1-4分期;D:M1分期.

图2 HOXB8的生存分析.
本研究首先比较了HOXB8在CRC中的mRNA表达水平,评估其表达与CRC相关临床特征间的关系.我们发现HOXB8在CRC肿瘤组织中显著高表达,同时还与T分期和M分期之间存在密切相关.林飞燕等[21]通过细胞实验证明高表达的HoxB8基因能够促进CRC细胞的增殖和克隆形成能力,同时HoxB8能够增强CRC细胞的迁移能力.这与本研究结果相一致,都提示了HOXB8在肿瘤发生发展、局部浸润和远处转移中起重要作用.其次,我们还发现HOXB8在不同肿瘤位置的CRC中也有差异表达.以往的研究已经证明左半和右半CRC之间在病理类型、临床表现、预后与化疗耐药等方面均存在显著不同[22-24].然而,其潜在的分子机制还不甚清楚.对HOXB8深入探索或许能为研究左右半结肠癌提供新的思路.另外,HOXB8的生存分析也表明其表达与CRC患者的PFS密切相关.因此,我们推断HOXB8可能在CRC的发生发展中起到了关键作用,导致结果截然不同的化疗耐药和预后.
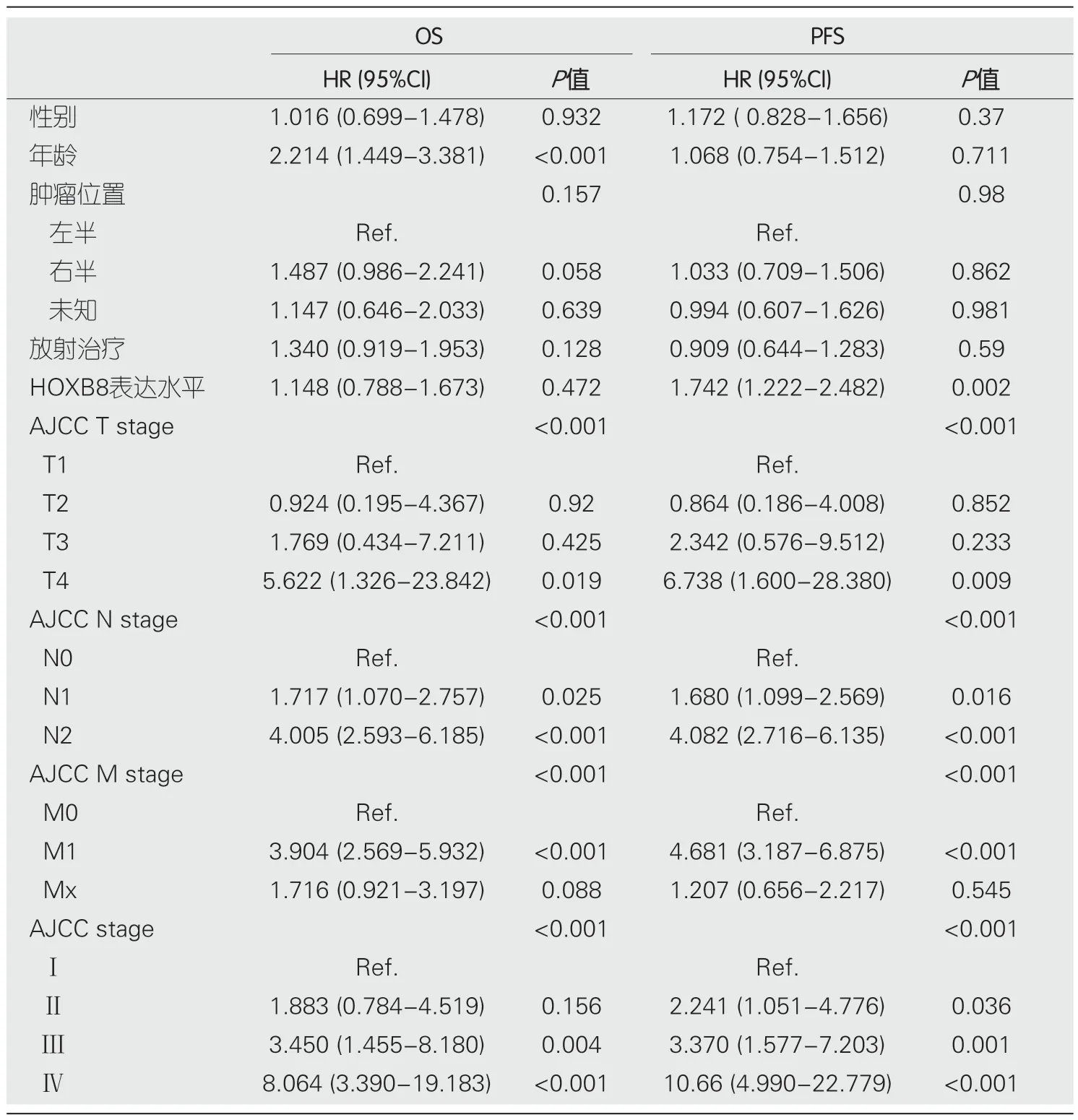
表2 结直肠癌患者的总生存期与无进展生存期的单因素COX分析
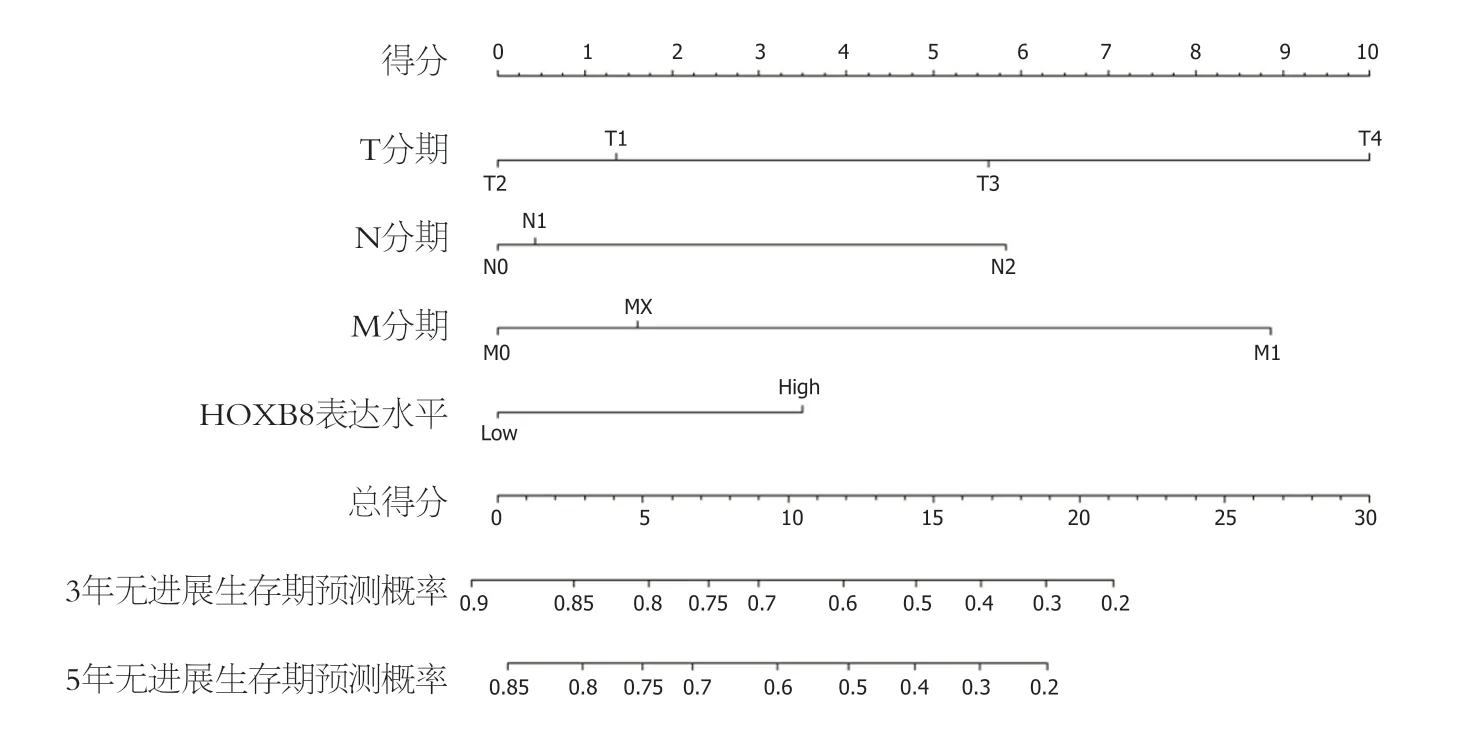
图3 结直肠癌患者的3年和5年无进展生存期预测列线图.
其次,为了评估HOXB8在CRC中的预后价值,我们进行了单因素和多因素COX分析,发现HOXB8的表达水平、TNM分期是CRC患者独立预后因素.为了更好的预测CRC患者的PFS,我们依据上述的预后因素将COX模型可视化后建立了列线图,并全面地对其进行评价,结果发现HOXB8在预测CRC患者3年和5的PFS中表现良好.这些结果进一步证明了HOXB8在CRC中预后价值.
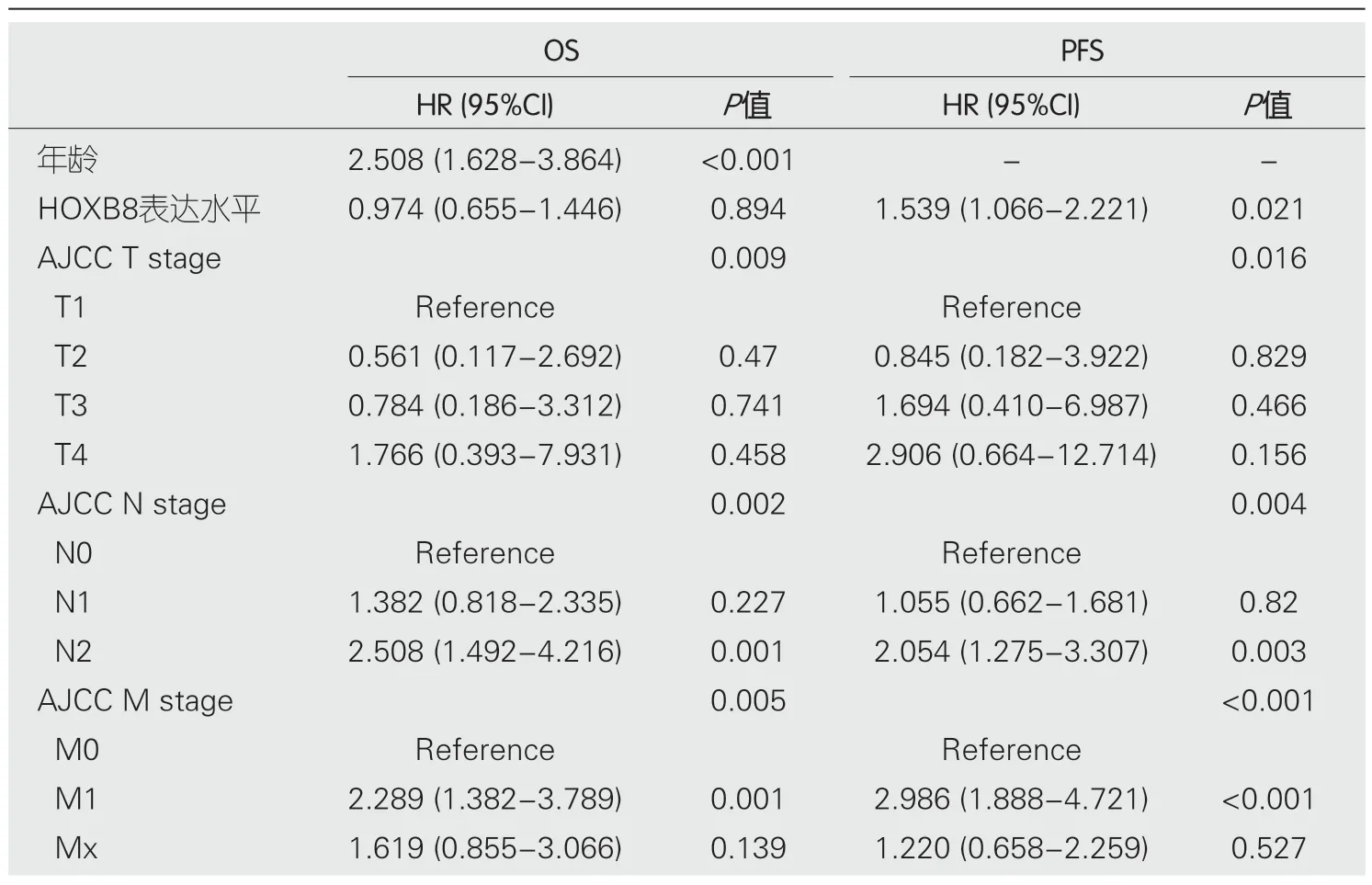
表3 结直肠癌患者的总生存期与无进展生存期的多因素COX分析

图4 列线图预测3年和5年无进展生存期的标准曲线.A:3年无进展生存期(progression-free survival,PFS)的预测;B:5年PFS的预测.PFS:无进展生存期.

图5 列线图预测3年和5年无进展生存期的临床决策曲线.A:3年无进展生存期(progression-free survival,PFS)的临床决策曲线(decision curve analyses,DCA);B:5年PFS的DCA.
4 结论
综上所述,HOXB8的表达与CRC患者预后密切相关,对CRC患者的疾病进展和复发具有一定的预测能力.HOXB8可以作为一种潜在的生物标记物来识别高危CRC患者,有希望成为CRC的新治疗靶点和预后监测指标.同时,还需要进行更深入的分子基础研究和随机化临床试验,来揭示HOXB8与CRC患者的预后之间的作用机制及HOXB8在CRC中的临床应用.
文章亮点
实验背景
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,目前CRC患者仍有很高比例的复发和远处转移,严重影响预后.同时,HOXB8与CRC发生发展相关.
实验动机
基于CRC的转移和复发居高不下,本研究旨在探讨HOXB8基因在CRC患者预后中的判断价值,为监测高危CRC的疾病进展和复发提供思路.
实验目标
本研究希望了解HOXB8基因的表达与CRC患者相关病理特征及预后的联系,并利用HOXB8建立一个全新的及有价值的CRC预后模型.
实验方法
通过分析肿瘤基因组图谱数据库中的HOXB8表达数据与CRC临床病理因素及生存预后之间的关系,然后基于HOXB8建立一个新的CRC预后模型及列线图,并对其进行全面科学的验证和评价.
实验结果
HOXB8主要在CRC肿瘤组织、右半CRC及较晚的临床分期中呈现高表达.生存分析显示HOXB8的高表达与CRC患者更差的无进展生存期的相关.基于HOXB8建立的CRC预后模型及列线图具有良好的预测价值.
实验结论
HOXB8的表达与CRC患者预后密切相关,对CRC患者的疾病进展和复发具有一定的预测能力.
展望前景
HOXB8可以作为一种潜在的生物标记物来识别高危CRC患者,有希望成为CRC的新治疗靶点和预后监测指标.

