冠心康调控巨噬细胞miRNA-155与SOCS1-STAT3-PDCD4生物轴抗动脉粥样硬化研究*
秦合伟,李彦杰,郭 宁,刘志勇
(1. 河南省中医院,郑州 450002;2. 河南中医药大学第二附属医院,郑州 450002;3. 河南中医药大学,郑州 450002)
动脉粥样硬化(athcrosclerosis,AS)是缺血性心脑血管疾病的基本病理基础。一般认为,脂质代谢紊乱、血液流变学异常和炎性反应是促使动脉粥样硬化斑块形成的危险因素[1]。新近研究发现,参与动脉粥样硬化的炎症细胞中,在趋化因子以及多种细胞因子的共同作用下,外周血单核细胞分化成巨噬细胞,然后迁移到动脉内膜吞噬脂质后形成泡沫细胞,泡沫细胞不断积累后形成脂质核心,与纤维帽及炎症因子共同组成动脉粥样硬化斑块,在动脉粥样硬化的发生及斑块形成过程中,巨噬细胞介导多种炎症信号通路[2]。miRNAs在调节AS发生发展中具有重要作用,单核/巨噬细胞、内皮细胞及血管平滑肌细胞都参与AS的发生发展,miR-155是非编码的微小RNA之一,研究发现其可表达于活化的免疫细胞并与免疫功能相关。新近研究发现,miR-155具有促进炎症反应发生及放大炎症反应的作用。该研究证实,miR-155通过调控细胞因子信号传导抑制剂l(SOCS1, 抑炎因子)/磷酸化转录激活子 3(p-STAT3, 促炎因子)炎症信号通路,进而调控程序性细胞凋亡因子4(PDCD4),影响肿瘤坏死因子-a(TNF-α)、白细胞介素6(IL-6)、干扰素-γ(IFN-γ)3种炎症因子在斑块及血清中的表达,减少动脉粥样硬化的炎症反应以及减少动脉粥样硬化最终事件的发生[3]。本实验通过观察冠心康对miR-155和SOCSl/p-STAT3/PDCD4炎症信号通路的调控作用,以及对TNF-α、IL-6、IFN-γ等炎症因子的影响,探索中医药抗动脉粥样硬化的作用机制,为中医药防治心脑血管疾病提供实验依据。
1 材料
1.1 动物与细胞
雄性SD大鼠20只,体质量(300±20)g,购自南京大学模式动物研究所,动物许可证号SCXK(苏)2015-0001。RAW 264.7只小鼠巨噬细胞株购自ATCC,所有动物饲养于河南中医药大学第二附属医院动物实验中心,(22±1)℃恒温、60%~75%恒湿、12 h循环照明,自由摄食、饮水。本实验已通过河南中医药大学第二附属医院实验动物伦理委员会审查(批准标号20170228)。
1.2 药物与试剂
本研究所用中药复方为冠心康。药物组成:黄芪30 g,全栝楼15 g,赤芍12 g,丹参12 g,薤白12 g,半夏12 g,益母草30 g。方中所有中药均来源于河南中医药大学第二附属医院药剂科,由医院煎药房按要求煎煮和浓缩成不同浓度的汤剂(冠心康高剂量浓度3.456 g/mL,冠心康低剂量浓度0.864 g/mL)。
荧光定量PCR试剂盒购自TaKaRa公司;RNA逆转录试剂盒购自Fermentas公司;蛋白提取试剂盒购自碧云天公司;抗体pri-miR-126、RGS16和GAPDH均购自Cell Signaling公司;抗体CXCL12、CXCR4和VCAM-1购自Dako公司;二抗(羊抗小鼠IG-HRP)和氧化型低密度脂蛋白(OX-LDL)购自武汉博士德生物工程有限公司;Anti-miR-155引物由广州锐博生物科技有限公司设计和合成。
2 方法
2.1 含药血清的制备
将20只雄性健康SD大鼠按随机数字表法分为中药高剂量组、中药低剂量组2组,高剂量组(10只) 以冠心康86.4 g/(kg·d) 灌胃,低剂量组(10只)以冠心康21.6 g/(kg·d) 灌胃,每日早晚2次,连续5 d。末次给药后1 h,腹腔注射水合氯醛(350 mg/kg)麻醉,腹主动脉取血,37 ℃静置1 h,3000 r/min离心10 min,分离血清放入离心管中,0.45 μm微孔滤膜过滤除菌分装,-20 ℃保存备用。
2.2 细胞分组与造模
RAW264.7细胞经培养、传代、活力检测、免疫化学鉴定,采用ox-LDL刺激RAW264.7巨噬细胞建立模型。造模后按照干预方法不同分为5组:对照组:空白血清;miR-155 mimic组:造模后参照脂质体2000说明书转染微小RNA-155 mimic转染进入RAW264.7细胞;miR-155 inhibitor组:造模后参照脂质体2000说明书转染微小RNA-155 inhibitor转染进入RAW264.7细胞;含药血清高剂量组:造模后采用高剂量冠心康含药血清干预;含药血清低剂量组:造模后采用低剂量冠心康含药血清干预。处理48 h后进行观察,收集细胞总RNA和总蛋白并进行后续检测。
2.3 药物血清干预
血清作用于RAW 264.7细胞:将第3~5代RAW 264.7细胞弃去培养基,用PBS温和洗3遍,分别加入中药高剂量和中药低剂量含药血清的RPMI 1640培养基,在37 ℃ 5% CO2孵箱中培养。
2.4 RAW264.7细胞转染
在无菌条件下,用含有10% FBS的细胞培养基DMEM,将RAW264.7细胞(1×105cells·mL-1)接种于6孔板,每孔含有2 mL培养基;在37 ℃ 5% CO2细胞培养箱中孵育片刻备用;取miR-155 mimic (20 μM) 0.6 μL和HiPerFect转染试剂12 μL滴加入300 μL不含FBS和抗生素的DMEM细胞培养基,混合均匀使其终浓度为5 nM;取miR-155 inhibitor (20 μM) 6 μL和HiPerFect转染试剂12 μL滴加入300 μL细胞培养基DMEM(不含FBS和抗生素),混合均匀使其终浓度为5 nmol/L。在室温条件下(15~25 ℃)放置 5~10 min,直至形成转染复合物;将转染复合物分别均匀滴入上述接种RAW264.7细胞培养基中混合均匀;在37 ℃ 5% CO2细胞培养箱中孵育24 h后更换所需的培养基,等到RAW264.7细胞的融合度约达到80%时终止细胞培养,用细胞刮轻轻刮取细胞,以提取RAW264.7细胞的RNA和总蛋白[4]。
2.5 指标及检测方法
2.5.1 RT-PCR检测RAW264.7细胞中miR-155、SOCSl、p-STAT3、PDCD4 mRNA表达 表1示,收集RAW264.7细胞分离提取总RNA,逆转录成cDNA,以cDNA为模板,采用SYBR Green进行qRT-PCR反应;反应参数:95 ℃ 30 s,1个循环;95 ℃ 5 s,55 ℃ 10 s,40个循环[5],样本中目的基因的计算方法为2-ΔΔCT,GAPDH为内参。

表1 miR-155、SOCSl、p-STAT3、PDCD4的引物序列
2.5.2 Western blotting检测RAW264.7细胞中SOCSl、p-STAT3、PDCD4蛋白表达 收集RAW264.7细胞PBS洗涤3次,用试剂盒提取蛋白后,采用BCA蛋白定量法测定蛋白浓度,6%~15% SDS聚丙烯酰胺凝胶进行蛋白电泳,蛋白分离后恒定电流200 mA转膜至PVDF膜上;室温下5%脱脂奶粉封闭2 h,用相应的一抗按照1∶1000稀释,4 ℃孵育过夜,洗涤后换HRP标记二抗,按照1∶5000稀释,室温孵育2 h,TBST洗涤3次,洗涤后采用化学发光试剂盒在GE ImageQuant LAS 4000mini超灵敏化学发光成像仪显影,使用Image J的软件分析条带灰度值测定目的条带和内参β-actin的灰度值,结果以样本灰度值/内参灰度值表示[5]。
2.5.3 Elisa法检测RAW264.7细胞分泌TNF-α、IL-6、IFN-γ等炎症因子水平 取干预后细胞上清液,Elisa实验测定TNF-α、IL-6、IFN-γ水平。严格按照Elisa试剂盒说明操作,TNF-α、IL-6、IFN-γ的可测范围分别为4~500、30~4000、15~2000 ng/L,重复3次实验,各组上清液标本平行检测3次[5]。
2.6 统计学方法

3 结果
3.1 含药血清对细胞中miR-155、SOCSl、p-STAT3、PDCD4 mRNA表达的影响
表2示,与对照组比较,miR-155mimic组和中药含药血清组RAW264.7细胞中miR-155和SOCSl mRNA表达明显升高(P<0.05),miR-155inhibitor组RAW264.7细胞中miR-155和SOCSl mRNA表达明显降低(P<0.05);与对照组比较,miR-155mimic组和中药含药血清组RAW264.7细胞中p-STAT3和PDCD4 mRNA表达明显降低(P<0.05),miR-155inhibitor组RAW264.7细胞中p-STAT3和PDCD4 mRNA表达明显升高(P<0.05);各中药含药血清组RAW264.7细胞中miR-155、SOCSl、p-STAT3、PDCD4 mRNA表达水平比较差异无统计学意义(P>0.05)。

表2 含药血清对细胞中 miR-155、SOCSl、p-STAT3、PDCD4 mRNA表达的影响
3.2 含药血清对细胞中SOCSl、p-STAT3、PDCD4蛋白表达的影响
表3图1示,与对照组比较,miR-155mimic组和中药含药血清组RAW264.7细胞中SOCSl蛋白表达明显升高(P<0.05),miR-155inhibitor组RAW264.7细胞中SOCSl蛋白表达明显降低(P<0.05)。与对照组比较,miR-155mimic组和中药含药血清组RAW264.7细胞中p-STAT3和PDCD4蛋白表达明显降低(P<0.05),miR-155inhibitor组RAW264.7细胞中p-STAT3和PDCD4蛋白表达明显升高(P<0.05)。各中药含药血清组RAW264.7细胞中SOCSl、p-STAT3、PDCD4蛋白表达水平比较差异无统计学意义(P>0.05)。
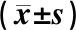
表3 含药血清对细胞中SOCSl、p-STAT3、PDCD4蛋白表达的影响
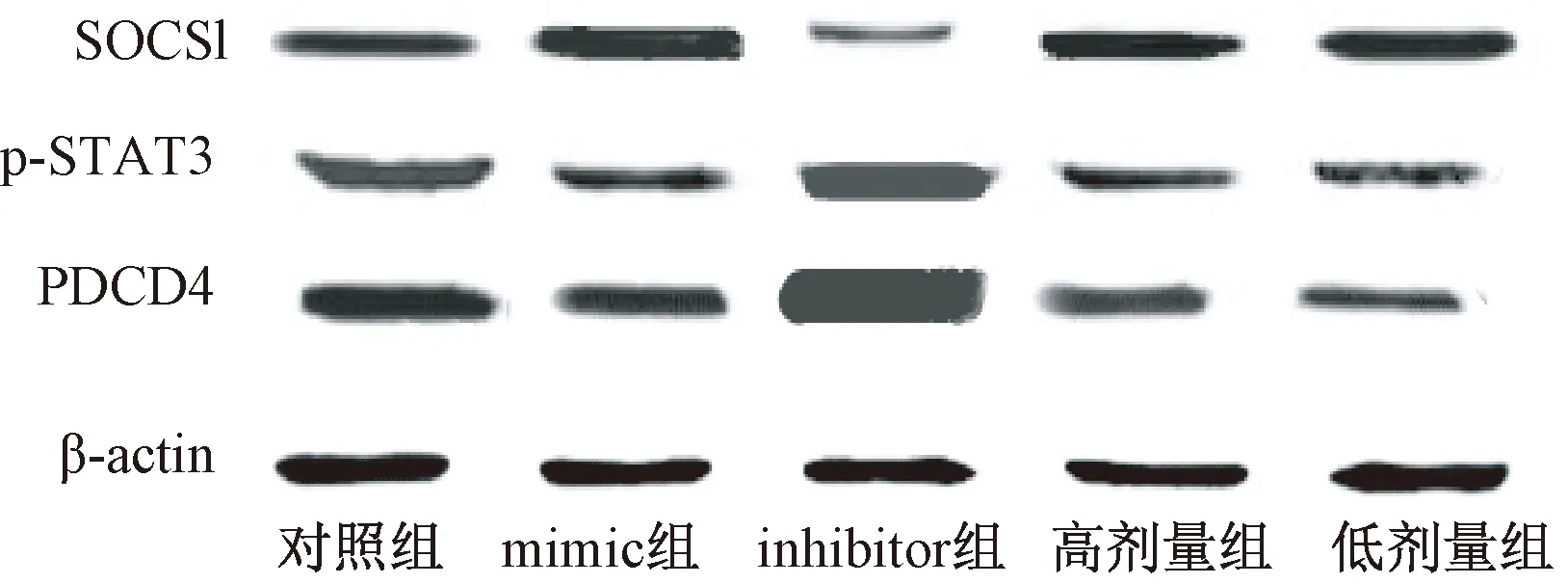
图1 含药血清对细胞中SOCSl、p-STAT3、PDCD4蛋白表达的影响
3.3 含药血清对细胞液TNF-α、IL-6、IFN-γ水平的影响
表4示,与对照组比较,miR-155mimic组和含药血清组细胞液中TNF-α、IL-6、IFN-γ水平明显降低(P<0.05),miR-155inhibitor组细胞液中TNF-α、IL-6、IFN-γ水平明显升高(P<0.05)。各含药血清组细胞液中TNF-α、IL-6、IFN-γ水平比较差异无统计学意义(P>0.05)。
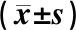
表4 含药血清对细胞液TNF-α、IL-6、IFN-γ水平的影响
4 讨论
研究发现,动脉内皮损害是动脉粥样斑块形成的重要始动因素,AS的发生是由于血管内皮细胞和平滑肌细胞受到各种危险因子损伤时,血管局部产生的一种过度的慢性炎性增生反应,miRNAs在调节AS发生发展中具有重要作用,单核/巨噬细胞、内皮细胞及血管平滑肌细胞都参与AS的发生发展,而miRNAs对这几种细胞的功能均具有调节作用,miRNAs是抗AS药物的潜在作用靶点[3]。
miR-155是非编码的微小RNA之一,研究发现其可表达于活化的免疫细胞并与免疫功能有关,且与心血管疾病和动脉粥样硬化发生发展密切相关[6]。研究认为,miR-155能抑制炎症反应,减少黏附因子和趋化因子表达,从而抑制炎症反应[7]。动物研究在miR-155-/-/ApoE-/-双基因敲除模型小鼠中发现,miR-155的表达缺乏可明显降低巨噬细胞的炎症浸润程度及减慢动脉粥样硬化的形成[8]。研究发现,过表达miR-155可使炎症反应加强,促进泡沫细胞的生成,进而加速动脉粥样硬化的形成进程[9]。PDCD4是一种肿瘤抑制因子,在巨噬细胞中,PDCD4可以通过激活转录因子(NF-κB)抑制白介素10(IL-10)的表达,进而促进炎症反应,PDCD4还能够通过增殖及诱导内皮细胞、血管平滑肌细胞和成纤维细胞等引起各种细胞的凋亡[10-11]。SOCS1是一种重要的炎症负向调控因子,其主要功能为通过抑制TNF-α、IL-6、INF-γ等各种炎症细胞因子的产生,进而抑制炎症反应。SOCSl也是miR-155的目标靶基因,miR-155可以直接与SOCSl结合逆向调节巨噬细胞的炎症反应[12],而且巨噬细胞中的miR-155也可以通过SOCSl信号传感器和活化的STAT3信号途径,促进心脏肥大和功能衰竭[13]。新近研究发现,miR-155具有促进及放大炎症反应的作用。该研究证实,miR-155通过调控SOCS1/p-STAT3炎症信号通路,进而调控PDCD4,影响TNF-α、IL-6、INF-γ炎症因子在斑块中及血清中的表达,降低动脉粥样硬化的炎症反应以及动脉粥样硬化最终事件的发生[3]。
本课题组结合前期研究认为,痰瘀证是动脉粥样硬化的主要证型,提出益气活血、化痰降浊的治疗大法。“方从法出,以法统方”。本研究方药冠心康由《金匮要略》栝楼薤白半夏汤化裁而来,其中生黄芪为君药,丹参和赤芍为臣药,可益气活血、祛瘀通络,佐以栝楼、薤白化痰降浊,通阳散结;制半夏燥湿化痰,益母草活血通经、利水泄浊,全方补泻兼施、升降同调、相辅相成,共奏益气健脾、化痰泄浊、活血祛瘀之功效。前期研究结果表明,冠心康抗动脉粥样硬化的作用与抗炎、保护血管内皮、抑制血小板聚集和调节免疫等多种生物效应有关[14];新近研究还表明,冠心康具有调节抑制血小板活化的作用,同时冠心康可能通过阻断SDF-1/CXCR4生物轴,下调EPC上CXCR4表达,减弱其下游信号途径,控制骨髓源性内皮祖细胞动员及募集,从而抑制EPC的生物学功能途径,起到抗动脉粥样硬化的作用[15-17]。
本实验采用ox-LDL刺激RAW264.7巨噬细胞,建立动脉粥样硬化模型,观察冠心康对RAW264.7细胞miRNA-155和SOCS1-STAT3-PDCD4生物轴的调控,以及对TNF-α、IL-6、IFN-γ的影响,从分子、细胞层次揭示中药复方冠心康防治AS的分子机制,为AS相关疾病的防治提供新思路。本研究结果再次验证miRNA-155能够调控SOCS1-STAT3-PDCD4生物轴,影响TNF-α、IL-6、IFN-γ表达,同时表明冠心康含药血清能够提高ox-LDL损伤模型RAW264.7细胞中miR-155 mRNA、SOCSl表达水平,降低p-STAT3和PDCD4表达,降低细胞液中TNF-α、IL-6、IFN-γ水平。研究结果说明,冠心康抗动脉粥样硬化的分子机制可能与调节miR-155、调控SOCSl/p-STAT3/PDCD4炎症信号通路、降低TNF-α、IL-6、IFN-γ等炎症因子表达有关。

