硫堇修饰多壁碳纳米管电极电化学测定人血清中的蛋白质
董丹秀,潘若辰,张伟禄,†,杨丽珠
(1.温州大学化学与材料工程学院,浙江温州 325035;2.温州医科大学药学院,浙江温州 325035)
蛋白质是一类生物有机大分子,是生命的物质基础,也是构成细胞的基本的物质.蛋白质在完成有机体内的生化代谢和有机体多样的生理功能中发挥着非常重要的作用.因此,蛋白质的定量分析在临床医学和生命科学的研究中是非常重要的.目前,定量测定蛋白质的方法主要有比色分析法[1-2]、荧光分析法[3-4]和共振光散射法[5]等.也有文献报道利用蛋白质与有机染料小分子、药物小分子等相互作用来测定蛋白质的浓度,但多采用光谱分析法[6-7].电分析化学法具有操作简便、高灵敏度和高选择性等优点,同时不会受到颜色的干扰,近年来在生命科学领域中有着广泛的应用.硫堇(Thionine, TH)是一种结构对称,具有芳环π-π共轭体系,带有正电荷的吩噻嗪类阳离子染料,因其具有紫外吸收和电化学活性,故可使用光谱及电化学方法进行研究[8-10].1991年,碳纳米管由日本科学家饭岛博士(Iijima S.)首次发现[11].它是一种针状的管形的碳单质,具有稳定晶体结构,同时具有导电性好、比表面积大及较高催化活性等优点,近年来在电化学传感器方面受到颇多关注[12-15].
本文利用硫堇通过π-π共轭作用修饰到多壁碳纳米管电极上,制备成硫堇/多壁碳纳米管修饰电极作为工作电极,利用硫堇与蛋白质之间的相互作用构建了一种简便的电化学定量检测蛋白质的方法.该方法简单、有效,具有很好的稳定性和重现性,可用于检测人血清样品中蛋白质含量.
1 实验部分
1.1 仪器与试剂
1.1.1 仪 器
电化学实验在电化学系统(上海辰华仪器有限公司, CHI660a)上进行.三电极体系:多壁碳纳米管(Multiwall Carbon Nanotubes, MWNTs)修饰玻碳电极(GCE)为工作电极,铂丝为对电极,Ag/AgCl电极为参比电极.紫外-可见光谱图在紫外-可见分光光度仪(Varian Cary 50)上测定.pH值在pH计(上海科学精密仪器有限公司, PHS-3C)中测定.
1.1.2 试 剂
牛血清白蛋白购自北京鼎国生物技术有限公司,溶菌酶(Lyso)购自上海伯奥生物科技有限公司,人血清白蛋白(HSA)和硫堇购自Sigma-Aldrich公司,上述样品配制成一定浓度的储备液,置于4℃的冰箱.羧基化的多壁碳纳米管(直径在40 - 60 nm之间,纯度 > 95%)购自深圳纳米港高科技有限公司.二甲基甲酰胺(DMF)购自上海第四试剂厂.缓冲溶液的配制:磷酸盐缓冲溶液(PBS)由一定量的0.2 mol/L NaH2PO4溶液和0.2 mol/L Na2HPO4溶液混合;NaAc-HAc缓冲溶液由一定量的0.2 mol/L NaAc溶液和0.2 mol/L HAc溶液混合;Britton-Robinson(B-R)缓冲液由0.04 mol/L H3PO4、0.04 mol/L HAc和 0.04 mol/L H3BO3溶液混合,再用0.2 mol/L NaOH溶液调节pH值.其它试剂均为分析纯.实验用水为超纯水,实验在室温下进行.
1.2 实验方法
1.2.1 多壁碳纳米管修饰电极(MWNTs/GCE)的制备
在高温条件下,将多壁碳纳米管在2.0 mol/L的硝酸中搅拌回流纯化7 h,然后在浓盐酸中超声分散1 h,之后用超纯水冲洗至中性[16],放入60℃的烘箱干燥12 h后备用.将2.0 mg的多壁碳纳米管加入到1.0 mL的DMF中,超声3 h分散得到黑色多壁碳纳米管-DMF分散液.玻碳电极在0.3 μm和0.05 μm氧化铝粉末中抛光,再分别用丙酮、乙醇和超纯水超声清洗,置于空气中干燥、冷却,然后在电极表面滴涂10 μL的多壁碳纳米管-DMF分散液,红外灯烘干后制得多壁碳纳米管修饰电极(MWNTs/GCE).
1.2.2 硫堇修饰的多壁碳纳米管电极(TH/MWNTs/GCE)的制备
将上述制得的MWNTs/GCE浸入到2 mg/mL硫堇溶液中反应20 min,再取出用超纯水清洗30 min,以除去硫堇在电极表面的物理吸附,室温下晾干后制得硫堇修饰碳纳米管电极(TH/MWNTs/GCE),将修饰电极浸泡在B-R的缓冲液中(pH = 5.0)待用.
1.2.3 电化学测定方法
TH/MWNTs/GCE在B-R缓冲溶液(pH = 5.0)中用连续循环伏安扫描法在-0.8 - 0.4 V(vs.Ag/AgCl)范围内扫描,形成稳定的峰电流.磁力搅拌下加入一定量的BSA并反应5 min,然后用循环伏安法(Cyclic Voltammetry, CV)或线性扫描伏安法(Linear Sweep Voltammetry, LSV)测定硫堇的氧化还原峰峰电流的变化.
1.2.4 交流阻抗法(EIS)
在10 mmol/L [Fe(CN)6]3-/4-的溶液(含0.1mmol/L KCl)中记录交流阻抗谱图.正常电位下,频率:10 Hz - 100 kHz,电压振幅:1 mV.
1.2.5 紫外-可见分光光度法
配制5组待测溶液:0.4 mg/mL BSA,0.06 mg/mL硫堇,0.06 mg/mL硫堇 + 0.4 mg/mL BSA混合液、0.06 mg/mL硫堇 + 0.8 mg/mL BSA混合液和0.06 mg/mL硫堇 + 1.2 mg/mL BSA.记录200 - 800 nm波长范围内的紫外-可见分光光谱图.
2 结果和讨论
2.1 BSA在TH/MWNTs/GCE上的电化学行为
图1是当扫描速度为0.1 V·s-1时、不同类型的电极在B-R缓冲液(pH = 5.0)中的循环伏安(CV)曲线.图1中曲线a为裸玻碳电极(GCE)的CV曲线.曲线b为多壁碳纳米管修饰玻碳电极的CV曲线,可以看出背景信号明显增大,这是由于多壁碳纳米管修饰后电极的导电能力增大的结果.当多壁碳纳米管修饰玻碳电极在2.0 mg/mL浓度的硫堇溶液中反应20 min,得到了硫堇修饰的多壁碳纳米管电极(曲线c),可以在-0.08 V和-0.15V观察到一对很明显的硫堇的氧化还原峰,这是因为硫堇分子中的芳香环可以通过π-π共轭作用吸附到多壁碳纳米管上.当溶液中加入0.04 mg/mL BSA后,硫堇的氧化还原峰峰电流明显下降,而峰电位基本保持不变(曲线d),当加入更多量0.08 mg/mL的BSA时,硫堇的氧化还原峰峰电流下降更加明显,这可能是由于BSA和硫堇之间形成了非电活性的化合物的缘故.
2.2 扫描速度的影响
通过循环伏安法对TH/MWNTs/GCE在扫描速度分别为0.025 V·s-1、0.05 V·s-1、0.075 V·s-1、0.1 V·s-1、0.12 V·s-1、0.15 V·s-1、0.2 V·s-1时进行扫描,观察其氧化还原峰电流,如图2(a).实验发现,硫堇的氧化还原峰的峰电流都随着扫速的增加而相应增大,且氧化还原峰的峰电流均与扫速呈线性关系,线性方程分别为ipa(μA) = 13.334 + 508.359V(V·s-1)(R= 0.995)和ipc(μA) =-12.340-502.151V(V·s-1)(R= 0.996),其中R为线性系数.说明,TH/MWNTs/GCE电极表面的氧化和还原反应是都是受吸附控制的.
上述溶液加入0.08 mg/mL的BSA得到的BSA/TH/MWNTs/GCE电极在0.025 - 0.2 V·s-1的扫速范围内扫描,检测硫堇的氧化还原峰的峰电流变化,如图2(b).实验发现,在同等的扫速条件下,氧化还原峰的峰电流均减小,并且氧化还原峰的峰电流与扫速之间呈线性关系,线性方程为ipa(μA) = 4.058 + 269.588V(V·s-1)(R= 0.997)和ipc(μA) = -3.261-201.440V(V·s-1)(R= 0.999).说明BSA/TH/MWNTs/GCE电极表面的氧化和还原反应均是是受表面吸附控制的.实验结果说明,在体系中加入BSA后,游离的硫堇浓度的降低,导致氧化还原峰电流的降低,进一步说明有非电活性物质产生[17].
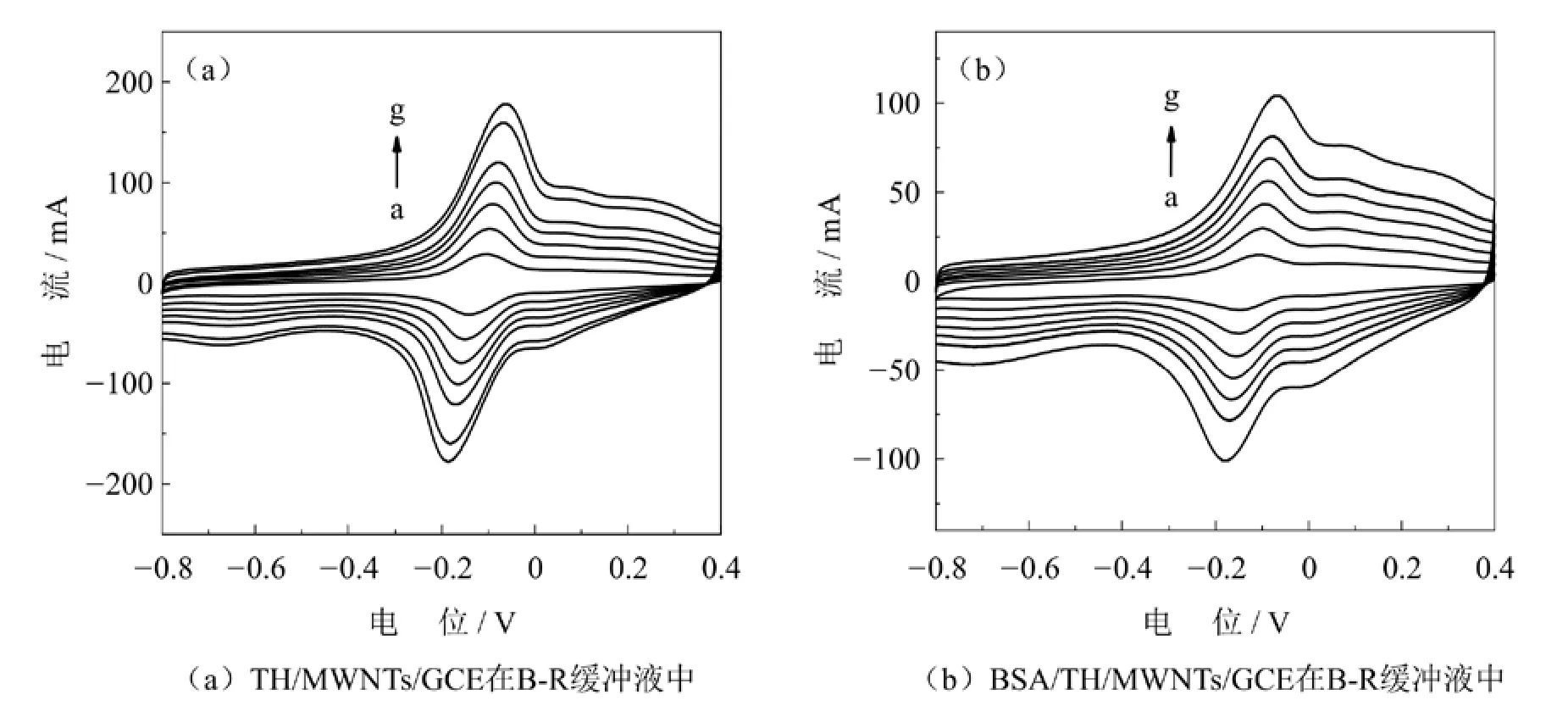
图2 TH/MWNTs/GCE在不同扫速条件下加入BSA前后的循环伏安曲线
2.3 紫外-可见光谱图
通过紫外-可见光谱实验,进一步证明了BSA和硫堇之间的结合作用,如图3所示.BSA在278 nm处有一吸收峰,硫堇有三个吸收峰,分别在:235 nm,282 nm和600 nm.当在硫堇溶液中加入了0.4 mg/mL BSA后,235 nm处的吸收峰消失,282 nm的吸收峰增强,且稍有蓝移,600 nm处的吸收峰下降.当继续加入一定量的BSA(曲线d和e)后,282 nm的吸收峰增强,且稍有蓝移,600 nm处的吸收峰继续呈下降趋势,说明硫堇和BSA发生结合.
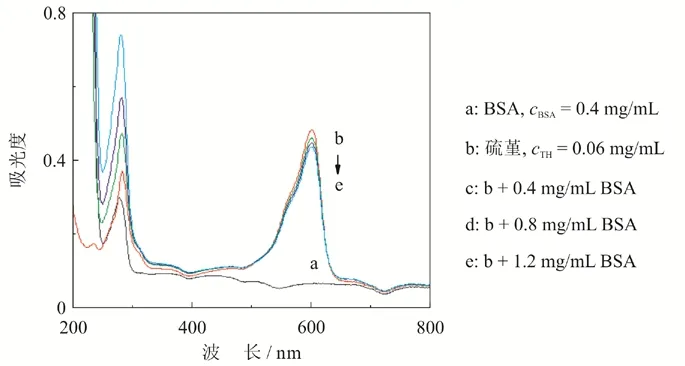
图3 硫堇和BSA作用的紫外分光光度图
2.4 电化学交流阻抗图(EIS)
根据电化学交流阻抗的变化来判断电极表面的状况.我们在电化学工作站上测定不同的电极修饰所得到的电极Nyquist图谱(通过阻抗值的虚部Zim对其实部Zre作图),转移阻抗值(Ret)的数值等同于半圆的直径,对应的Nyquist图谱是通过高频区域的半圆连接到低频区域的直线.根据文献[18]可知,半圆反映电子转移过程的特征,45度直线反映扩散控制特征.实验结果如图4所示.裸玻碳对应曲线(曲线a)在高频区域有较小直径的圆弧(约为30 Ω),这说明裸玻碳电极(GCE)表面的反应是受扩散控制的,裸玻碳电极阻挡Fe(CN)63-/4-的氧化还原反应过程的电子传输较小.作为对比,MWNTs/GCE电极对应的曲线(曲线b)在高频区域的圆弧直径接近于零,说明了碳纳米修饰电极能够非常有效促进电子的转移.将碳纳米管修饰电极浸入一定浓度的硫堇溶液反应后,硫堇可以通过π-π共轭作用键合到修饰电极(MWNTs/GCE)表面,从而抑制了电子间的转移(曲线c,高频区域圆弧直径为160 Ω).在溶液中再加入0.08 mg/mL BSA后(曲线d),BSA/TH/MWNTs/GCE高频区域圆弧直径为240 Ω,由此可见电子转移抑制明显,表面BSA与硫堇相互作用后生成一种非电活性物质,与之前实验得到的结果一致.
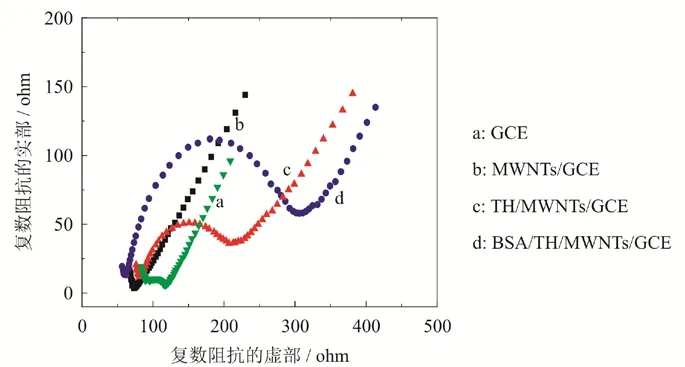
图4 不同电极的交流阻抗图图谱
2.5 实验参数的优化
2.5.1 支持电解质的选择
我们对支持电解质-缓冲溶液进行了选择.试验不同的缓冲溶液对硫堇的氧化还原峰的影响,包括0.2 mol/L的磷酸盐缓冲溶液(pH:4.5 - 7.0);0.2 mol/L的NaAc-HAc缓冲溶液(pH:3.8 -5.4)和B-R缓冲溶液(pH:2.5 - 7.5).实验发现在B-R缓冲溶液中峰电流最大、峰形最好且可逆性最好,因此选择B-R缓冲溶液作为支持电解质.同时也试验了不同的pH值的B-R缓冲溶液对硫堇氧化还原峰的影响(图5).发现随着酸性的增大,峰电位向正电位方向移动,说明有H+参与反应的进行.当pH为5的时候,硫堇的氧化还原峰的峰形好且峰电流较大,选择支持电解质为pH为5的B-R缓冲溶液.
2.5.2 修饰剂用量的选择
实验选择不同量的碳纳米管-DMF修饰剂(2 μL、4 μL、6 μL、8 μL、10 μL、12 μL、14 μL)分别和2.0 mg/mL的硫堇溶液发生反应,观察其氧化还原峰电流的变化(图6).实验发现,当修饰剂的用量达到10 μL时,氧化还原峰已经比较明显且峰形较好,最终选择修饰剂的用量为10 μL.
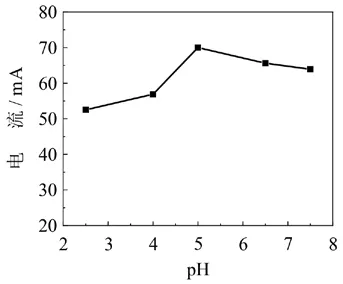
图5 B-R缓冲溶液的pH值对BSA测定的影响
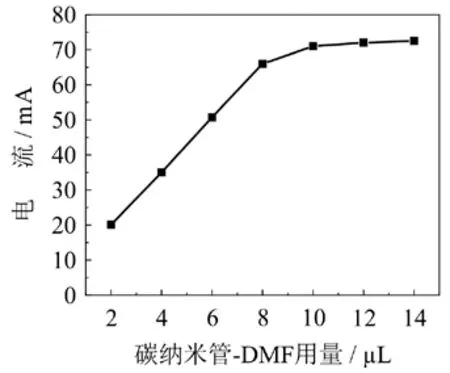
图6 碳纳米管-DMF修饰剂用量的影响
2.5.3 硫堇和碳纳米管修饰电极间的反应时间的选择
实验考察了多壁碳纳米管修饰电极(MWNTs/GCE)和硫堇溶液(2.0 mg/mL)不同的反应时间(分别为5 min、10 min、20 min、30 min、40 min、50 min),比较硫堇的氧化还原峰的峰电流大小(图7).实验发现,在5 - 20 min的范围内,随着反应时间的增加,硫堇的峰电流随之增大.当反应时间大于20 min,硫堇的峰电流增加不明显,说明两者反应已经达到饱和.因此,选定20 min作为硫堇和多壁碳纳米管修饰电极的反应时间.
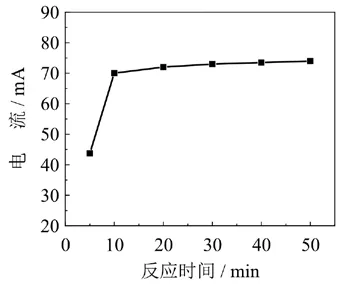
图7 硫堇和碳纳米管修饰电极间的反应时间的影响
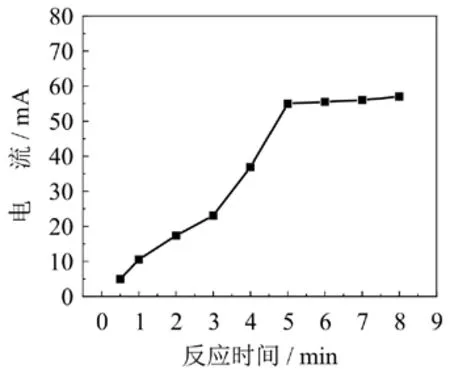
图8 BSA和硫堇修饰碳纳米管电极上硫堇的反应时间的影响
2.5.4 BSA和硫堇修饰碳纳米管电极上硫堇的反应时间的选择
将一定量的BSA(0.06 mg/mL)加到浸有硫堇修饰多壁碳纳米电极的缓冲溶液里,静置.实验了不同的反应时间(分别为0.5 min、1 min、2 min、3 min、4 min、5 min、6 min、7 min和8 min)的影响(图8),实验发现,当反应时间到达及超过5 min后,硫堇的氧化还原峰峰电流基本保持稳定,因此选择5 min作为反应的时间.
2.6 BSA的线性、测定稳定性及重现性
采用LSV分别测定了硫堇修饰多壁碳纳米管电极上的氧化还原峰与BSA的作用,如图9所示.结果发现,随着BSA浓度增加,硫堇氧化还原峰的峰电流相应下降,这是因为BSA浓度的增加,导致更多的非电活性物质产生.硫堇的氧化还原峰的峰电流的下降值和加入的BSA浓度在0.01 - 0.12 mg/mL范围之间呈线性关系,如图9所示.氧化峰的线性方程为Δipa(μA) = 3.401 +336.775cBSA(mg/mL)(R= 0.997),还原峰的线性方程为Δipc(μA) = -4.252 - 415.045cBSA(mg/mL)(R= 0.997),最低检测限达到0.004 mg/mL.
实验对比了该体系对溶菌酶(Lyso)和人血清白蛋白(HSA)的氧化还原响应,以氧化峰为例,得到相应的工作曲线,分别为Δipa(μA) = 5.678 + 405.235cHSA(mg/mL)(HSA的浓度在0.008 -0.08 mg/mL范围内,相关系数R= 0.998),Δipa(μA) = 10.578 + 289.345cLyso(mg/mL)(Lyso的浓度在0.01 - 0.20 mg/mL范围内,相关系数R= 0.995).由于本方法对不同类别的蛋白均有响应,因此可用于测定血清样品中的总蛋白含量.目前荧光光谱法测定蛋白质的含量[4-5,19-20]发展非常迅速,但该方法不仅耗时,还需比较昂贵的样品和仪器设备.极谱分析测定蛋白质[21-22]的灵敏度较高,但缺点是毒性较大.我们设计的电化学方法测定蛋白质具有快速、经济、简便等优点,方法对于一些在短时需要结果的实验是非常有利的.
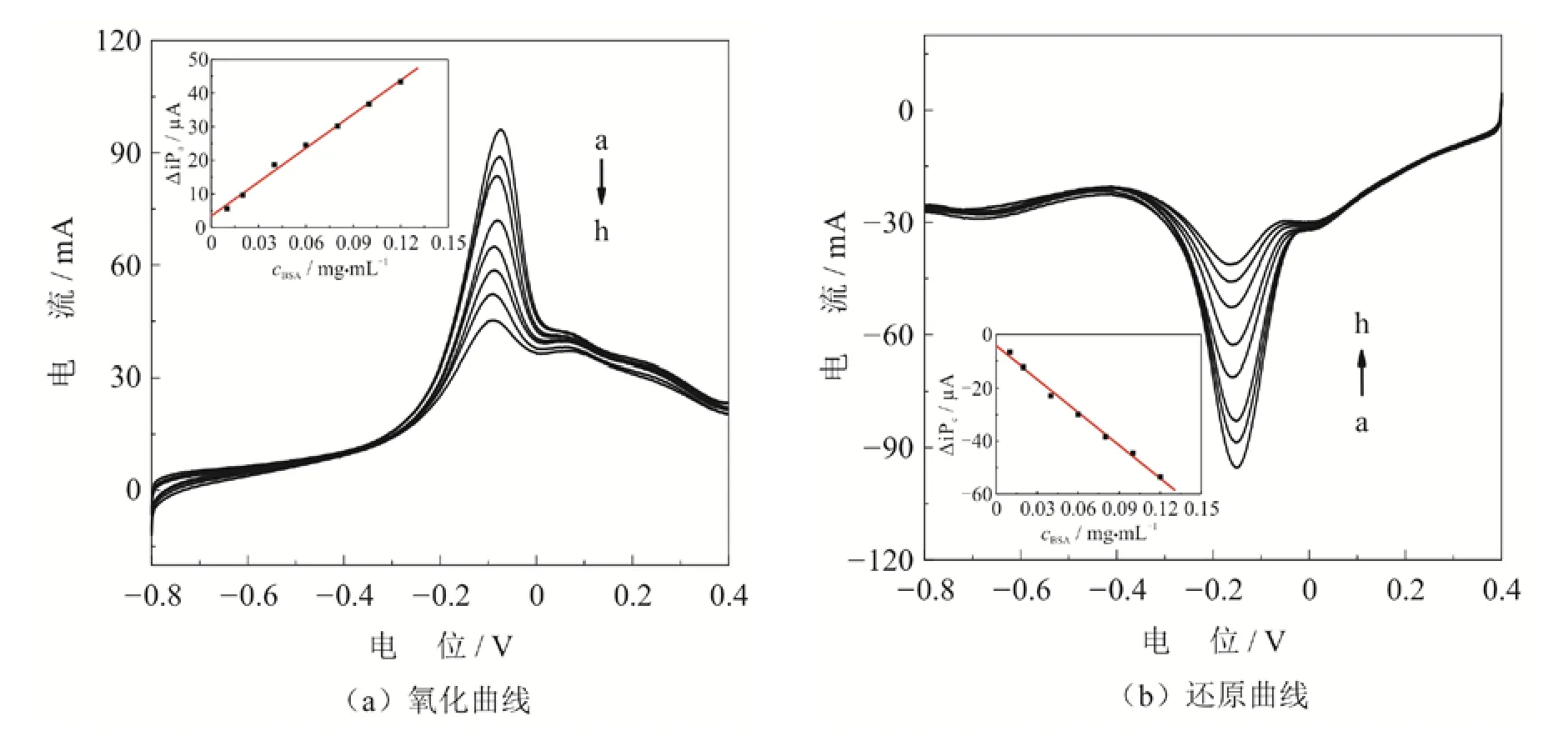
图9 不同浓度BSA和硫堇相互作用的线性扫描伏安曲线
对同一支TH/MWNTs/GCE电极,加入0.08 mg/mL BSA前后进行连续的10次测定,评价本实验的重现性.实验发现,加入BSA前后的相对标准偏差(Relative Standard Deviation, RSD)分别是2.2%和2.4%,显示本实验具有很好的重现性.另外,我们用相同方法修饰10支TH/MWNTs/GCE电极,考察不同修饰电极间的重现性.结果显示,相同方法修饰的10支不同的电极(TH/MWNTs/GCE)的RSD为4.3%,说明制备TH/MWNTs/GCE的方法有实用的价值.
2.7 干扰物质的影响
实验了一些氨基酸(包括L-白氨酸,D/L-酪氨酸,丝氨酸,酪氨酸,L-胱氨酸)和实验室常见的物质(包括苹果酸,葡萄糖、柠檬酸)和一些金属离子(包括K+、Ca2+、Zn2+、Na+)等对测定的影响,结果见表1.
实验表明,当相对误差在10%以内时,低浓度的上述物质对测定结果的影响不大.相同浓度的D/L-酪氨酸、丝氨酸、L-胱氨酸、苹果酸、柠檬酸、Ca2+、Zn2+、Na+、K+不影响测定,相同浓度的L-白氨酸和葡萄糖稍有影响.然而,在实际的样品测定过程中,血清样品常稀释1 000倍以上,因此以上物质在测定溶液中的浓度很小,基本可以不考虑干扰的问题.
2.8 人血清样品中蛋白质的分析
移取0.1 mL人血清样品(4个不同的血清样品,由温州医科大学附属第二医院的检验科提供),用超纯水配置成100 mL溶液,置于容量瓶中,置于4℃冰箱中备用.按照拟定方法测定1.0 mL的样品,并做回收率实验.回收率在97.9% - 103.2%之间,5次测定的RSD在2.0% - 3.0%之间,结果见表2.与经典的考马斯亮蓝法(CBB G2250)[23]结果一致.
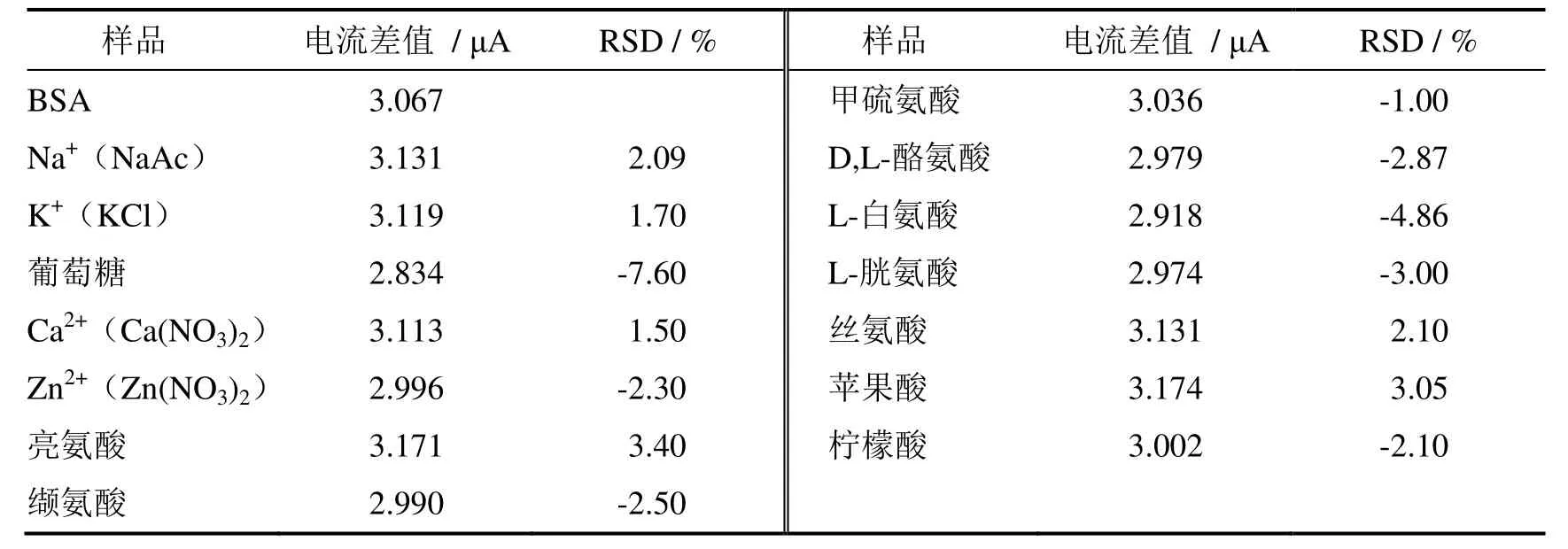
表1 干扰物质的测定结果(n = 3)
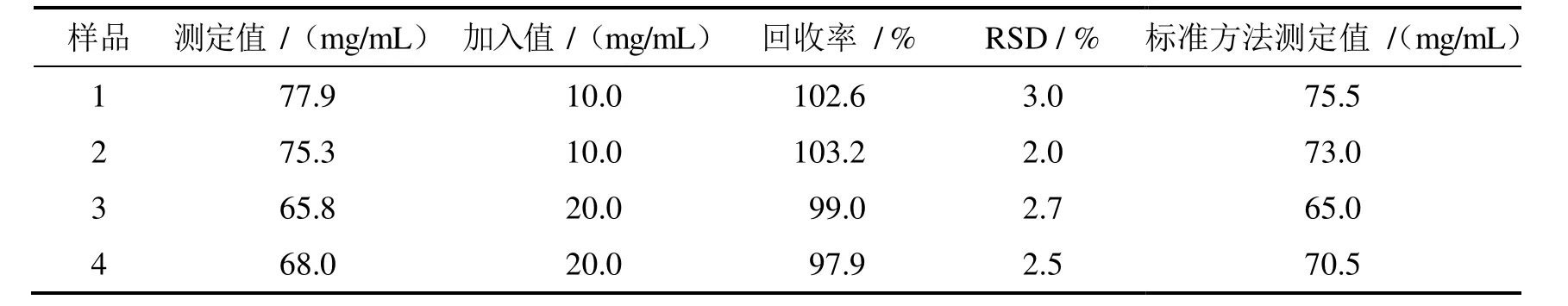
表2 样品的分析结果和回收率实验结果(n = 5)
3 结 论
本文构建了一种基于硫堇修饰多壁碳纳米管电极上硫堇与蛋白质的相互作用的电化学检测蛋白质的方法.运用电化学方法(循环伏安法和线性扫描伏安法)和紫外-可见光谱法来研究硫堇修饰的碳纳米管电极上硫堇与BSA的相互作用,实验表明BSA可以和硫堇修饰碳纳米管电极上的硫堇之间生成了一种非电活性化合物.在实验选定的最佳测量条件下,硫堇的氧化还原峰峰电流的下降值和BSA浓度在一定范围内呈线性关系.方法简单、有效,具有很好的稳定性和重现性,可用于检测人血清样品中蛋白质含量.

