西洛他唑促进小鼠急性脑梗死区域血管内皮增殖相关研究
卢 山 钱 芸 夏文卿 汪 容 唐 波
西洛他唑(cilostazol,CLZ)是一种磷酸二酯酶Ⅲ抑制剂,用于脑梗死后的抗血小板聚集治疗。前期研究报道发现,在小鼠脑梗死急性期给予CLZ 治疗,可改善小鼠脑梗死区域的脑血流量,并促进小鼠大脑由来血管内皮细胞的内皮型一氧化氮合酶的活化[1]。本研究通过测定脑梗死模型小鼠CLZ 治疗后脑梗死区域的血小板-内皮细胞粘附分子(platelet endothelial cell adhesion molecule-1,CD31)阳性标记细胞数量,以及通过测定加入5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)培养的小鼠大脑由来血管内皮细胞BrdU 阳性标记血管内皮细胞数,从而明确CLZ 是否具备促进小鼠血管内皮细胞增生的能力。现将报道如下。
1 实验材料
1.1 动 物 SPF 级8 周龄雄性Icr 小鼠12 只,体质量18.0~23.0(20.0±3.0)g,由浙江中医药大学动物试验中心提供(实验动物合格证号:上海西普尔必凯实验动物有限公司,SCXK(沪)2018-0006),置于浙江中医药大学动物房12h 明暗周期循环,控制室温为(21±2)℃。制备脑梗死模型后1 周内予以粉状饲料饲养。本实验取得浙江中医药大学动物实验伦理委员会批准,动物伦理审批编号:20191216-22。
1.2 细胞株 CRL-2299 系列小鼠大脑由来血管内皮细胞,由美国ATCC 公司提供。
1.3 试 剂 CD31 抗体(批号sc-376764,规格:200μg/mL,公司:Sante Cruz);山羊抗小鼠IgG H&L Alexa Fluor 488(批号ab150113,规格:500μg,公司:ABCAM);Brdu 抗体(批号B2531,规格:100μL,公司:sigma);山羊抗兔IgG H&L(Alexa Fluor 555)(批号ab150078,规格:500μg,公司:ABCAM);4',6-二脒基-2-苯基吲哚(DAPI)(批号28718-90-3,规格:10mg,公司:kirkegaard&Perry)。
1.4 药 物 CLZ(批号190106P,规格:50mg/粒),由浙江大冢制药有限公司提供。
2 实验方法
2.1 药物制备 为保证腹腔注射给药剂量的稳定性,将CLZ 粉碎后用羟乙基-β-环糊精(2-Hydroxypropyl-β-cyclodextrin,HPβCD)制备成性质较稳定浓度为5%的CLZ 悬浊液。
2.2 小鼠脑梗死模型建立 12 只小鼠均使用3%异氟烷诱导全身麻醉及1.5%异氟烷维持麻醉,以右侧卧位固定,暴露左侧颞部,消毒后于左耳外耳道至左眼连线中点处剪开皮肤,钝性分离静脉、唾液腺及肌肉,并电凝阻断手术视野内所见血管。分离相关组织至左侧颧骨颧弓区,剪断颧骨,继续分离肌肉及相关组织至颅底,在嗅索区域使用骨钻去除颅骨,分离已暴露的硬脑膜,充分暴露左侧大脑中动脉,在近嗅索区使用双极电凝器阻断左侧大脑中动脉,并用显微剪剪断已电凝阻断部位的残余血管以确保血管阻断。于手术区域加入动物用抗生素,将之前钝性分离的组织复位,缝合皮肤。术后将小鼠放入恒温箱内观察,待完全脱离麻醉状态后继续相关实验。手术过程中将小鼠体温控制于(37.0±0.2)℃。建模成功后,小鼠左侧大脑即出现局限于大脑皮层的脑梗死病灶。
2.3 分组及给药 将完成建模手术后的小鼠分为CLZ 组和HPβCD 组,每组6 只,分别予以50μL CLZ悬浊液及50μL HPβCD 溶液进行腹腔注射(1 次/日)。注射开始7 天后,使用异氟烷进行深度麻醉并使用4%甲醛对建模小鼠进行循环灌注,然后按16mm 厚度进行大脑冰冻切片制作,并对切片进行CD31 免疫荧光标记,并使用Alexa-conjugated(Alexa Fluor 488 or 555)进行显色标记。使用4,6-二氨基-2-苯基吲哚(4',6-diamino-2-phenylindole,DAPI)进行细胞核标记。制作完成的小鼠大脑切片使用共聚焦镭射显微镜进行观察拍摄,并使用ImageJ 的彩色无序图像外轮廓提取方法对所得到图像进行脑梗死区域及缺血半暗带区域进行CD31 阳性标记细胞密度测定及分析。
2.4 细胞培养 在24 孔培养皿中使用血管内皮培养液培养小鼠大脑由来血管内皮细胞(细胞浓度:1×104cells/well)。培养1 天后,分别换用加入含有4μg 5%浓度CLZ 悬浊液的血管内皮培养液(共500μL)继续培养。对照组使用分别添加4μg 的HPβCD 血管内皮培养液。在培养开始第4 天时,往各组培养皿中加入BrdU(10μg/mL)。于第5 天时固定细胞,并使用BrdU 显色抗体进行显色染色,每个培养皿相同区域于显微镜下观察并统计细胞总数以及BrdU 阳性标记细胞数。
2.5 统计学方法 应用SPSS 23.0 统计软件处理数据,符合正态分布的计量资料以均数±标准差() 表示,比较采用t 检验。P<0.05 为差异有统计学意义。
3 实验结果
3.1 两组小鼠大脑冰冻切片CD31 染色标记图像及图像数据分析 通过使用ImageJ 彩色无序图像外轮廓提取方法,提取出A-D 中CD31 阳性标记(红色标记)区块面积和各切片病理组织区块总面积(简称为总面积)。(见插页图1)CLZ 组CD31 阳性标记区域面积占总面积比例(0.101±0.027)较HPβCD(0.049±0.013)组明显增多,差异均有统计学意义(P 均<0.05)。
3.2 小鼠大脑由来血管内皮细胞增殖数相关分析加入含CLZ(10μg/L)的血管培养液培养的小鼠大脑由来血管周细胞在经过5 天培养后,BrdU 阳性标记细胞数占DAPI 标记细胞核数比值较HPβCD 组高,差异均有统计学意义(P<0.05)。见表1,插页图2。
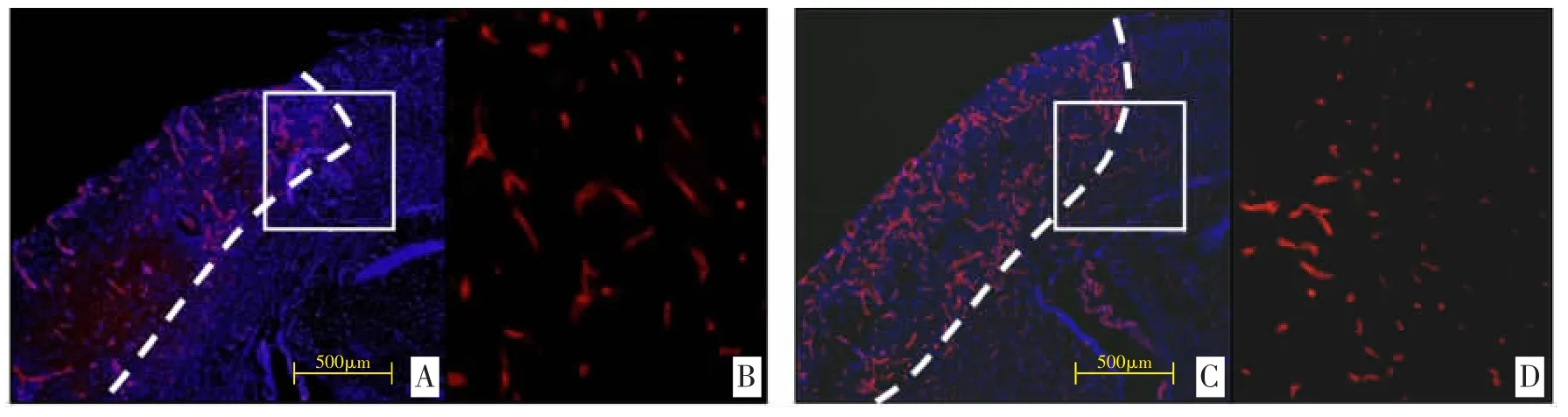
图1 两组小鼠大脑冰冻切片CD31 染色标记图像及相关图像
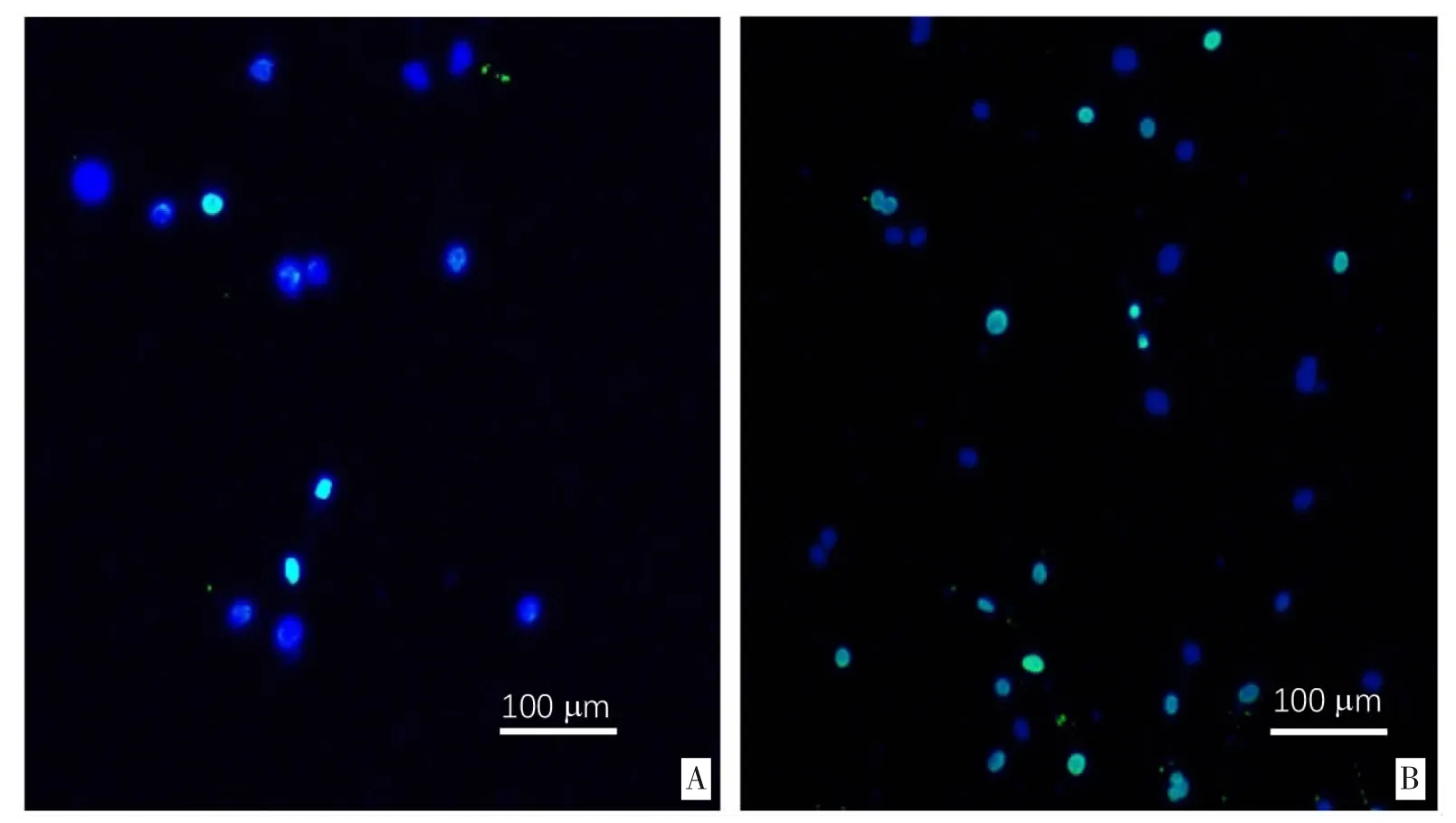
图2 两组小鼠大脑由来血管内皮细胞总数及BrdU 阳性标记细胞数占细胞总数相关分析
表1 CLZ 促进小鼠大脑由来血管周细胞增殖效果影响(个/高倍镜,)

表1 CLZ 促进小鼠大脑由来血管周细胞增殖效果影响(个/高倍镜,)
注:CLZ 组给予以50μLCLZ 悬浊液腹腔注射;HPβCD 组给予50μL HPβCD 溶液腹腔注射;与HPβCD 组比较,aP<0.05
4 讨论
CLZ 已在临床用于脑梗死二级预防[2]。通过已经完成的本项目相关前期研究发现,CLZ 可明显增加小鼠脑梗死急性期脑梗死区域的脑血流量[1],以及CLZ 可促进小鼠大脑由来血管内皮细胞的内皮型一氧化氮合成酶的活性成分生成[3],这与本项目组既往相关研究报道CLZ 可改善机体组织缺血区域血流量[4-5],减少缺血后的组织损伤结论相符[6-7]。
结合本项目前期相关研究结果,通过本项目此次研究发现,经过CLZ 治疗的急性脑梗死建模小鼠梗死区域的CD31 阳性标记细胞所占面积较PBS 及HPβCD 组有明显增多,因此笔者认为CLZ 具备促进小鼠脑急性梗死区域血管内皮细胞增殖的能力。在进一步的离体细胞培养实验中我们发现,使用CLZ(10μ/L)组的BrdU 阳性标记细胞数与DAPI 阳性标记细胞数比值与PBS 组及HPβCD 组亦有明显差异,说明CLZ 可通过促进血管内皮细胞增殖,达到促进小鼠脑梗死后脑梗死区域的新生血管增殖的效果,相关研究结果与已有其他相关报道CLZ 可能通过上调血管紧张素Ⅱ及血管内皮生长因子等途径促血管生成因子的表达进而促进缺血区域血管新生的结论相符[8-10],也可进一步解释为CLZ 有改善血管相关细胞功能的能力[11-12],具备促进微血管新生[13-15]、改善脑缺血区域血流量的作用[16]。
综上所述,CLZ 在脑梗死急性期具备促进血管内皮增殖的能力进而达到促进小鼠脑梗死后脑梗死区域血管新生效果,进而起到改善脑梗死区域脑血流量效果,为脑梗死后缺血区域受损组织修复提供必要条件。

