Cd2+胁迫下对单环刺螠行为响应及淀粉酶活性的研究
王书扬 王玥琛 杜兴林 牟晋华 吕冬伟
摘要:采用静水试验法,在水温(10±2) ℃的条件下,用去离子水配制的Cd2+溶液(0、0.2、0.5、0.8、1.1 mg/L)对单环刺螠(Urechis unicinctus)成体进行48 h急性毒性试验。结果表明,单环刺螠体腔液中淀粉酶的活性与单环刺螠生活水体中Cd2+的浓度呈简单的负相关,且随暴露水体中Cd2+浓度的不断增大,单环刺螠成体表现出不同程度应激性变化。
关键词:镉;单环刺螠(Urechis unicinctus);急性毒性;淀粉酶;指示生物
中图分类号:S94 文献标识码:A
文章编号:0439-8114(2020)18-0063-04
DOI:10.14088/j.cnki.issn0439-8114.2020.18.012 开放科学(资源服务)标识码(OSID):
Study on the response of Urechis unicinctus and amylase activity under Cd2+ stress
WANG Shu-yang, WANG Yue-chen, DU Xing-lin, MU Jin-hua, LYU Dong-wei
(China Agricultural University(Yantai), Yantai 264670,Shandong,China)
Abstract: Used hydrostatic test, cadmium ions solution (0, 0.2, 0.5, 0.8, 1.1 mg/L) prepared with deionized water at a water temperature of (10 ± 2) ℃ was used for 48 h acute toxicity test to Urechis unicinctus. The results showed that the activity of amylase in the body cavity of Urechis unicinctus was simply negatively correlated with the concentration of Cd2+ in the living water body of Urechis unicinctus, and with the increasing concentration of Cd2+ in the exposed water, Urechis unicinctus showed varying degrees of stress change.
Key words: cadmium; Urechis unicinctus; acute toxicity; amylase; biological indicator
影响海水增养殖区环境质量状况的主要因素是部分增养殖区水体呈富营养化状态以及沉积物中粪大肠菌群、铜和镉等重金属含量超标,这种状况主要是由于外源输入污染造成的。而在外源输入污染中,海洋重金属污染是近年来人们关注的热点问题[1]。重金属是具有潜在危害的污染物,它不能被微生物分解,相反生物体可以富集重金属,并将其转化为毒性更强的物质[2]。崔毅等[3]研究了胶州湾海洋生物体中重金属含量,表明以沉积物为主要饵料的底栖生物体内重金属含量比鱼类高,其中镉具有较强的富集能力。淀粉酶是由消化腺和消化系统分泌的一种水解酶,淀粉酶能将淀粉类食物分解成可吸收的小分子物质,为机体提供所需的营养和能量,淀粉酶的活性变化能及时反映出生物体对消化生理调节和环境适应的响应。现有的研究已经证实有多种因素能对淀粉酶活性产生影响[4-9],重金属离子含量便是影响淀粉酶活性的主要因素之一[10-12]。单环刺螠(Urechis unicinctus)俗名海肠、海肠子,属于螠虫动物门(Echiurioidea)螠纲(Echiurida)无管螠目(Xenopneusta)刺螠科(Urchidae)刺螠属。单环刺螠和其他刺螠属的生物一样,是生活在海边潮间带泥性底质或珊瑚礁区中的管状螠虫动物,主要分布在黄海、渤海沿岸的威海、烟台等地,其洞穴为U形穴,曾被当作沿海硫化物代谢相关研究的模式生物。本试验以重金属Cd2+为应急因子,采用急性毒性试验、酶活性检测和观察其行为响应的方法,确定Cd2+对单环刺螠的影响,为深入研究重金属Cd2+对单环刺螠的致毒机理以及螠虫动物环境毒理学提供基础。
1 材料与方法
1.1 材料
试验所用单环刺螠均来自烟台北翠海鲜市场,选择活力良好、体表无伤痕、体态均一的單环刺螠成体,体长(10±1) cm;体质量(60±5) g,将单环刺螠成体放于7个(25.42±0.05) L泡沫保温箱中,每箱5只,加沙加水并24 h不间断供氧,暂养7 d,每天投饵1次,暂养期间每隔2 d换水1次。试验用沙取自渤海湾海滩,海水为实验室自制,通过海水晶配比,盐度为30.5;药品为CdCl2·2.5H2O,分析纯固体,用去离子水配制成不同浓度梯度的暴露液。
1.2 方法
根据王晶[13]对沙蚕污染物暴露浓度的设定,将暴露的最高浓度控制在单环刺螠半致死浓度以下。唐永政等[14]研究发现,单环刺螠幼螠在Cd2+溶液中48 h的急性毒性试验的半致死浓度为1.789 mg/L,Cd2+对其无害的浓度为 0.179 mg/L,又因单环刺螠成体对水中重金属污染抗性更强,所以推断Cd2+的总浓度应控制在0.179~1.779 mg/L;已有研究表明,渤海湾重金属污染海水中Cd2+的平均浓度为0.5 mg/L左右[15-18]。
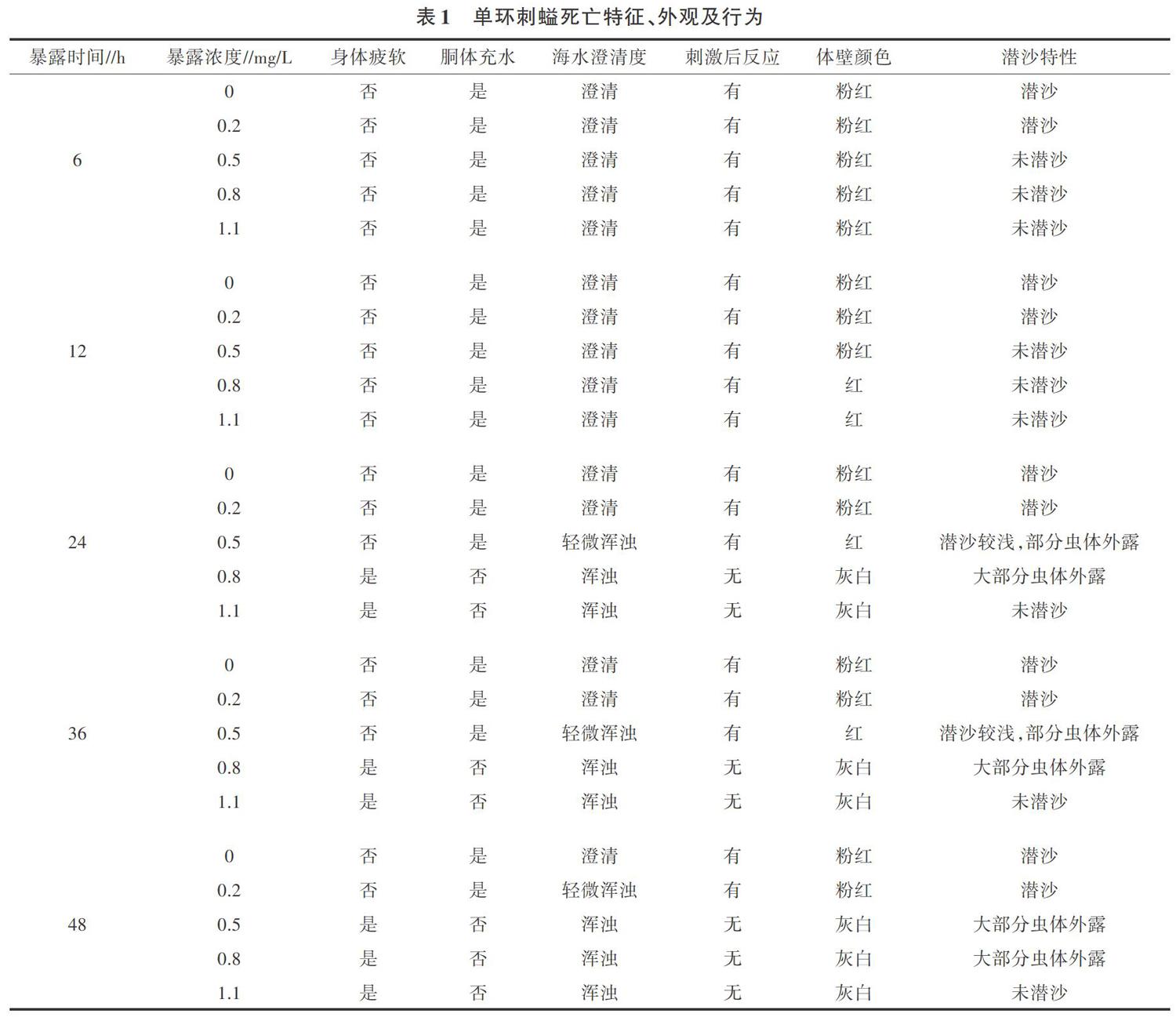
以重金属污染海区的平均浓度为基准,设置0、0.2、0.5、0.8、1.1 mg/L 5个梯度;同时设置空白对照(CK),CK为过滤后的渤海湾纯净海水,每个梯度放入5只经实验室暂养的成螠,试验周期为48 h。试验期间微充氧,不投饵,分别于6、12、24、36、48 h观察单环刺螠的体态变化和应激反应。
在暴露48 h之后,迅速将各组成体取出,放置到不同的大锥形瓶中,等待约10 min,待其将体内所吸海水排出,将其取出,开始解剖并放出体腔液(此为单环刺螠血液和其他体液的混合物)。从单环刺螠背侧肛门端开始,用解剖剪慢慢地向吻端呈直线剪去,当第一滴体腔液从开口开始流出时,用洁净的小型注射器缓慢地吸取,直到体腔液不再流出。迅速将所得体腔液移入小型离心管中,待其他各组的体腔液都移入离心管后,3 500 r/min离心5 min,取上清液待用。
将上清液按照淀粉酶测试盒(南京建成生物工程研究所制)说明书进行操作,在660 nm处用紫外分光光度计测量各处理的OD并记录;取不同单环刺螠个体的体腔液进行3次平行试验,并计算平均值和不确定度。
2 结果与分析
2.1 单环刺螠生理变化
由表1可知,暴露6 h 5个浓度梯度处理的单环刺螠体表身体未见疲软,胴体有充水现象,海水澄清;暴露12 h,在暴露浓度为0.8、1.1 mg/L的处理中,其应激性明显下降,个体经多次刺激后才有反应,身体未见疲软,胴体充水;暴露24 h,在暴露浓度为0.8、1.1 mg/L的处理中,单环刺螠已经全部死亡,身体疲软,胴体不充水,其余组内单环刺螠经多次刺激后才有反应;暴露48 h,暴露浓度为0.5 mg/L的处理中,个体全部死亡,身体疲软,胴体不充水。
暴露6 h,单环刺螠体表普遍为粉红色,0.5、0.8、1.1 mg/L的处理均无法进行正常潜沙;暴露12 h,0.8、1.1 mg/L处理下单环刺螠体壁有类似白色凝霜物质出现,体壁颜色变灰白,其余组无此现象;暴露24 h,0.8、1.1 mg/L处理中单环刺螠已经全部死亡,体壁发白,0.5 mg/L处理下单环刺螠体壁变红,部分虫体从沙中露出;暴露48 h,0.5 mg/L处理下单环刺螠个体体壁变灰白,从沙中钻出,大部分虫体外露。
2.2 单环刺螠体内淀粉酶活性变化
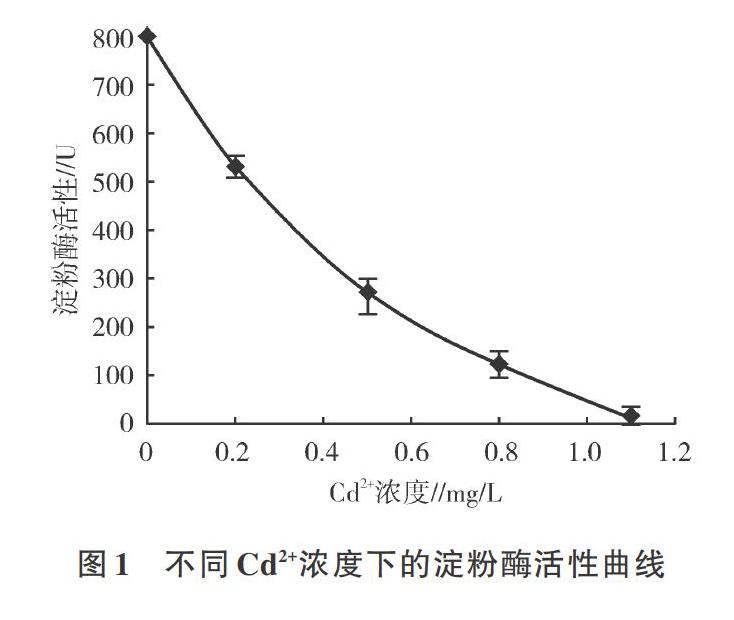
用Excel 2010得到误差棒曲线,通过SPSS 18.0,利用LSD法对不同暴露浓度下淀粉酶的活力进行多重比较,得LSD0.05=0.003 6,LSD0.01=0.005 1;因此,不同Cd2+浓度下所测淀粉酶活力之间差异极显著,可以使用。
当环境中Cd2+浓度为0.2 mg/L时,单环刺螠体腔液中淀粉酶活性为530.6 U;当环境中Cd2+浓度为0.5 mg/L时,其淀粉酶活性为268.9 U;当环境中Cd2+浓度为0.8 mg/L时,其淀粉酶活性为121.9 U;当环境中Cd2+浓度为1.1 mg/L时,其淀粉酶活性为10.6 U。
3 小结与讨论
结果表明,当单环刺螠生活环境中的Cd2+浓度上升时,单环刺螠体腔液中的淀粉酶活性表现为抑制,生理活动受到胁迫。与其他近海底栖生物进行对比发现,此结果与Lai等[11]探究的在 Cd2+胁迫下红树蚬淀粉酶基本表现为抑制作用的研究结果基本一致,但与陈肖肖等[19]研究的低浓度Cd2+对泥蚶淀粉酶活性有诱导作用、高浓度Cd2+有抑制作用的结论不完全一致。陈肖肖等[19]将重金属 Cd2+浓度设定为0.005~0.050 mg/L,是在较低浓度条件下 Cd2+对底栖滤食型动物淀粉酶影响的研究,其最高浓度(0.050 mg/L)较本试验的最低浓度(0.2 mg/L)还低,二者的 Cd2+ 浓度范围不在同一个区间,所以二者的结果可比性较低。
除淀粉酶外,短时间低浓度重金属离子胁迫下,单环刺螠可以通过提高超氧物歧化酶(Superoxidative dismuse,SOD)、過氧化氢酶(Catalase,CAT)等抗氧化酶的活性来适应胁迫;但高浓度长时间胁迫下,抗氧化酶活性下降,活性氧自由基积累,导致机体受到伤害[20]。已有研究表明,淀粉酶是Ca2+的依赖性酶,低浓度Cd2+对酶活性有激活作用,推测高浓度Cd2+可能通过占据Ca2+的结合位点,且与结合位点外的氨基酸残基结合使酶的构象改变,从而抑制酶的活性[21]。
根据研究中单环刺螠所表现出来的特性,可以提出将其作为海水中金属镉指示生物的设想。指示生物又叫生物指示物(Biological indicator),是指在一定地区范围内,能通过特性、数量、种类或群落等变化,指示环境或某一环境因子特征的生物[22]。在近海水域污染监测中,经常通过测定指示生物体内重金属浓度评价水域污染水平。常用的环境指示生物的选择,是利用生物体从周围环境中积累重金属,并且其体内重金属浓度与环境重金属浓度间有一定的相关关系。如马藏允等[23]研究的重金属镉的指示生物紫贻贝、魁蚶、褶牡蛎都是利用了上述特性。本研究结果表明,单环刺螠体腔液中的淀粉酶活性与环境中镉离子浓度呈负相关。可利用单环刺螠这一性质,通过测定某一海域成体体内淀粉酶活性来衡量海水中金属镉的含量,作为一种金属镉的环境指示生物。通过碘液指示单环刺螠体腔中淀粉酶与淀粉混合液的颜色,以混合液分光光度作为一种指标,可以更加直观、简便地衡量海水中金属镉的含量。
单环刺螠体腔液中的淀粉酶活性与其生存环境中Cd2+浓度呈简单的负相关,当单环刺螠生活环境中的Cd2+浓度上升时,单环刺螠体腔液中的淀粉酶活性表现为抑制,个体生命活动受到胁迫;同时,单环刺螠在Cd2+中毒时还会出现身体疲软、胴体充水、体表黏膜脱落、体壁变暗等生理现象。
参考文献:
[1] 杨金龙,吴晓郁,石国峰,等.海洋牧场技术的研究现状和发展趋势[J].中国渔业经济,2004(5):48-50.
[2] 贾晓平,蔡文贵,林 钦.我国沿海水域的主要污染问题及其对海水增养殖的影响[J].中国水产科學,1997,4(4):78-82.
[3] 崔 毅,陈碧鹃,宋云利.胶州湾海洋动物体中重金属含量及评价[J].海洋环境科学,1996(4):17-22.
[4] FAN D P,PAN L Q,XIAO G Q,et al. The effect of pH and temperature on digestive enzyme activity in Sinonoracula constricta[J].Transactions of oceanology and limnology,2003(4):69-73.
[5] SUPANNAPONG P,PIMSALEE T,A-KOMOL T,et al. Digestive enzymes and in-vitro digestibility of different species of phytoplankton for culture of the freshwater pearl mussel, Hyriopsis(Hyriopsis)bialatus[J].Aquaculture international,2008,16(5):437-453.
[6] HASSETT R P,LANDRY M R. Seasonal changes in feeding rate, digestive enzyme activity, and assimilation efficiency of Calanus pacificus[J].Limnology & oceanography,1990,62(3):203-210.
[7] 李俊辉,王庆恒,杜晓东,等.温度和 pH 对马氏珠母贝 肝胰脏消化酶活力的影响[J].水产科学,2011,30(2):115-117.
[8] COEN W M D,JANSSEN C R. The use of biomarkers in Daphnia magna toxicity testing II. Digestive enzyme activity in Daphnia magna exposed to sublethal concentrations of cadmium, chromium and mercury[J].Chemosphere,1997,35(5):1053-1067.
[9] 吴众望,潘鲁青,董双林.9种金属离子对缢蛏消化酶活力的影响[J].中国水产科学,2003,10(4):297-300.
[10] 辛碧芬,谢进金,庄巧阳.几种金属离子对鲢肝胰脏淀粉酶的影响[J].水生态学杂志,2009,2(3):91-95.
[11] LAI T H,HE B Y,FAN H Q,et al. Effects of cadmium stress on the activities of antioxidant enzymes,digestive enzymes and the membrane lipid peroxidation of themangrove mud clam Geloina coaxans(Gmelin)[J].Acta ecologica sinica,2011,31(11):3044-3053.
[12] CHEN Z,MAYER L M,WESTON D P,et al. Inhibition of digestive enzyme activities by copper in the guts of various marine benthic invertebrates[J].Environmental toxicology and chemistry,2002,21(6):1243-1248.
[13] 王 晶.沙蚕暴露于镉、铜和石油烃单一与复合污染的生态毒理学研究[D].哈尔滨:东北农业大学,2007.
[14] 唐永政,宋祥利,翟传阳,等.3种重金属离子对单环刺螠幼螠的急性毒性研究[J].烟台大学学报(自然科学与工程版),2017,30(1):31-35.
[15] 张晓举,赵 升,冯春晖.渤海湾南部海域生物体内的重金属含量与富集因素[J].大连海洋大学学报,2014,29(3):267-271.
[16] 王惠艳,陈 亮,胡树起.渤海湾西部海域表层沉积物重金属含量分布与评价[J].物探与化探,2016,40(3):609-613.
[17] 孙钦帮,王 阳,张 冲,等.渤海湾西南部近岸海域表层沉积物重金属的含量分布与污染评价[J].人民珠江, 2016,37(10):89-93.
[18] 陈 岩.渤海湾潮间带表层沉积物中重金属含量的空间分异[D].北京:中国科学院地理科学与资源研究所,2007.
[19] 陈肖肖,高业田,吴洪喜,等.重金属Cd2+和Cu2+胁迫下泥蚶消化酶活性的变化[J].生态学报,2013,33(24):7690-7698.
[20] 李金龙,秦贞奎,史晓丽,等.铜离子对单环刺螠的毒性及对体壁抗氧化酶活性的影响[J].海洋湖沼通报,2012(2):77-82.
[21] 洪法水,王雪峰,吴 康,等.重金属离子对猪胰α-淀粉酶活性影响的作用机理研究[J].高等学校化学学报,2001,12(22):1979-1983.
[22] MARKERT B,WAPPELHORST O,WECKERT V,et al. The use of bio-indicators for monitoring the heavy metal status of the environment[J].Journal of radioanalytical & nuclear chemistry,1999,240(2):425-429.
[23] 马藏允,刘 海,姚 波,等.几种大型底栖生物对Cd,Zn,Cu的积累实验研究[J].中国环境科学,1997,17(2):151-155.

