大豆GmAGL8基因功能在拟南芥中的初步鉴定
刘媛媛,陆婉瑶,刘 双,秦雅菲,杨翊晖,丁 晨,郭 蓓,2**
(1.北京农学院 a.植物科学技术学院,b.北京农学院生物与资源环境学院;2.中华人民共和国农业农村部华北都市农业重点实验室,北京 102206)
大豆的豆荚是荚果的一种,大豆的成熟期,豆荚的背缝线与腹缝线开裂从而种子从豆荚散出的现象称为炸荚(Pod-shattering)[1-2]。大豆的农业生产中,豆荚的炸裂会对产量造成严重的影响。易炸荚品种与中度炸荚的品种造成的减产可以达到57~175 和0~186 kg/hm2[3]。炸荚在其他油料作物和豆科作物中也有发现[4]。
植物MADS-box基因家族在植物生长发育过程中起着非常重要的作用[5],控制许多发育过程,包括根、花还有果实的发育[6]。拟南芥中的FRUITFULL(FUL)基因属于MADS-box基因家族,研究表明该基因起到调控拟南芥开花时间、花分生组织的分化、茎生叶的发育以及心皮与果实的发育的作用。徐勇等研究了桃树(Prunuspersica)中与拟南芥FUL同源的基因PpMADS6,过表达PpMADS6的拟南芥植株出现了花期提前,单花器官增多,成熟期的角果不易开裂等一系列性状[7]。AGL8基因也被称作AGAMOUS-like8,FRUITFULL,FUL等,前人的研究发现,AGL8基因对心皮的发育和分裂组织的分化起到调控作用[8-9]。中华人民共和国农业农村部华北都市农业重点实验室李冉阳[10]通过同源扩增从大豆中克隆得到与拟南芥FUL基因相似的GmAGL8基因,同时对GmAGL8进行了生物信息学分析,比对了GmAGL8与桃PpMADS6和拟南芥FUL的核酸序列,相似度分别为 80% 和 77% ,三者的氨基酸序列同源性为74%。在GmAGL8中发现与MADS基因家族相似的MEF2,并找到可能与多聚体的形成有关的K-box基因。为了进一步验证GmAGL8的功能,本试验将构建的过表达GmAGL8的载体(pCAMBIA1300∷GmAGL8)和反义抑制表达GmAGL8的载体(pCAMBIA1300∷antiGmAGL8)转入拟南芥中,观察转基因后代的表型变化,以验证大豆GmAGL8基因的功能。
1 材料与方法
1.1 试验材料
植物材料:拟南芥(Columbia),拟南芥agl8突变体(购自英国诺丁汉大学);表达载体:中华人民共和国农业农村部华北都市农业重点实验室构建的GmAGL8过表达载体pCAMBIA1300∷GmAGL8,GmAGL8反义抑制表达载体pCAMBIA1300∷antiGmAGL8;供试农杆菌:LBA4404;抗生素:卡那霉素;购自北京擎科生物科技有限公司的T5 Direct PCR Kit(Plant)及遗传转化相关基础试剂。
1.2 试验方法
1.2.1 拟南芥的室内培养 将拟南芥种子置于4 ℃冰箱低温春化48 h后播种,萌发两周后移栽,培养土为泥炭土∶蛭石∶珍珠岩3∶3∶1的混合土。培养室内温度设置为26 ℃,每天16 h光照/8 h黑暗,光强1 500 lx,空气相对湿度55%~65%。拟南芥喜湿,在培养过程中要注意保持空气相对湿度,同时防止土壤染菌。
1.2.2 拟南芥的遗传转化(花浸法) 将含有阳性转化子的农杆菌菌液扩大培养,收集菌体。配置1/2MS液体培养基100 mL,加入20 μL的silwetL-77,重悬菌体使OD600重新达到1.0左右,此重悬液即为侵染液。拟南芥种植大约6周后去其初生花序,初次侵染需将已开的花全部剪掉。将拟南芥的花序部分浸入侵染液1 min,期间晃动,避光培养24 h后恢复原培养条件。在初次转化后可根据植株状态进行重复侵染,侵染3次后可等待果荚成熟收获种子[11-12]。
1.2.3 种子的抗生素筛选 用70%乙醇、2%的次氯酸钠(每50 mL加15 μL吐温)依次对种子消毒。消毒后的种子与0.1%的琼脂糖混合,播种于1/2MS固体培养基(含Kan=50 mg/L)进行转基因植株的抗性筛选。1周左右即可初步筛选转基因植株。
1.2.4 转基因植株的PCR鉴定 一种方法为传统的CTAB法提取DNA,进行PCR检测;另一种方法无需提取DNA,利用T5 Direct PCR Kit(Plant)直接用植物组织进行PCR扩增。在植物的嫩叶或幼茎上,用直径1.5 mm打孔器取样后直接放入PCR反应体系(2×T5 Direct PCR Mix 12.5 μL,EYFP F/R引物各1 μL,dd H2O 10.5 μL至总体积25 μL)中进行扩增,反应程序为98 ℃预变性3 min; 98 ℃, 10 s/58 ℃, 10 s/72 ℃, 20 s,34个循环; 72 ℃延伸4 min。使用的引物:GmAGL8-F 5’GGGGTACCATGGGGAGAGGAAGGGTGCAGT TG 3’;GmAGL8-R 5’CGGAATTCTTCATTTGTAGGACGAAGCATCCAAGG 3’;EYFP-F 5’ CTGAGCAAGGGCGAGGAGCTGTTCACCGGG GTG3’;EYFP-R 5’ TTACTTGTACAGCTCGT CCATGCCGAGAGTGATC 3’。
1.2.5 转基因植株的表型观察 在相同培养条件下,观察过表达和反义抑制GmAGL8的转基因植株与拟南芥野生型及agl8突变体在生长发育、开花时间、荚的形态、荚开裂等表型特征上的变化。

2 结果与分析
2.1 转基因植株的PCR鉴定结果
2.1.1 过表达GmAGL8拟南芥的PCR鉴定结果 经过抗卡那霉素筛选,获得21棵抗性植株,采用传统的CTAB法提取叶片DNA后,利用载体上带有的EYFP基因片段设计引物以构建好的pCAMBIA1300∷GmAGL8质粒为阳性对照,ddH2O为阴性对照进行PCR验证,结果见图1。
由电泳图可见,在测定的21株中,有13株扩增出了720 bp的目标条带,而野生型中没有目标条带出现。初步确定1、4、6、11、13~21号为阳性植株,回收种子,继续培养T1代。
2.2.2 anti-GmAGL8转基因拟南芥PCR鉴定结果 同样通过抗生素筛选获得转化anti-GmAGL8的拟南芥30株。除了采用传统方法检测外,尝试直接用叶片采用T5 Direct PCR Kit(Plant)进行直扩法PCR验证,结果见图2,可以看出有2株扩增出清晰可见的750 bp目标条带。继续培养阳性株获得T1代植株。比较图1与图2的扩增结果显示看出,与传统的CTAB法提取DNA后进行PCR相比,直扩PCR的方法更加简便,且条带清晰,只需小面积叶片,特别适合于材料稀少的样品。

WT.野生型;+.阳性对照;-.阴性对照
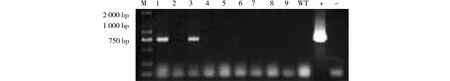
WT.野生型;+.阳性对照;-.阴性对照
2.3 拟南芥的表型观察结果
将过表达AGL8转基因植株T1代(12株),anti-GmAGL8转基因植株T1代(10株),野生型植株(10株),agl8突变体植株(5株),在相同条件下进行培育,仔细观察不同生育时期,不同类型的植株表型上的差异。
2.3.1 叶片形态 如图3显示,在叶片形态方面,过表达GmAGL8植株(图3-A)叶片相对较厚,呈圆形;野生型植株(图 3-B)及anti-GmAGL8植株(图3-C)叶片均较薄,但野生型叶柄长,叶片呈水滴形,而anti-GmAGL8植株叶柄较短叶片偏长,呈长圆形。agl8突变体植株(图3-D)长势很弱,叶片发黄且植株矮小。

A.GmAGL8过表达植株;B.野生型;C.anti-GmAGL8植株;D.agl8突变体
2.3.2 角果形态 在角果形态方面(图4),与野生型(图4-C)相比,anti-GmAGL8植株(图4-A)角果短,长度在0.5 cm左右;agl8突变体植株(图4-B)角果短小且瘦弱,多为畸形和败育果荚;过表达GmAGL8植株(图4-D)角果较长,与野生型相近,平均在1.20 cm,并且过表达植株果荚比同时期其他类型植株的果荚成熟更早。

A.anti-GmAGL8植株; B.agl8突变体; C.野生型;D.过表达GmAGL8植株
2.3.3 角果开裂情况 通过观察发现,野生型拟南芥角果(图5-A、5-B、5-C)在变黄成熟后一周正常开裂;而anti-GmAGL8转基因拟南芥在角果成熟时果荚会完全炸开;过表达GmAGL8(图5-D、5-E)转基因拟南芥在角果成熟后两周少有开裂;agl8突变体植株(图5-F)虽然偶能结荚,但由于败育和发育不全而干瘪,几乎得不到成熟的种子。通过随机碰撞试验计算得到过表达植株抗裂角指数平均为0.44,anti-GmAGL8转基因植株抗裂角指数平均为0.35,野生型抗裂角指数为平均0.38。通过IBM SPSS Statistics19进行数据分析,结果表明不同类型植株抗裂角指数差异显著。
另外还发现,在开花时间方面,过表达GmAGL8植株出现早花现象,在发芽第20天左右开始开花;野生型植株一般在发芽第32天左右开花,而anti-GmAGL8与agl8突变体植株开花较迟,平均在发芽后40 d左右开花。
3 讨论与结论
FUL基因作为受上游基因调控的基因,对控制拟南芥开花、叶片形态、果实发育起到调控作用。研究表明,FUL在莲座叶、茎生叶维管束中表达,使叶片细胞排列紧密,拟南芥FUL基因的突变体会产生植株叶片变宽和叶肉细胞分布松散的现象,过表达IiFUL基因会使拟南芥出现茎生叶片的表型[11-13]。在本试验中过表达和抑制表达GmAGL8的植株叶片与野生型相比在厚度和形状上也产生了一些变化,说明GmAGL8基因在某种程度上参与了叶片的发育过程。Mciller 曾研究发现,DEFH28是金鱼草中FUL的直系同源基因,影响了转基因拟南芥的花序分生组织的诱导和后期的花分生组织的形成[14]。对比本试验中GmAGL8的过表达、抑制表达、及突变体和野生型拟南芥植株的开花时间,发现过表达GmAGL8植株出现早花现象,果荚成熟早,anti-GmAGL8与agl8突变体植株开花较迟,这说明GmAGL8的表达在一定程度上可以促进拟南芥开花转变过程。Gu等[11]发现拟南芥ful突变体植株果荚短小,与本试验anti-GmAGL8、agl8突变体植株果荚短小的现象相一致。 另外,过表达GmAGL8转基因拟南芥在角果成熟时少有开裂,而anti-GmAGL8由于果荚变短种子数量不变,使得荚果随着成熟期到来过早开裂。

A、B、C.野生型;D、E.过表达GmAGL8植株;F.agl8突变体
目前,有关大豆炸荚基因的报道相对较少,Funatsuki等利用炸荚栽培性状差距大的两个大豆品种图位克隆了抗炸荚基因pdh1,董阳等也以抗炸荚品种黑农44和炸荚的野生大豆ZYD00755为材料克隆了抗炸荚基因SHAT1-5,前者在大豆的炸荚过程中降低荚皮扭曲力起到负调控作用,后者提高腹缝线次生细胞壁厚度起到正调控作用[15-16]。过表达GmAGL8基因的拟南芥角果不易炸裂,暗示该基因在控制植物果荚开裂中起到负调控作用。
GmAGL8基因作为FUL基因的同源基因,结合其他物种与FUL同源的基因在拟南芥中的研究,初步认为GmAGL8基因在拟南芥中行使着与FUL基因类似的功能,对拟南芥叶片发育、开花时间以及果荚长短与开裂均有影响,一定程度上促进开花及果荚成熟,提高果荚抗裂性。已有学者进行了油菜过表达FUL及其同源基因的研究,来控制油菜角果的开裂[17]。探寻GmAGL8基因对大豆果荚开裂的影响,研究该基因与同样作为控制大豆炸荚的pdh1、SHAT1-5基因作用模式的差异,对大豆品种的改良,提高大豆收获效率与经济收益具有重要意义。

