赤霉素和生长素浸种对多叶棘豆种子萌发的影响
贾 鑫,王素巍,张 英,岳 鑫,于 娟,王晓琴
(内蒙古医科大学药学院,呼和浩特 010110)
多叶棘豆(Oxytropismyriophylla(Pall.)DC.)为豆科棘豆属多年生草本植物,为《内蒙古蒙药材标准》中规定的蒙药“达克沙”的正品,是蒙医常用药,具有杀黏、清热、燥希日乌素、愈伤、生肌、锁脉、止血、消肿、通便之功效[1]。该植物在内蒙古地区广泛分布,近年来由于人们的过渡采挖,野生资源逐渐匮乏,因此对多叶棘豆的野生驯化迫在眉睫。然而在野生变家栽的驯化过程中,以种子作为繁殖材料,发芽非常困难,发芽率近于零,成为多叶棘豆生产的一大障碍。
外源激素有助于破除种子休眠,促进幼苗生长。赤霉素(GA3)和生长素(IAA)是目前常用的2种主要的外源激素。用GA3和IAA浸种可提高多种种子的发芽率,促进种子萌发,参与植物生长和发育的很多重要过程[2,3]。不同浓度激素对种子萌发作用程度不同,不同植物对同一激素的敏感程度也不同[4,5]。目前,关于多叶棘豆种子萌发特性的研究比较缺乏[6],这极大地限制了其在生产实践中的应用。本研究选用多叶棘豆种子作为试验材料,研究外源激素GA3和IAA对其种子萌发的影响,以期为筛选出多叶棘豆种子的最适萌发条件,提高出苗率,为促进种子发芽和幼苗生长提供理论依据,从而实现野生变家种资源的可持续利用。
1 材料与方法
1.1 实验材料
多叶棘豆种子于2018年8月采自内蒙古赤峰市赛罕乌拉,经王晓琴教授鉴定为多叶棘豆(Oxytropismyriophylla(Pall.)DC.)种子,采收后在室内阴干保存,于2018年9月开始本实验研究。
1.2 实验方法
1.2.1种子质量特性研究
选择成熟、饱满、健康的多叶棘豆种子测定千粒重、含水量和吸水率。
1.2.2种子处理
选择成熟、饱满、健康的多叶棘豆种子为萌发材料,将种子用5%次氯酸钠溶液浸种5 min进行消毒处理,消毒后用蒸馏水漂洗3次,备用。
1.2.3GA3不同浓度和不同浸种时间的处理对多叶棘豆种子萌发的影响
设置24个处理,每个处理3次重复。在每个蒸发皿中放50粒种子,设置GA3浓度为100 mg·L-1、200 mg·L-1、300 mg·L-1、400 mg·L-1、500 mg·L-1,以蒸馏水浸种处理为对照组,分别浸种7 h、14 h、21 h和28 h。将处理后的种子分别均匀播入铺有双层滤纸的培养皿,在25 ℃、12 h黑暗、12 h光照的恒温培养箱中进行发芽。每天观察记录种子萌发情况,以种子露白为萌发标志。
1.2.4IAA不同浓度和不同浸种时间的处理对多叶棘豆种子萌发的影响
设置24个处理,每个处理3次重复。在每个蒸发皿中50粒种子,设置IAA浓度为1 mg·L-1、5 mg·L-1、20 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1,以蒸馏水浸种处理为对照组,分别浸种7 h、14 h、21 h和28 h。将处理后的种子分别均匀播入铺有双层滤纸的培养皿,在25 ℃、12 h黑暗、12 h光照的恒温培养箱中进行发芽。每天观察记录种子萌发情况,以种子露白为萌发标志。
1.2.5指标测定
发芽率(%)=(15 d内正常发芽的种子数/供试种子总数)×100%;
发芽势(%)=(试验种子于第10天发芽种子个数/供试种子总数)×100%;
发芽指数=∑Gt/Dt(式中:Gt为在发芽试验期内每日的发芽种子个数;Dt为对应的种子发芽日数)。
1.3 数据处理
数据以“平均值±标准差”表示,采用Microsoft Office Excel 2007软件处理数据并绘图,采用SPSS 19.0软件进行数据统计分析,用最小显著极差法(LSD)进行差异显著性检验和多重比较(p<0.05)。
2 结果与分析
2.1 多叶棘豆种子质量特性研究
多叶棘豆种子细小,扁肾形,表面褐色或灰黄色,种子一侧有一凹口。种子净度为(94.6±0.35)%,千粒重为(1.45±0.04)g,含水量为(5.13±0.85)%。多叶棘豆种子的吸水率见图1,在4 h内,多叶棘豆种子吸水较为缓慢,从8 h开始吸水显著增加,在36 h吸水率达到最大值,为16.6%,与各处理之间有显著性差异(p<0.05)。在36 h之后,多叶棘豆种子吸水率未发生显著性变化,趋于稳定。

注:不同的小写字母表示在0.05水平上的显著差异性。下同。图1 多叶棘豆种子的吸水率
2.2 GA3不同浓度和浸种时间对多叶棘豆种子萌发特性的影响
2.2.1GA3不同浓度和浸种时间对多叶棘豆种子发芽率的影响
如图2所示,在浸种时间相同的情况下,多叶棘豆种子的发芽率随GA3浓度的增加均呈先升高后降低的趋势。与对照相比,100 mg·L-1的GA3浸种14 h、21 h,200 mg·L-1的GA3浸种7 h、14 h、21 h、28 h,300 mg·L-1的GA3浸种7 h、14 h、21 h、28 h,400 mg·L-1的GA3浸种7 h、14 h、21 h、28 h,500 mg·L-1浸种21 h、28 h都能提高多叶棘豆种子的发芽率,其中400 mg·L-1GA3浸种7 h与其他组相比差异最为明显(p<0.05),发芽率达24.67%。
2.2.2GA3不同浓度和浸种时间对多叶棘豆种子发芽势的影响
发芽势是评价种子萌发程度的另一个重要指标,能够较好地反映种子发芽的快慢和整齐度。由图3可知,在浸种时间相同的情况下,发芽势也随着GA3浓度的增加呈先升高后降低的趋势。与对照组相比,300 mg·L-1GA3浸种 7 h、14 h、21 h、28 h,400 mg·L-1GA3浸种 7 h、14 h、21 h、28 h,500 mg·L-1GA3浸种21 h,均能提高种子发芽势,差异显著,其中400 mg·L-1GA3浸种处理发芽势较其他组提高明显,达19.33%。
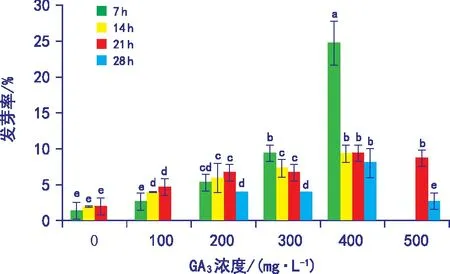
图2 GA3不同浓度和不同浸种时间对 多叶棘豆种子发芽率的影响

图3 GA3不同浓度和不同浸种时间对 多叶棘豆种子发芽势的影响
2.2.3GA3不同浓度和浸种时间对多叶棘豆种子发芽指数的影响
如图4所示,相同浸种时间处理下,随着GA3浓度的增加,整体呈先增加后降低的趋势。除了100 mg·L-1GA3浸种7 h外,其余处理组均与对照有显著性差异,其中400 mg·L-1GA3浸种7 h处理后,发芽指数较其他组显著升高。
2.2.4GA3不同浓度和浸种时间对多叶棘豆种子胚根长度的影响
由表1可知,在同一处理时间下,多叶棘豆的胚根随着GA3浓度的增加基本呈先增加后降低的趋势,浸种7 h处理后,100 mg·L-1GA3处理组与对照组相比增加了约2.5倍,400 mg·L-1GA3处理后,增加了约4.3倍。同一浓度处理下,不同浸种时间的处理组之间差异不显著。结果表明,不同浓度的GA3对多叶棘豆种子胚根长的影响作用大于浸种时间对其的影响。
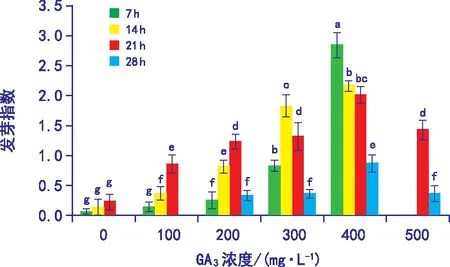
图4 GA3不同浓度和不同浸种时间对 多叶棘豆种子发芽指数的影响

表1 GA3不同浓度和浸种时间对多叶棘豆胚根长的影响
2.3 IAA不同浓度和浸种时间对多叶棘豆种子萌发特性的影响
2.3.1IAA不同浓度和浸种时间对多叶棘豆种子发芽率的影响
如图5所示,在同一浸种时间处理下,多叶棘豆种子发芽率基本呈先增加后降低的趋势。与对照相比,5 mg·L-1的IAA处理21 h,10 mg·L-1的IAA处理7 h、14 h、21 h,20 mg·L-1的IAA处理7 h、14 h、21 h、28 h均有不同程度的增高,其中10 mg·L-1的IAA处理21 h最为显著,为13.33%,较对照增加近4倍。
2.3.2IAA不同浓度和浸种时间对多叶棘豆种子发芽势的影响
如图6所示,IAA处理多叶棘豆种子后,对其发芽势有一定提高作用。其变化规律与发芽率基本一致,10 mg·L-1的IAA处理组变化较为明显,10 mg·L-1的IAA浸种7 h后,发芽势达8.67%,较对照增加了2.2倍。
2.3.3IAA不同浓度和浸种时间对多叶棘豆种子发芽指数的影响
如图7所示,10 mg·L-1的IAA处理组对多叶棘豆种子发芽指数的影响与对照组相比均有显著性差异,其中浸种21 h最为显著,较对照增加了2.5倍。随着IAA浓度继续增加,呈下降趋势。可见IAA对多叶棘豆种子萌发的影响具有适宜的浓度范围。

图5 IAA不同浓度和不同浸种时间对 多叶棘豆种子发芽率的影响
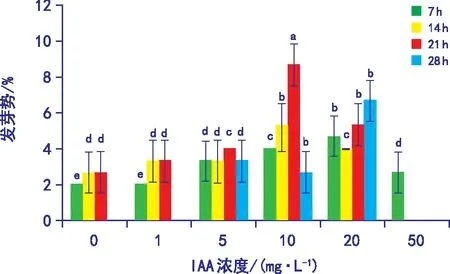
图6 IAA不同浓度和不同浸种时间对 多叶棘豆种子发芽势的影响

图7 IAA不同浓度和不同浸种时间对 多叶棘豆种子发芽指数的影响
2.3.4IAA不同浓度和浸种时间对多叶棘豆种子胚根长度的影响
如表2所示,1 mg·L-1的IAA处理与5 mg·L-1的IAA处理组对多叶棘豆种子胚根长度的影响与对照相比均无显著差异,用10 mg·L-1的IAA处理后,胚根长度较对照增加显著,浸种7 h、14 h、21 h、28 h后较对照分别增加了72%、83%、1.6倍和3.7倍。随着浓度的增加,胚根长度又开始降低。50 mg·L-1的IAA处理后,只有浸种7 h的处理种子发芽,胚根长度接近对照水平,而浸种14 h、21 h、28 h后均无发芽。可见,一定浓度的IAA可促进多叶棘豆种子胚根的生长,但高浓度反而会抑制其发芽和生长。
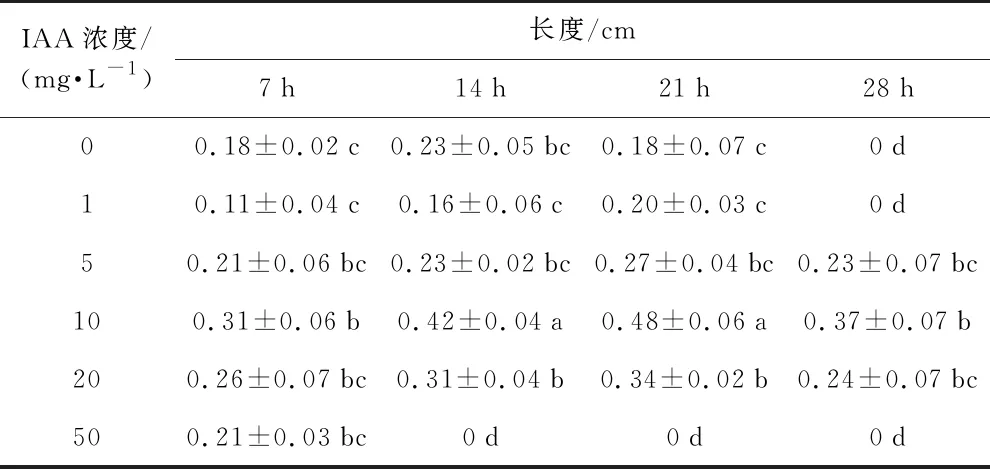
表2 IAA不同浓度和浸种时间对多叶棘豆胚根长的影响
3 结论与讨论
使用植物生长调节剂浸种,能破除种子休眠,破坏阻碍种子萌发的相关物质,从而提高种子发芽率,促进幼苗生长,是改善田间生产性能重要且简单易行的方法之一[7]。GA3和IAA是目前常用的2种主要外源激素,均能促进多种植物种子的萌发,提高种子活力[8,9]。本试验通过测定发芽率、发芽势、发芽指数及胚根生长状况,从不同角度探讨多叶棘豆在不同浓度GA3和IAA溶液,以及不同浸种时间处理下种子的萌发状况。
GA3能够提高种子中以α-淀粉酶为主的水解酶的活性,能够使贮藏物质大部分分解,为种子萌发提供非结构性碳水化合物和其它养分[10],从而输送到新生器官供生长使用,因此GA3浸种可以促进种子萌发,提高种子发芽率[11],且GA3对植物的生长呈低浓度促进高浓度抑制的趋势[12]。本研究中,在同一浸种时间处理下,随着GA3浓度的增加,对多叶棘豆种子萌发的促进作用呈先增强后减弱的趋势,这与对苦瓜[13]、珠芽魔芋[14]、蓝花棘豆[4]等种子的研究结果一致。
IAA作为重要的内源和外源激素,能够参与植物生长和发育的很多重要过程,如侧根的形成、茎的生长、器官的生长和衰老以及植物的向地性和向光性反应等[15]。刘启彤等研究认为,IAA具有促进种子萌发、诱导休眠芽生长和促进细胞分裂的作用[16]。IAA 在低浓度能促进种子萌发,高浓度抑制种子萌发,且IAA对不同植物敏感程度不同。本研究也表明,低浓度IAA(<10 mg·L-1)处理时,对多叶棘豆种子发芽具有一定的促进作用,随着浓度增加,当IAA为20 mg·L-1时,促进作用开始减弱,当IAA浓度为50 mg·L-1时,反而表现出抑制作用,发芽率显著降低。可见,只有在适宜浓度范围内,才会对多叶棘豆种子萌发起到促进作用。
综上所述,一定浓度范围内的GA3和IAA浸种可促进多叶棘豆种子的萌发,提高其发芽率,GA3的作用效果强于IAA,该试验可为实际生产提供理论依据,为多叶棘豆的人工化种植奠定基础。但整体来说,发芽率还是较低,如何进一步提高多叶棘豆发芽率,从而加快其人工驯化的进程还有待深入研究。

