紫苏籽蛋白对免疫力低下小鼠免疫调节功能的研究
朱 艳,姜 盛,李明亮,董 哲,王雨晴,郭 颖,*,谷瑞增,*
(1.中国食品发酵工业研究院有限公司,北京 100015; 2.华狐生物科技(中国)有限公司,辽宁沈阳 110000)
紫苏是我国种植历史悠久的一种药食同源植物,具有润肺止咳、下气消痰、宽肠、止痛、安胎的功效[1]。紫苏籽出油率40%~50%,且α-亚麻酸的含量高达60~70%左右,居所有植物之首[2]。因此,对紫苏籽的研究主要集中在对紫苏油的开发和利用方面。紫苏油提取后的副产物紫苏籽粕中蛋白质含量高达28%~33%,富含人体必需的8种氨基酸以及儿童必需的10种氨基酸,是一种优质的植物蛋白[3-4]。目前对紫苏籽粕的研究主要集中在紫苏分离蛋白的提取、蛋白质功能性质的检测以及酶解紫苏蛋白制备活性肽等方面[5-8]。但是对紫苏蛋白的生物功能方面的研究并不多见,深入探索紫苏蛋白的生物功能,对紫苏蛋白商业价值的提高具有重要意义。
现代研究表明,多种疾病的发生都与免疫系统紊乱密切相关,比如衰老、癌症、抑郁症等[9-11],因此增强机体免疫力对预防疾病的发生具有重要作用。然而目前存在的免疫调节化学药物具有用药时间长、药物残留、环境污染等缺点[12],而植物蛋白是一类潜在的天然免疫调节剂,对机体毒害小[13],是近年来国内外学者研究的重点。研究表明,紫苏籽蛋白具有消炎止痛的功效,经常食用含紫苏籽蛋白的产品,能够提高机体抗氧化能力,增强体质并延缓衰老[14],因此,紫苏籽蛋白具有很好的调节机体免疫力的潜力。因此,本实验以环磷酰胺(CTX)建立免疫低下小鼠模型,探讨紫苏籽蛋白其免疫系统调节作用,以期对未来相关产品的开发以及其它生物活性的研究奠定理论基础。
1 材料与方法
1.1 材料与仪器
健康Balb/c雌性小鼠(动物许可证:SCXK(京)2016-0006) 6~8周龄,16~18 g,购自北京维通利华实验动物技术有限公司,饲料和垫料也由该公司提供,小鼠饲养于SPF级动物房内,实验期间维持环境温度为(22~24) ℃,适应性饲养1周后用于实验;紫苏籽蛋白 实验室自制;左旋咪唑 北京索莱宝生物技术有限公司;小鼠淋巴瘤细胞YAC-1 上海冠导生物工程有限公司;RPMI-1640培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS) Hyclon公司;青霉素/链霉素、胰酶、红细胞裂解液、CCK-8 碧云天生物技术研究所;补体、15%绵阳红细胞(SRBC)、0.33%中性红染色液、0.4%台盼蓝染色液 北京索莱宝生物工程有限公司;MTT、刀豆蛋白Con A、脂多糖LPS Sigma Aldrich公司;TNF-α、IL-2酶联免疫检测试剂盒 北京百智生物科技有限公司。
BD C6流式细胞仪、240i直热式二氧化碳培养箱 美国Thermofisher公司;CKX-4倒置相差显微镜 日本奥里巴斯有限公司;Spectra MR多功能酶标仪 美国Dynex公司;721型紫外分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 紫苏籽蛋白的制备 紫苏籽粕→破碎→一次碱溶(50 ℃、pH=10)→离心→二次碱溶(50 ℃、pH=9)→离心→酸沉(用HCl调pH至4.4)→离心→解碎、调浆中和(pH调至7.2)→过滤→均质→灭菌→喷雾干燥→紫苏籽蛋白
1.2.2 实验动物分组和给药 健康Balb/c雌性小鼠54只,随机分为空白组、模型组、阳性对照组(左旋咪唑30 mg/kg)、紫苏籽蛋白低、中、高剂量组,成人(按照60 kg体质量计算)每日推荐摄入量为3 g,试验采取人体推荐摄入量的2倍、1倍、0.5倍分别作为高(1200 mg/kg)、中(600 mg/kg)、低(300 mg/kg)剂量对小鼠进行灌胃。每组6只,每天一次灌胃给药,空白组和模型组给予等体积的生理盐水,持续28 d。除空白组外,每组每天按照40 mg/kg腹腔注射CTX,连续3 d,后每隔一周注射一次,注射剂量为80 mg/kg,空白组腹腔注射等体积生理盐水,建立免疫力低下小鼠模型[15]。末次给药后,小鼠禁食不禁水12 h,处死小鼠,进行各项免疫指标的检测。
1.2.3 小鼠体重和免疫器官重量的测定 给药期间每隔3 d称量一次体重,28 d后,小鼠断食不断水12 h,称重后将小鼠断颈处死,解剖取其胸腺和脾,称重,计算胸腺系数和脾脏系数。

1.2.4 小鼠脾淋巴细胞增殖能力的检测 参考张瑞雪等[16]的实验方法制备小鼠脾细胞悬液:小鼠断颈处死后浸泡于75%酒精中5 min,随后在无菌条件下分离脾,用剪刀将脾剪碎并研磨,研磨过程中不断用灭菌的PBS冲洗,过200目尼龙筛网,收集滤液,1200 r/min离心5 min,弃上清,加入2 mL红细胞裂解液重悬细胞,室温裂解2~3 min,离心弃上清,用RPMI-1640不完全培养基清洗1~2次,将其重悬于含10% FBS、1%青霉素/链霉素的RPMI-1640完全培养基中,得到脾细胞悬液,台盼蓝染色确定细胞存活率大于95%方可用于实验。用RPMI-1640完全培养基调整细胞密度为5×106个/mL接种于96孔板,每孔90 μL,再向每孔添加10 μL Con A/LPS,使其终浓度为15 μg/mL,每组6个复孔,于37 ℃、5% CO2培养箱中诱导培养72 h,向每孔添加10 μL CCK-8,继续孵育2 h,用酶标仪于490 nm处测OD值,空白组为灌胃生理盐水小鼠淋巴细胞,小鼠淋巴细胞的增殖能力用刺激指数(SI)表示:
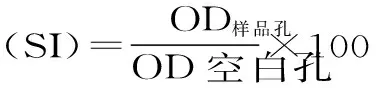
1.2.5 小鼠血清溶血素的测定 小鼠持续灌胃24 d后,腹腔注射0.2 mL体积分数为2%的SRBC致敏,4 d后摘眼球取血,4 ℃过夜放置,分离血清。实验时,用生理盐水将血清稀释200倍后取血清样品1 mL、10% SRBC 0.5 mL、10%补体1 mL于离心管中,用生理盐水代替血清作为对照,37 ℃水浴30 min,冰浴终止反应,3500 r/min离心10 min取上清,用紫外分光光度计测定540 nm处的吸光度值,以生理盐水作为空白调零[17]。

1.2.6 小鼠NK细胞杀伤力的测定
1.2.6.1 靶细胞的准备 选取小鼠淋巴瘤细胞(YAC-1细胞)作为靶细胞。细胞培养在含10% FBS、1% 青霉素/链霉素的RPMI-1640完全培养基中,每2 d换一次液,待细胞长满培养瓶的80%左右,按照1∶3进行传代培养。实验时,对细胞进行台盼蓝染色,确定细胞活性大于95%即为靶细胞。实验时,用RPMI-1640完全培养基调整细胞密度为1×105个/mL。
1.2.6.2 NK细胞杀伤力的测定 用RPMI-1640完全培养基调整脾细胞悬液密度为5×106个/mL,作为效应细胞。实验组向U型96孔板中加入效应细胞和靶细胞各100 μL,保证效靶比为50∶1,设置靶细胞YAC-1对照孔,添加100 μL YAC-1细胞悬液和100 μL RPMI-1640完全培养基,另设效应细胞对照孔,添加100 μL 效应细胞悬液和100 μL RPMI-1640完全培养基。37 ℃孵育4 h后向每孔添加10 μL CCK-8,37 ℃继续孵育2 h,用酶标仪于490 nm处测OD值[18],按照下面方法计算NK细胞杀伤率:

1.2.7 小鼠腹腔巨噬细胞吞噬能力的测定
表1 紫苏籽蛋白对小鼠体重的影响Table 1 Effect of Perilla frutescens seed protein on mice
1.2.7.1 巨噬细胞的制备 小鼠持续灌胃25 d后,给小鼠腹腔注射1 mL 4%淀粉肉汤溶液,3 d后断颈处死小鼠[19],并在75%酒精中浸泡5 min,于无菌工作台上剥离腹部皮肤,注意不要剪破腹腔膜,用一次性注射器向其腹腔内注射3 mL无菌PBS,轻轻按摩腹部2~3 min,收集腹腔液,1200 r/min离心5 min,弃上清,用不完全RPMI-1640培养基清洗2次,收集沉淀,并重悬于RPMI-1640完全培养基中,台盼蓝染色确定细胞活性大于95%,调整细胞密度为5×106个/mL,取96孔板,每孔加入100 μL细胞悬液,37 ℃培养2.5 h,吸弃培养基,并洗去未贴壁细胞,再向每孔加入100 μL完全培养基,即得到单层巨噬细胞。
1.2.7.2 巨噬细胞吞噬能力测定 得到的单层巨噬细胞在37 ℃、5% CO2培养箱中继续培养24 h,吸弃培养液,调整细胞浓度为1×106个/mL,继续培养2.5 h使其贴壁,再每孔加入100 μL 0.1%中性红溶液,继续培养1 h,用PBS洗去未被吞噬的中性红,每孔加入100 μL细胞裂解液(含体积分数1%的乙酸和50%的乙醇),室温放置2~3 h,待细胞溶解后,用酶标仪测定559 nm处吸光度值,空白组为灌胃生理盐水小鼠腹腔巨噬细胞,并计算吞噬指数(PI):

1.2.8 小鼠血清IgG、IL-2含量的测定 小鼠禁食12 h后,用乙醚麻醉,摘眼球采血,分离血清,用酶联免疫检测试剂盒测定血清中IgG和IL-2含量。
1.3 数据处理
2 结果与分析
2.1 紫苏籽蛋白对小鼠体重和免疫器官重量的影响
胸腺和脾脏是机体两大重要免疫器官,胸腺是T淋巴细胞分化、发育和成熟的场所,脾脏是T、B淋巴细胞储存和发挥作用的场所[20],因此它们的增重往往代表着淋巴细胞的增殖,从而直接体现了免疫应答的强弱[21]。表1为灌胃期间小鼠体重、胸腺系数和脾脏系数的变化,由数据可知,28 d后,模型组小鼠体重与空白组相比增加不明显,不同剂量的紫苏蛋白均能增加小鼠体重。与空白组相比,模型组小鼠脾脏系数和胸腺系数极显著降低(P<0.01),与模型组相比,中剂量的紫苏籽蛋白显著增加免疫低下小鼠的脾脏系数(P<0.05),并极显著的增加了胸腺指数(P<0.01),可见紫苏籽蛋白很好的延缓CTX引起的免疫器官缩减。
2.2 紫苏籽蛋白对T/B淋巴细胞增殖能力的影响
淋巴细胞是免疫系统中主要的免疫细胞,其中T/B淋巴细胞承担着机体内的体液免疫和细胞免疫,它们可分别由刀豆蛋白(Con A)和脂多糖(LPS)诱导活化,其增殖活化决定了淋巴细胞的数量,影响着免疫水平的强弱,为常见的免疫检测指标[22-23]。
如图1所示为紫苏籽蛋白对免疫低下小鼠T/B淋巴细胞增殖的影响。与空白组相比,CXT导致小鼠脾淋巴细胞的增殖极显著降低(P<0.01),模型建立成功。与模型组相比,低剂量的紫苏籽蛋白显著促进了B淋巴细胞的增殖(P<0.05),随着浓度的增加,紫苏籽蛋白对T/B淋巴细胞的增殖呈现先增加后降低趋势,其中,中剂量的紫苏籽蛋白对免疫力低下小鼠T/B淋巴细胞的增殖效果较模型组均具有极为显著的差异(P<0.01),所以适量摄入紫苏籽蛋白对细胞免疫和体液免疫均能起到增强效果,而过量蛋白的摄入可能增加了小鼠的代谢负荷,反而影响免疫功能的发挥[24]。
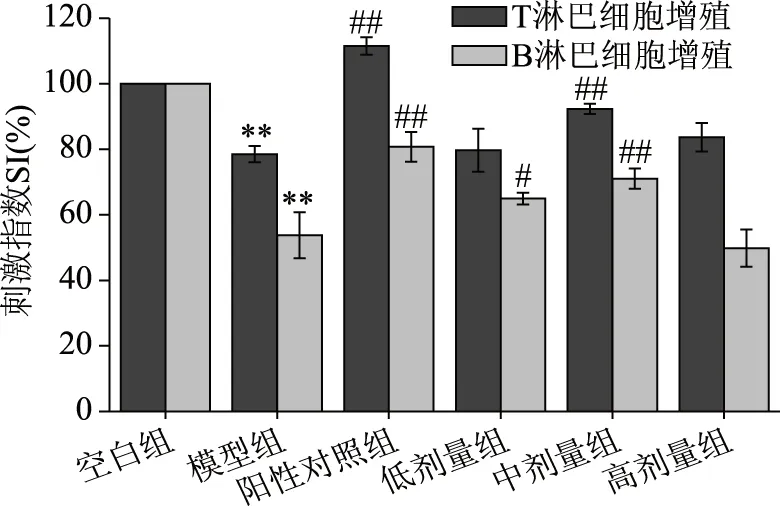
图1 紫苏籽蛋白对小鼠T/B淋巴细胞增殖影响Fig.1 Effect of Perilla frutescens seed proteinon T/B lymphocyte proliferation in mice
2.3 紫苏籽蛋白对血清溶血素含量的影响
血清溶血素是B淋巴细胞接触到特异性抗原,即绵阳红细胞SRBC后产生的特异性抗体,其含量多少体现了机体释放特异性抗体的能力[25]。小鼠经SRBC免疫后产生的特异性抗体主要存在血清中,它与SRBC和补体在一定条件下会引起SRBC发生溶血,溶血程度与分泌的抗体量相关[26],因此血清溶血素的含量是反应机体体液免疫强弱的一个重要指标。
如图2所示,紫苏籽蛋白能很好地提高免疫力低下小鼠血清溶血素水平,中剂量的紫苏籽蛋白极其显著提高了免疫力低下小鼠血清半数溶血值(P<0.01),且相比于阳性药物左旋咪唑的效果无明显差异(P>0.05)。因此,中剂量紫苏籽蛋白具有较强的免疫调节作用,且效果与左旋咪唑相当。
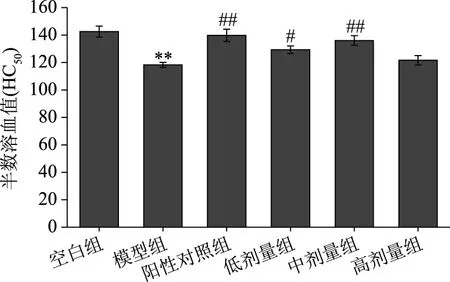
图2 紫苏籽蛋白对小鼠血清血溶素含量的影响Fig.2 Effect of Perilla frutescens seed proteinon serum lysin content in mice
2.4 紫苏籽蛋白对小鼠NK细胞杀伤力的影响
NK细胞(自然杀伤力细胞)是淋巴细胞的一种,是天然存在于生物体内非特异性的免疫细胞,在无抗原刺激和抗体存在的情况下能够直接溶解和清除些肿瘤细胞和病毒感染的细胞[27],目前NK细胞被认为是免疫监视细胞中最理想的效应细胞。
图3为紫苏籽蛋白和对免疫低下小鼠NK细胞杀伤力的影响,可以看出,正常小鼠腹腔注射CTX后,NK细胞杀伤力降低,免疫力极显著降低(P<0.01)。紫苏籽蛋白能较好的提高免疫低下小鼠NK细胞杀伤力,且在低剂量组下就能显著地提高NK细胞杀伤力(P<0.05),中剂量组下极显著地提高了NK细胞杀伤力(P<0.01),继续增加蛋白浓度,效果变弱,但仍显著提高了免疫低下小鼠NK细胞的杀伤力能力。相比而言,左旋咪唑对NK细胞杀伤力的影响较弱,中剂量的紫苏籽蛋白提高NK细胞杀伤力的功效较之增加了9.4%。

图3 紫苏籽蛋白对小鼠NK细胞杀伤力的影响Fig.3 Effect of Perilla frutescens seed proteinon NK cell lethality in mice
2.5 紫苏籽蛋白对小鼠巨噬细胞吞噬能力的影响
非特异性免疫是机体免疫系统的重要组成部分,巨噬细胞能够识别外来异物并能通过吞噬作用起到清除效果[28],其吞噬能力的强弱不仅代表着吞噬细胞的活性,而且在机体低于外来病原体入侵和维持内环境稳态等生命活动中占据重要作用[29]。吞噬中性红的定量测定常用来评价吞噬细胞的吞噬能力。
如图4所示,正常小鼠注射CTX后吞噬细胞吞噬指数极显著降低(P<0.01),对免疫低下小鼠灌胃紫苏籽蛋白后,小鼠内吞噬细胞吞噬异物能力提高,低剂量的紫苏籽蛋白较模型组显著提高了免疫低下小鼠腹腔吞噬细胞吞噬指数(P<0.05),随灌胃浓度增加,效果减弱。但是低剂量和中剂量的紫苏蛋白在增强小鼠巨噬细胞吞噬能力方面并无显著差异。因此,紫苏籽蛋白能够增强免疫低下小鼠非特异性免疫,但剂量不易过高。

图4 紫苏籽蛋白对小鼠腹腔巨噬细胞吞噬能力的影响Fig.4 Effect of Perilla frutescens seed protein onphagocytosis of peritoneal macrophages in mice
2.6 紫苏籽蛋白对小鼠血清IL-2、IgG含量的影响
IL-2即白细胞介素-2是由T淋巴细胞产生的一种糖蛋白,它的生物学功能主要是促进T淋巴细胞的增殖和分化,介导细胞免疫应答[30],它也能够促进B淋巴细胞的增殖,但不是B淋巴细胞增殖所必须的,增强NK细胞杀伤力,激活体内巨噬细胞,是评价细胞免疫功能的重要指标[31]。IgG是体液免疫应答中产生的主要的抗体,由B淋巴细胞分泌产生,约占全部抗体的80%,是反映体液免疫的常见指标[32]。
结果如表2所示,经CTX诱导后,正常小鼠体内IL-2和IgG含量均极显著降低(P<0.01),说明CTX诱导免疫力低下小鼠模型建立成功。三个剂量下紫苏籽蛋白对IL-2的分泌均起到了良好的促进效果,与模型组相比具有极为显著差异(P<0.01),中剂量的紫苏蛋白效果最强。高剂量的紫苏蛋白对促进IL-2分泌的效果与阳性药物左旋咪唑相当,但对B淋巴细胞的增殖与模型组相比并没有表现出显著的差异(P>0.05),这可能与IL-2主要是介导细胞免疫的生物学功能相关[30],免疫力低下小鼠过量摄入蛋白质,可能会增加小鼠代谢负荷,不利于免疫系统的恢复[24]。三个剂量组的紫苏籽蛋白虽增加了免疫低下小鼠血清中IgG含量,但与模型组相比无差异,可见,紫苏籽蛋白对小鼠细胞免疫具有更好的调节作用。
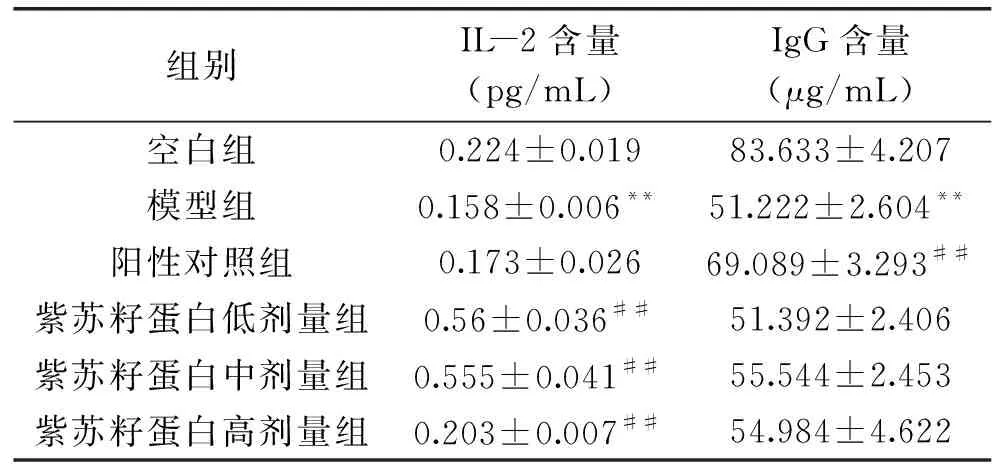
表2 紫苏籽蛋白对小鼠血清中IL-2和IgG含量的影响Table 2 Effect of Perilla frutescens seed proteinon IL-2 and IgG levels in serum of mice
3 结论
本实验探究了紫苏籽蛋白对CTX诱导的免疫力低下小鼠的免疫调节作用,研究表明,连续28 d的灌胃紫苏籽蛋白后,小鼠的脾脏指数和胸腺指数均增加,有效遏制了CTX引起的免疫器官的衰减。在细胞免疫中,随着紫苏籽蛋白浓度的增加,T/B淋巴细胞增殖率均呈现出先增加后降低的趋势,中剂量的紫苏籽蛋白对促进T/B淋巴细胞的增殖效果最好,同时显著促进T淋巴细胞分泌IL-2,又反过来刺激细胞免疫和体液免疫的发生。中剂量的紫苏籽蛋白对体液免疫也具有很好的调节效果,大量增加了免疫低下小鼠血清溶血素含量,但对促进B淋巴细胞分泌IgG效果不明显,因此对体液免疫的调节功效也具有一定的调节作用。在非特异性免疫中,紫苏籽蛋白对NK细胞杀伤力以及吞噬细胞吞噬能力均有一定程度的影响,相比于高剂量的紫苏籽蛋白,低剂量和中剂量的效果更强。综上所述,适量摄入紫苏籽蛋白能够很好的起到增强免疫力的效果,但是过量摄入则会带来相反的结果。而关于紫苏籽蛋白免疫调节的作用机制还需进一步实验探究,为未来相关产品和保健品的开发提供新的思路。

