紫马铃薯花色苷的提取、纯化及其稳定性研究
于世莹,王文秀,马倩云,马子晔,任丛涛,宫可心,孙剑锋,*
(1.河北农业大学食品科技学院,河北保定 071000; 2.张家口弘基农业科技开发有限责任公司,河北张家口 075000; 3.今麦郎面品有限公司,河北邢台 054000)
马铃薯(SolanumtuberosumL.)原产于南美洲,是我国重要的农作物之一[1-3]。紫马铃薯是一种新型马铃薯,其中富含花色苷使它的块茎呈深紫色[4]。花色苷由花色苷以糖苷键与多种糖结合而成[5],作为一种水溶性天然色素[6],被广泛应用于食品工业中[7-8]。大量研究表明,花色苷不仅赋予食品诱人的色泽,在维持人类健康方面也发挥着重要作用,如抗氧化、抗癌、调节血压和多种疾病的预防等[9-11]。
目前国内外研究中花色苷的提取以溶剂法为主,但该方法提取时间较长不利于花色苷保持稳定性[12-15],而且常以甲醇、乙醇和乙酸等有机溶剂进行提取,溶剂残留会对人体带来健康和安全风险,而以柠檬酸为溶剂提取可避免此类问题。超声波提取法可以加速植物细胞内花色苷的释放速度,缩短提取时间。将超声波提取法和溶剂提取法结合可以极大程度上缩短提取时间从而提高花色苷的提取效率,保持花色苷的稳定性。初步提取的花色苷提取物中含有较多杂质,影响对其性质的研究[16]需要通过纯化去除杂质提高花色苷纯度[17]。大孔吸附树脂在花色苷的分离纯化方面具有优异的性能[18],被普遍应用在不同来源花色苷的分离纯化过程中。申芮萌[19]以XAD-7大孔树脂作为吸附材料纯化了蓝莓花色苷,Shen等[20]用XDA-6大孔吸附树脂纯化了枸杞花色苷,纯化后花色苷的稳定性受其所处外界环境的高度影响,这限制了花色苷作为天然色素在食品工业中的应用[21]。因此研究紫马铃薯花色苷的稳定性是其在食品工业中应用的重要前提[22]。
近年来,有部分关于紫马铃薯花色苷的研究。但是缺乏对其提取、分离纯化和稳定性的系统性研究。本文以河北省张家口市种植的紫马铃薯(黑金刚)为原料,以花色苷提取量为指标,通响应面法优化了紫马铃薯花色苷的提取工艺,采用大孔吸附树脂分离纯化了紫马铃薯花色苷,并以紫马铃薯花色苷的保存率作为指标,系统的研究了光照,溶液pH,温度和金属离子对紫马铃薯花色苷稳定性的影响,为紫马铃薯花色苷在食品工业中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
紫马铃薯(黑金刚) 张家口弘基农业科技有限公司;柠檬酸、乙酸钠、无水乙醇、氯化钾 国药试剂有限公司;D-101、AB-8、DM130、HPD100、X-5、NKA-9大孔吸附树脂 北京瑞达恒辉科技发展有限公司;试验用水 蒸馏水;所有试剂 均为分析纯。
AR432CN型电子分析天平 上海澳司豪仪器有限公司;DHG-9143BS-III型电热鼓风干燥箱 上海苗新有限公司;试验室pH计 上海澳司豪仪器有限公司;SK5200H型超声波清洗机 新枝生物科技公司;UV-1700PC型紫外可见分光光度计 北京普析通用仪器有限责任公司;Neofuge15R型高速冷冻离心机 长沙易达仪器有限公司;BH1000-2J蠕动泵 兰戈有限公司;BS-100A自动部分收集器 上海青浦沪西仪器厂。
1.2 实验方法
1.2.1 紫马铃薯花色苷提取工艺优化
1.2.1.1 原料预处理 将新鲜紫马铃薯洗净切片,冷冻干燥后用粉碎机粉碎,将马铃薯粉过80目筛后,放于棕色瓶中,4 ℃下保存,备用。
1.2.1.2 最佳吸收波长的确定 准确称取0.5 g冻干粉末于锥形瓶中,加入20 mL 2.5%柠檬酸溶液,在40 ℃、300 W的条件下提取15 min。提取液在4 ℃、10000 r/min的条件下离心15 min。取1 mL上清液于10 mL容量瓶中,分别用pH1.0和pH4.5缓冲溶液定容,在避光条件下平衡30 min。分别测定两组溶液400~700 nm波长下的吸光度值,以波长为横坐标,吸光度值为纵坐标绘制吸光度曲线,确定最佳吸收波长。
1.2.1.3 单因素实验 准确称取1 g样品于三角瓶中,采用浓度为2.5%的柠檬酸溶液作为提取剂,将超声波提取温度设置为40 ℃,提取时间15 min,提取功率300 W,研究料液比(1∶20、1∶30、1∶40、1∶50、1∶60 g/mL)对紫马铃薯花色苷含量的影响;设定提取时间15 min,提取功率300 W,适宜的料液比,研究提取温度(20、30、40、50、60 ℃)对紫马铃薯花色苷含量的影响;设定提取功率300 W,适宜的料液比,适宜的温度,研究提取时间(5、10、15、20、25、30 min)对紫马铃薯花色苷含量的影响;设定适宜的料液比,适宜的温度,适宜的提取时间,研究提取功率(100、200、300、400 W)对紫马铃薯花色苷含量的影响。
1.2.1.4 响应面法优化紫马铃薯花色苷的超声波辅助提取工艺 根据1.2.1.3中单因素实验的结果,利用Design-Expert V8.0.6.1设计四因素三水平的Box-Behnken试验对提取工艺进行优化。四个因素分别为:提取功率(A)、料液比(B)、提取温度(C)和提取时间(D)。每个因素分别设置三个水平,以花色苷含量作为响应值,优化紫马铃薯花色苷的提取工艺,试验因素水平设置见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiment

表2 树脂信息Table 2 Information of macroporous adsorption resin
1.2.1.5 花色苷含量测定 采用pH示差法对单体花色苷含量进行测定。测定时选择合适的稀释倍数,使样品吸光度值在分光光度计的线性范围内[23],以保证测量的准确度。总花色苷含量以矢车菊素-3-葡萄糖苷当量计。计算公式如下:
式(1)
式中:C表示样品中花色苷的含量,mg/g;A=[(A525 nm-A700 nm)pH1.0-(A525 nm-A700 nm)pH4.5];V表示提取液体积;DF表示稀释倍数;MW表示矢车菊素-3-葡萄糖苷的相对分子质量,449.2 g/mol;ε表示矢车菊素-3-葡萄糖苷的消光系数,29600 L·mol-1·cm-1;M表示样品质量,g;L表示光程,1cm。
1.2.2 紫马铃薯花色苷的纯化研究
1.2.2.1 树脂信息 本实验共选取了六种大孔吸附树脂用于紫马铃薯花色苷的分离纯化研究。树脂信息见表2。
1.2.2.2 树脂的预处理 将未使用过的六种大孔吸附树脂浸泡在无水乙醇中使其充分溶胀。随后用无水乙醇冲洗至流出液透明澄清无肉眼可见杂质为止。再用蒸馏水淋洗树脂至无乙醇残留后滤出树脂备用。
1.2.2.3 树脂的静态吸附与解析 准确称取预处理好的大孔树脂各0.5 g于三角瓶中,分别加入紫马铃薯花色苷粗提液30 mL,于30 ℃下水浴振荡4 h,吸附完成后将树脂滤出,测定滤液中紫马铃薯花色苷的含量。再将滤出的树脂中加入30 mL 95%乙醇溶液,30 ℃下水浴振荡4 h,充分解吸后将树脂滤出[24],用pH示差法测定滤液中花色苷的含量。按照每种树脂的吸附率Q(%)和解析率D(%)对树脂进行选择。计算公式如下:
式(2)
式(3)
式中:C0表示样品中花色苷的初始含量,mg/g;Ce表示吸附平衡时滤液中花色苷的含量,mg/g;C1表示解析完成后滤液中花色苷的含量,mg/g。
1.2.2.4 吸附动力学曲线测定 准确称取预处理好的树脂各0.5 g于三角瓶中,加入紫马铃薯花色苷粗提液30 mL,于30 ℃下水浴振荡4 h,每30 min测量一次提取液在525 nm下的吸光度值。
1.2.2.5 解析乙醇浓度的选择 准确称取预处理好的AB-8树脂0.5 g于三角瓶中,加入紫马铃薯花色苷粗提液30 mL,于30 ℃下水浴振荡4 h后滤出树脂。分别将树脂浸泡在不同浓度(30%、40%、50%、60%、70%、80%)的乙醇中,30 ℃下水浴振荡30 min后计算解析率。
1.2.2.6 树脂的动态吸附与解析 将预处理好的AB-8大孔树脂填充到规格为16 mm×30 cm的树脂柱中。在室温下以2.0 mL/min的流速均匀进样,样品为浓度是0.29 mg/mL的紫马铃薯花色苷粗提液。使用自动部分收集器,每5 mL收集一管流出液,测定流出液中花色苷的含量。待树脂饱和后,用蒸馏水同样以2.0 mL/min的流速冲洗树脂,以除去树脂柱中的水溶性杂质。待水洗流出液为无色后,用适宜浓度的乙醇溶液以2.0 mL/min的流速洗脱,使用自动部分收集器,每5 mL收集一管流出液,测定流出液中花色苷的含量。
1.2.3 紫马铃薯花色苷的稳定性分析
1.2.3.1 光照对紫马铃薯花色苷稳定性的影响 准确移取紫马铃薯花色苷粗提液2 mL于三角瓶中,定容至30 mL,摇匀,调节pH=3.0,分别放置于避光、室内散射光和245 nm波长的紫外灯照射条件下。每2 d测定一次花色苷的保存率,共放置30 d。
1.2.3.2 pH对紫马铃薯花色苷稳定性的影响 准确移取紫马铃薯花色苷粗提液2 mL于三角瓶中,定容至30 mL,摇匀,分别调节pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0,于60 ℃下水浴加热250 min,每50 min测定一次花色苷的保存率。
1.2.3.3 温度对紫马铃薯花色苷稳定性的影响 准确移取紫马铃薯花色苷粗提液2 mL于三角瓶中,定容至30 mL,摇匀,调节pH=3.0,分别置于60、70、80、90 ℃下水浴加热5 h,每1 h测定一次花色苷的保存率。
1.2.3.4 金属离子对紫马铃薯花色苷稳定性的影响 准确移取紫马铃薯花色苷粗提液2 mL于三角瓶中,定容至30 mL,分别加入含有0.05 mol/L Al3+、Mg2+、K+、Na+、Zn2+、Ca2+、Cu2+的溶液5 mL,摇匀,室温条件下放置12 h,测定花色苷的保存率。
1.2.3.5 花色苷保存率的计算 本试验采用花色苷的保存率作为评价其稳定性的指标,计算公式如下:
式(4)
式中:C表示某时刻样品中花色苷的含量,mg/g;C0表示样品中花色苷的初始含量,mg/g。
1.3 数据处理
每个试验重复三次,试验结果用平均数±标准差表示。本试验采用SPSS Statistics 23进行统计分析,用Design-Expert V 8.0.6.1进行响应面试验的设计和分析,用Origin 2018绘图。
2 结果与分析
2.1 紫马铃薯花色苷提取工艺优化
2.1.1 最佳吸收波长的确定 如图1所示,对两种pH下紫色马铃薯提取液吸光度测量和计算可知差值最大值出现在525 nm处。因此,紫马铃薯花色苷的最佳吸收波长为525 nm。

图2 单因素实验结果Fig.2 Results of single-factor experiments
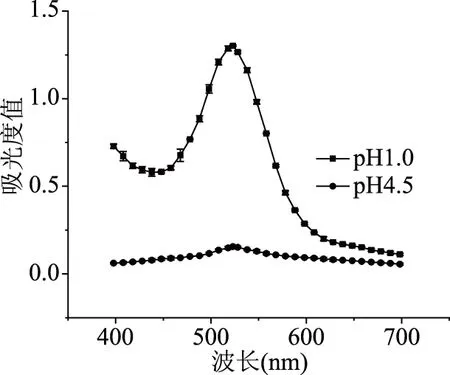
图1 最佳吸收波长的确定Fig.1 Determination of the optimal absorption wavelength
2.1.2 单因素实验结果 如图2A所示,随着料液比的增加,提取液中花青素的含量逐渐上升,当料液比达到1∶50后,提取液中花青素含量开始下降,可能是由于原料中的花青素含量一定,过多的溶剂稀释了提取物从而导致花青素含量下降。因此选择料液比为1∶50 g/mL,此时花色苷的含量为(1.428±0.015) mg/g。
如图2B所示,随着提取温度的升高,提取液中花青素的含量逐渐增加,当提取温度为50 ℃时,花色苷含量达到最高。提取温度大于50 ℃时,花色苷含量下降,可能是因为较高的温度使马铃薯中淀粉糊化,影响了花青素的溶解。因此,最佳提取温度为50 ℃,此时花色苷的含量为(1.404±0.017) mg/g。
如图2C所示,15 min前提取液中花青素的含量随着提取时间的增加而增加,15 min后,提取液中花青素的含量逐渐下降。可能是由于超声波提取法的提取效果与提取物的状态和粉碎程度密切相关,提取时间增加,有利于材料与溶剂之间充分接触,使花色苷含量提高,但长时间的处理有可能导致不稳定的物质分解导致花色苷含量下降。因此,最佳提取时间为15 min,此时花色苷的含量为(1.428±0.017) mg/g。
由图2D可知,提取功率小于300 W时,花色苷含量随着功率的增加而增加,功率达到400 W时,花色苷含量开始下降。可能是由于功率的增加导致细胞结构被破坏,胞内的分解酶被释放出来,导致花青素含量下降。因此,最佳提取功率为300 W,此时花色苷的含量为(1.364±0.019) mg/g。
2.1.3 Box-Behnken试验结果 将得到的数据由Design-Expert V8.0.6.1软件进行多元回归拟合分析后得到紫色马铃薯花色苷提取量(Y)与四种因素之间的关系满足以下二次多项回归方程:
Y=1.43+0.021A+0.092B+0.027C-9.917×10-3D-6.5×10-3AB+0.032AC-0.019AD-0.060BC+0.047BD+0.033CD-0.16A2-0.27B2-0.20C2-0.18D2
式中:Y表示样品中花色苷的含量,mg/g;A表示提取功率,W;B表示料液比,g/mL;C表示提取温度, ℃;D表示提取时间,min。
方程体现了各因素对提取效果的影响。多项式中各因素系数的正负体现了每种因素对响应值花色苷含量的影响方向,各项系数体现了各因素对响应值影响的大小。由此可知,料液比是对响应值影响最显著的因素,其次是提取温度、提取功率和提取时间。

表2 Box-Behnken试验结果Table2 Results of Box-Behnken design
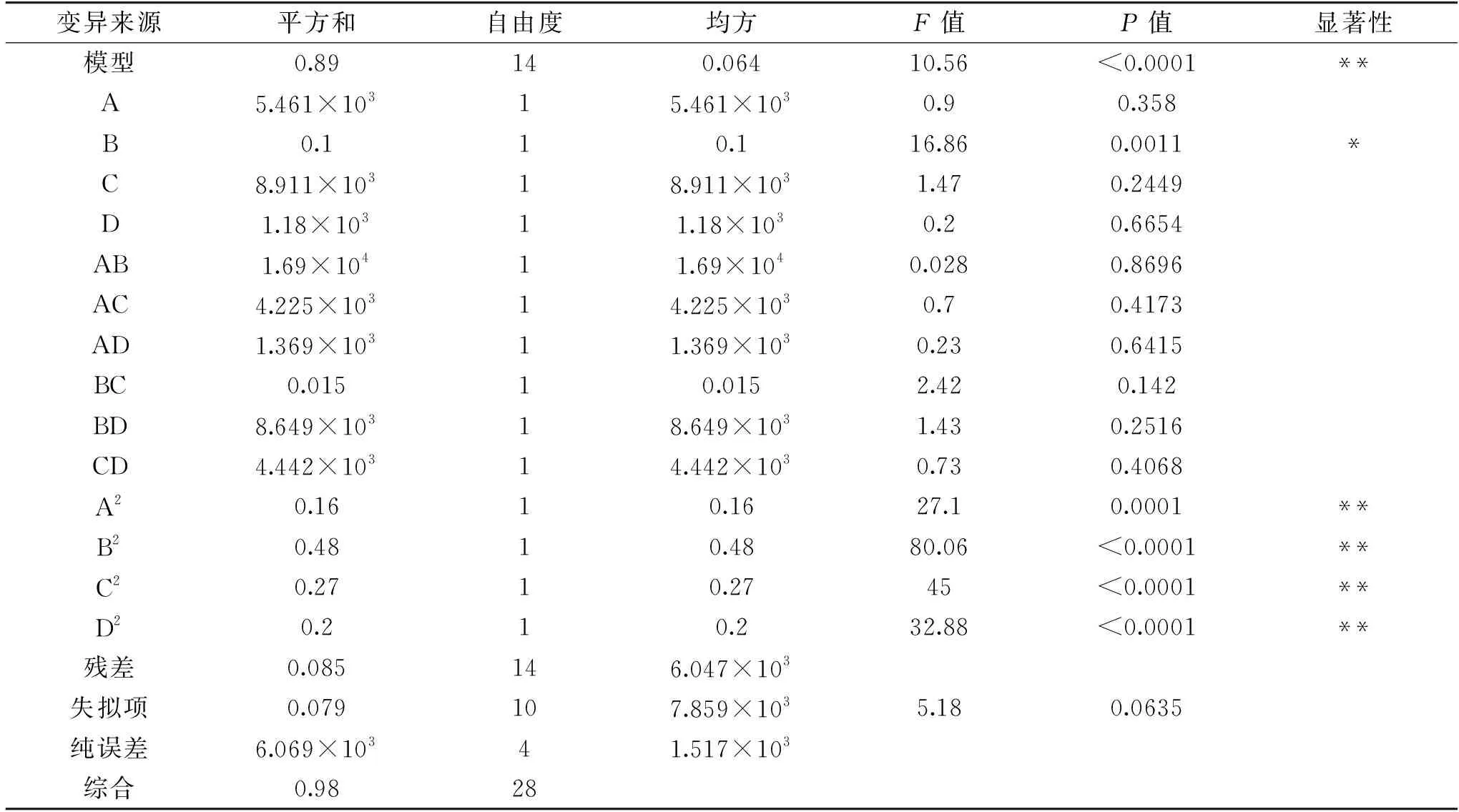
表3 回归方程方差分析Table 3 Variance analysis of regression equation
2.1.4 回归方程方差分析 由表3可以看出,模型极显著(P<0.01),调整型决定系数为0.8147,方程决定系数R2=0.9073,且模型失拟项的P值为0.0635>0.05,表明无法拒绝原假设,即可以判定本模型没有失拟现象,表明方程拟合良好,可用此模型对紫色马铃薯花色苷的提取进行分析和预测。模型中的一次项B显著(P<0.05),二次项(A2、B2、C2、D2)极显著(P<0.01),其他项不显著(P>0.05),说明各因素对响应值的影响不是简单的线性关系。根据表3中的F值可知,料液比是对响应值影响最大的因素,其次是提取温度、提取功率和提取时间,结果与2.1.3中保持一致。通过响应面分析法得出最佳提取条件为:功率307.05 W,料液比1∶51.65 g/mL,提取温度50.49 ℃,提取时间14.97 min,为方便控制将上述条件调整为:提取功率300 W,料液比1∶50 g/mL,提取温度50 ℃,提取时间15 min,在此条件下提取量为(1.435±0.27) mg/g。
2.2 紫马铃薯花色苷的纯化研究
2.2.1 不同树脂对紫马铃薯花色苷的静态吸附与解析能力 如图3所示,除X-5型大孔树脂外,其他5种树脂对紫马铃薯花色苷的吸附量都达到了85%以上,其中HPD100,D101,AB-8和NAK-9四种树脂的吸附能力较好。综合分析各种树脂的吸附和解析能力后,选择HPD100,D101,AB-8和NAK-9四种树脂进行下一步试验。
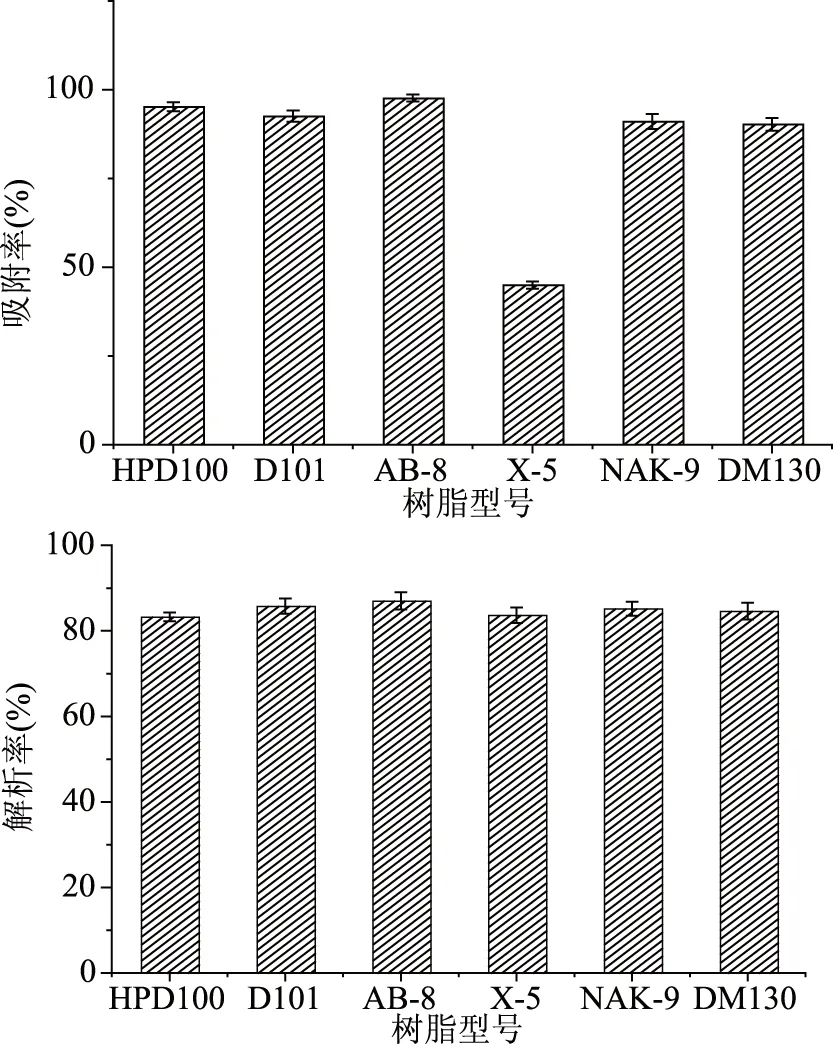
图3 不同树脂的吸附与解析能力Fig.3 Adsorption and analysis capacity of different resins
2.2.2 吸附动力学曲线 如图4所示,D101和NAK-9型树脂对紫马铃薯花色苷的吸附能力接近,AB-8和HPD100型树脂对紫马铃薯花色苷的吸附能力接近。但从吸附速度和吸附量来说AB-8型树脂都优于其他三种树脂。因此选择AB-8型树脂用于紫马铃薯花色苷的纯化。

图4 不同树脂的吸附动力学曲线Fig.4 Adsorption kinetics curves of resins
2.2.3 解析乙醇浓度的选择 如图5所示,当乙醇浓度小于60%时,解析率随着乙醇浓度的增加显著提高,当乙醇浓度大于60%时,解析率增加量不显著甚至有所下降。因此,考虑到试验成本问题,选择60%的乙醇溶液对紫马铃薯花色苷进行洗脱。

图5 乙醇浓度对解析效果的影响Fig.5 The effect of ethanol concentration on resolution
2.2.4 树脂的动态吸附和解析 如图6所示,流出液中花色苷的浓度随着进样量的增加而增加,当进样量达到9 BV(430 mL)时,流出液中花色苷浓度大于样品浓度的10%,此时即认定树脂达到吸附饱和。如图7所示,随着洗脱液体积的增加,洗脱液中花色苷的含量逐渐降低,当洗脱液体积达到6 BV(290 mL)时,流出液中花色苷的含量不再显著降低,洗脱液体积达到7 BV后,洗脱液中花色苷含量极少,综合试验成本考虑,选择6 BV洗脱液进行洗脱。
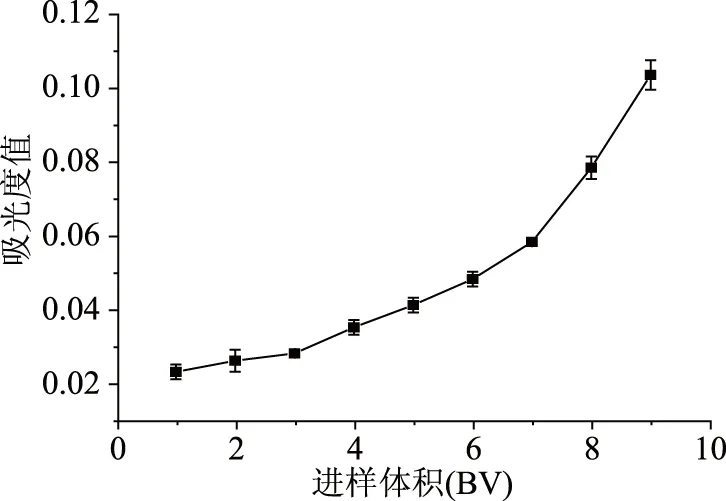
图6 AB-8树脂纯化紫马铃薯花色苷的泄露曲线Fig.6 Leakage curve of resin purification ofpurple potato anthocyanins by AB-8 resin
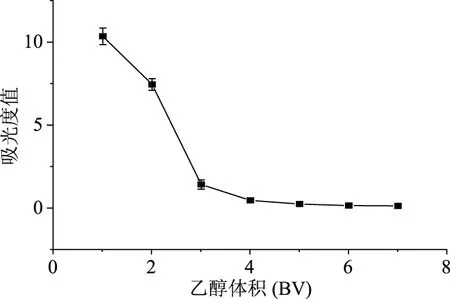
图7 AB-8树脂纯化紫马铃薯花色苷的解析曲线Fig.7 Analytical curve of purple potatoanthocyanins by AB-8 resin
2.3 紫马铃薯花色苷的稳定性分析
2.3.1 光照对紫马铃薯花色苷稳定性的影响 光照会降低花色苷稳定性,长时间的光照会导致花色苷的降解和颜色的变化[25]。如图8所示,在不同光照条件下,提取液中花色苷的含量均随着照射时间的增加而减少。其中,245 nm短波紫外线照射条件下花色苷含量下降速度最快,避光条件下最慢。由此证明短波紫外线照射对花色苷的稳定性影响较大,其次为室内散射光。有研究表明,365 nm的长波紫外线对花色苷的稳定性影响较明显小于254 nm的短波紫外线[26]。因此,紫马铃薯花色苷在运输或贮藏过程中应尽量避免光照,尤其是短波紫外线的照射。
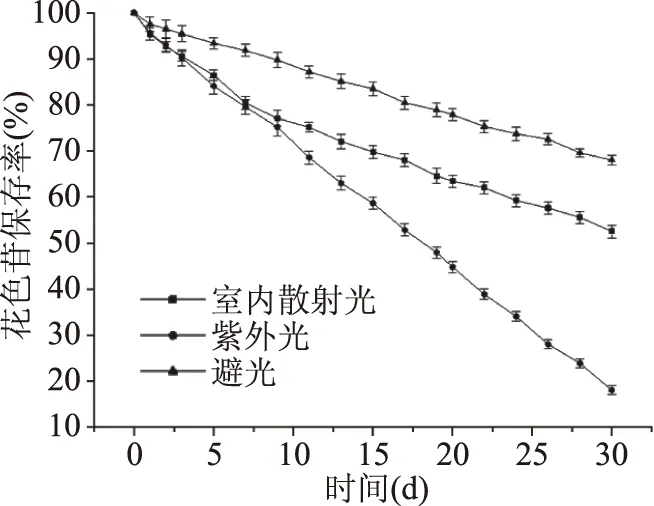
图8 光照对紫马铃薯花色苷稳定性的影响Fig.8 Effect of light on thestability of purple potato anthocyanins
2.3.2 pH对紫马铃薯花色苷稳定性的影响 在水溶液中,花色苷结构根据pH的变化而变化,在不同pH条件下以各种化学形式存在[27]。随着pH从酸性升高到碱性,花色苷变得越来越去质子化,从而导致其异构形式发生变化,颜色也从红色逐渐变为蓝紫色,pH越高花色苷的稳定越低[28]。如图9所示,在相同加热条件下,紫马铃薯花色苷的保存率与pH成反比关系。当pH>5时,保存率下降速度明显增加。因此,在马铃薯的加工运输和贮藏过程中应尽量在酸性环境下进行。
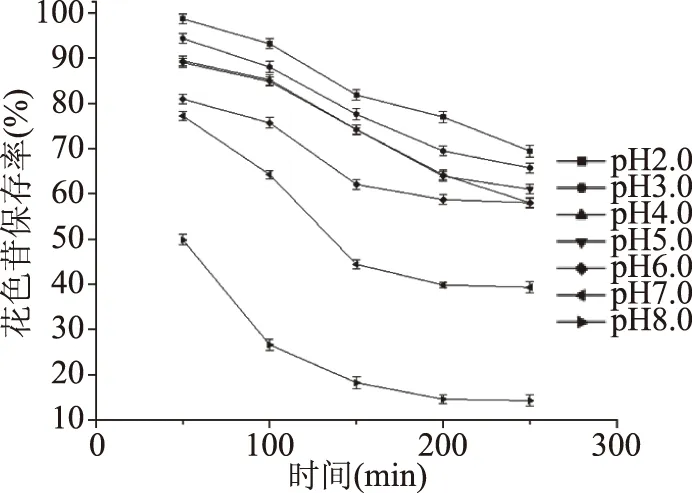
图9 pH对紫马铃薯花色苷稳定性的影响Fig.9 Effect of pH on thestability of purple potato anthocyanins
2.3.3 温度对紫马铃薯花色苷稳定性的影响 食品的生产过程中经常涉及到加热。加热会使微生物失活释放其中的内源降解酶,例如多酚氧化酶[29]等。同时热处理也会通过非酶反应,使花色苷等生物活性物质发生降解[30]。有研究表明富含花色苷的植物在较高的加工温度下,生物活性化合物含量大幅下降[31],因此研究温度对花色苷稳定性的影响对实际应用有重要意义。如图10所示,花色苷保存率与温度成反比。60~80 ℃时,下降速度比较缓慢,说明紫马铃薯花色苷在高温下具有较好的稳定性。当温度达到90 ℃时,紫马铃薯花色苷的保存率显著降低。因此,在加工运输和贮藏过程中应尽量避免90 ℃以上的高温,在冷藏或室温条件下保存最佳。
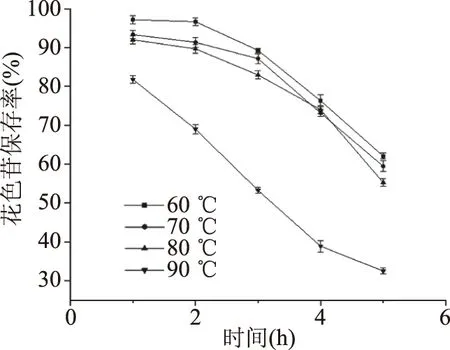
图10 温度对紫马铃薯花色苷稳定性的影响Fig.10 Effect of temperature on the stability of PPA
2.3.4 金属离子对紫马铃薯花色苷稳定性的影响 金属离子和黄烊盐类之间形成的螯合物赋予了鲜花颜多样的颜色[32]。因此,如果某些金属离子是饮食中必需的矿物质之一且和花色苷的相互作用是稳定的,那么两者就可以应用在同一食品中。如图11所示,紫马铃薯花色苷在含有Mg2+、K+、Na+、Zn2+、Ca2+离子的溶液中状态稳定。在含有Al3+的溶液中,保存率有所增加,说明Al3+对其有增色作用,这是因为Al3+与花色苷进行络合后可以避免其氧化来稳定蓝色醌型碱[33]。而在含有Cu2+的溶液中产生沉淀。因此,在加工运输和贮藏过程中,可适当添加Mg2+、K+、Na+、Zn2+、Ca2+离子,应避免与Cu2+离子接触。
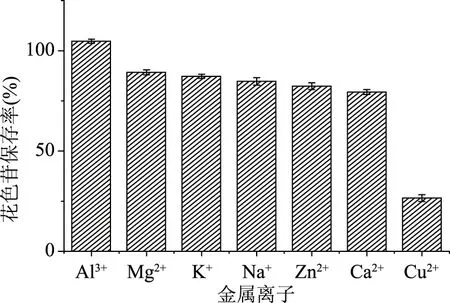
图11 金属离子对紫马铃薯花色苷稳定性的影响Fig.11 Effect of metal ions on the stability of PPA
3 结论
本文以新鲜紫马铃薯为原料,优化了紫马铃薯花色苷的提取工艺,确定了紫马铃薯花色苷的分离纯化工艺并对其稳定性进行了研究。最佳纯化条件为:AB-8型大孔吸附树脂,上样量9 BV,采用6 BV 60%乙醇溶液洗脱,上样和洗脱速度均为2.0 mL/min,纯化后的提取液浓度为(6.43±0.37)mg/mL。稳定性研究结果表明:紫马铃薯花色苷在光照条件下稳定性较差,受短波紫外线影响大,避光条件下较稳定,因此在贮存或使用过程中应避免长时间暴露在光线中;具有较好的热稳定性,但是在90 ℃以上的高温下易分解,因此应尽量避免90 ℃以上的高温,在冷藏或室温条件下保存最佳;在含有Al3+、Mg2+、K+、Na+、Zn2+、Ca2+离子的溶液中状态稳定,可以在应用时适当添加,在含有Cu2+的溶液中产生沉淀,应用中应避免与Cu2+接触;在酸性环境下有很强的稳定性,碱性环境下易分解,应尽量避免在碱性环境中使用。在后续的试验研究中,可以尝试对紫色马铃薯花色苷的具体组成和各组分含量进行分析,进一步确定其主要成分,还可对其在生物体内的利用度进行研究,为紫色马铃薯花色苷的工业化生产奠定良好的理论和实践基础。

