肺炎克雷伯菌对H2O2氧化胁迫的响应机制研究
邱雪梅,徐 丽,骆海龙,袁 杰,杨 靖,李 蓓,汪静杰,3,*
(1.湖北医药学院基础医学院,湖北十堰 442000; 2.湖北医药学院生物医药研究院,湖北十堰 442000; 3.武当特色中药研究湖北省重点实验室,湖北十堰 442000)
肺炎克雷伯菌为革兰氏阴性细菌、细杆菌,可寄居于动物呼吸道及人肠道内成为条件致病菌;是引起社区获得性感染与医院内感染的重要病原菌,严重威胁着人类的健康[1-2]。肺炎克雷伯菌可通过食品尤其是肉类食品经由肠道进入机体引起感染[3];所致感染包括肺炎、尿道炎等常见疾病,还可造成眼内炎、高血糖、脑炎等并发症疾病[4-5]。
目前已有研究报道从家畜体内,及零售肉类、海产品、蔬菜中分离出肺炎克雷伯菌[6-10]。经污染食品或吸入等途径进入机体的肺炎克雷伯菌,在胃肠道内会面临一些对细菌具有抑制作用的肠道因子,如氧化刺激、高渗环境、胆汁酸盐、低pH等的胁迫作用[11-14]。其中氧化因子是肠道抵御外来细菌的重要因素,可造成细菌的氧化损伤,破坏细胞壁、蛋白质、DNA等,干扰细胞代谢途径,从而发挥抑制细菌作用;在氧化胁迫下,细菌可依靠多种方式与机制应对胁迫,包括抗氧化酶系统、调整代谢途径、激活相关生物表型等途径[15-19]。然而关于肺炎克雷伯菌与氧化因子互作的研究鲜有报道,其应对氧化胁迫的机制尚不明确。
本研究选用不同浓度H2O2处理肺炎克雷伯菌,进行体外模拟肠道氧化因子实验,探究H2O2处理条件下细菌的生长速率及主要毒力因子表型荚膜、生物膜的变化,并通过qRT-PCR检测分析毒力表型相关基因的表达水平。本研究内容旨在为揭示肺炎克雷伯菌响应机体肠道氧化条件胁迫的机制奠定理论依据;并为食品污染途径的肺炎克雷伯菌的感染性疾病防控提供新思路。
1 材料与方法
1.1 材料与仪器
实验菌株为肺炎克雷伯菌NTUH-K2044株,是引起肝脓肿的代表菌株 由军事医学科学院微生物流行病研究所馈赠,保存于湖北医药学院病原生物学研究室;蛋白胨、酵母粉、氯化钠、琼脂 OXOID公司;LB(Luria-Bertani)固体培养基 由10 g/L蛋白胨、5 g/L 酵母粉、2.5 g/L氯化钠、5 g/L琼脂配制而成;二甲基亚枫(DMSO) Amresco公司;结晶紫 Sigma公司;30%过氧化氢(H2O2) 索莱宝生物公司;RNA提取试剂盒 Omega公司;逆转录试剂盒 Thermo Fisher Scientific公司;荧光定量PCR检测试剂盒 Bio-Rad公司;基因表达检测的引物 上海生工生物公司。
5424R高速离心机 德国Eppendorf公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;THZ-82B型恒温摇床 常州国旺仪器设备有限公司;BioSpectrometer Kinetic紫外分光光度计 德国Eppendorf公司;恒温培养箱 上海新苗医疗器械制造有限公司;CFX96荧光定量PCR仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 细菌培养 首先从-80 ℃超低温冰箱中取出低温冻存的肺炎克雷伯菌NTUH-K2044野生型菌株,37 ℃条件下均匀解冻、融化,并用接种环取适量融化的菌液划线接种到LB固体培养基平板上进行菌种活化。然后从活化培养基平板上分别挑取单菌落转接至含有氨苄青霉素(50 μg/mL)的新鲜LB液体培养基与固体培养基平板,37 ℃条件下培养备用。
1.2.2 氧化胁迫条件下细菌生长速率测定 以过氧化氢(H2O2)体外模拟肠道氧化条件,并检测该胁迫下肺炎克雷伯菌的生长速率。分别配制含0.195、0.39、0.78、1.56 mmol/L浓度梯度H2O2的LB液体培养基,然后将活化培养的肺炎克雷伯菌菌液OD600调至1.2后作为菌悬液母液。取适量母液按1∶100比例接种至分别装有100 mL含4种不同浓度H2O2的LB液体培养基三角烧瓶中,并以接种菌液至未添加H2O2的液体培养基为对照组。已接种菌液的各液体培养基分别放入摇床,37 ℃,180 r/min条件下振荡培养。在1、2、3、4、5、6、7、8、9 h时间点分别检测菌液的OD600值,记录数据并绘制细菌的生长曲线。
1.2.3 荚膜生成能力分析 利用液体培养离心实验法检测氧化因子处理条件下荚膜的生成能力[20]。首先将肺炎克雷伯菌划线接种至固体培养基上培养,然后取少许菌落液体培养过夜,并分别取50 μL活化的菌液接种至含不同浓度梯度(0.195、0.39、0.78 mmol/L)H2O2与未添加H2O2的5 mL LB液体培养基中培养12 h 后,各取1 mL菌液在8000 r/min条件下离心10 min后,观察细菌在离心管管底的沉淀程度,以分析肺炎克雷伯菌的荚膜生成量变化。
1.2.4 生物膜形成能力检测 将过夜活化培养的肺炎克雷伯菌株以1∶100的比例分别转接于含有0.195、0.39、0.78 mmol/L浓度H2O2的LB液体培养基小试管中,每种浓度梯度设置3个重复,未添加H2O2的培养基为对照。参考文献[21]的方法并适度调整,室温静置连续培养48 h后检测菌株在试管中形成生物膜的情况;首先从生物膜中间轻轻吸取菌液至另一灭菌的小试管中,检测各处理组菌株的OD600值。在含生物膜的原试管中用灭菌水润洗去游离细菌,加入0.1%结晶紫染液室温下静置染色30 min。然后弃去染色液并用灭菌水润洗至少3次,每管加入4 mL DMSO溶液溶解试管壁上的结晶紫,检测DMSO混匀溶解液的OD570值,每样品重复3次。并按100×OD570/OD600计算方法计算各实验组菌株的生物膜相对形成量。

表1 定量PCR检测靶基因所用引物Table 1 Primers used for target genes of qRT-PCR examination
1.2.5 qRT-PCR实时荧光定量分析 结合氧化胁迫条件下肺炎克雷伯菌荚膜与生物形成能力表型检测结果,并分析相关基因的表达量。将活化的肺炎克雷伯菌分别接种在含低浓度(0.195、0.39 mmol/L)H2O2与未添加H2O2的液体培养基中,37 ℃培养12 h后各取3 mL 菌液分别提取RNA。按cDNA逆转录试剂盒说明书的操作步骤,以各处理组RNA为模板反转录出第一链cDNA保存于-80 ℃备用。同时选取肺炎克雷伯菌荚膜、生物膜形成相关的8个基因为检测基因,16S rRNA作内参基因;各基因引物见表1。分别从不同处理组取适量cDNA为模板进行qPCR检测,反应条件为:95 ℃,预变性3 min;95 ℃ 变性10 s,58 ℃退火30 s,65 ℃ 延伸5 s,39个循环,95 ℃ 0.5 s,绘制溶解曲线。3次实验重复,按2-ΔΔCt法分析基因表达量数据。
1.3 数据处理
2 结果与分析
2.1 氧化胁迫对肺炎克雷伯菌生长的影响
如图1所示,肺炎克雷伯菌在4个不同浓度梯度H2O2条件下培养时,随着氧化因子浓度升高,肺炎克雷伯菌生长受到影响越明显;表现出浓度依赖的抑制效果。在0.195、0.39 mmol/L较低浓度处理时,分别在3、4 h时间点前细菌生长相较于对照组生长受到抑制,而在4 h时间点之后,低浓度的氧化因子胁迫条件对细菌生长无明显的影响。当氧化因子浓度达到0.78、1.56 mmol/L时,细菌生长受到明显抑制作用;除对细菌而言的极端浓度氧化因子(1.56 mmol/L)外,其他浓度处理下,细菌生长在8 h时间点后各处理组间无明显差异。这些结果说明:在非极端浓度氧化因子胁迫下,肺炎克雷伯菌早期生长过程受到抑制作用,而在中后期对细菌的生长无明显影响;暗示肺炎克雷伯菌可能通过相关调控方式响应胁迫而逐渐适应该不利环境。
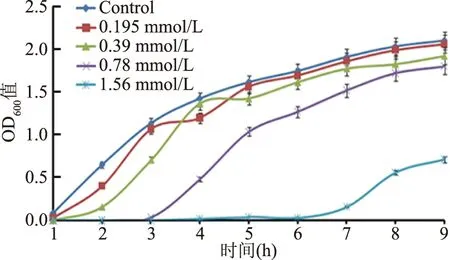
图1 肺炎克雷伯菌氧化胁迫处理下的生长曲线Fig.1 Growth curve of Klebsiellapneumoniae under oxidative stress
2.2 肺炎克雷伯菌氧化因子胁迫下荚膜生成能力变化
体外氧化因子H2O2处理对肺炎克雷伯菌的生长表现出一定的抑菌效果,并可进一步地研究肺炎克雷伯菌毒力表型与响应氧化胁迫间的关联。因高浓度氧化因子(1.56 mmol/L)处理下肺炎克雷伯菌的生长受到显著抑制,不利于后续的表型分析;故本研究通过高速离心实验分析了3个不同浓度(0.195、0.39、0.78 mmol/L)氧化因子H2O2胁迫对肺炎克雷伯菌主要毒力因子之一荚膜生成量的实验。如图2所示,在所选不同浓度H2O2胁迫处理作用下,与对照组相比,随着H2O2处理浓度升高,高速离心时各处理组的肺炎克雷伯菌越易在管底沉淀聚集,表明荚膜的生成量降低,不易粘稠、在管底上方形成云雾状;说明氧化胁迫条件能够减弱肺炎克雷伯菌荚膜的生成能力,也表现出浓度剂量相关性。

图4 氧化胁迫对肺炎克雷伯菌荚膜、生物膜相关基因表达量的影响Fig.4 Effect of oxidative stress on the expression of capsule and biofilm related genes in Klebsiella pneumoniae

图2 不同浓度氧化胁迫对肺炎克雷伯菌荚膜生成量的影响Fig.2 Effects of oxidative stress at different concentrationson capsule production of Klebsiella pneumoniae
2.3 氧化胁迫对生物膜形成能力的影响
肺炎克雷伯菌生物膜的形成与其致病性密切相关,生物膜是其重要的毒力因子[22-23]。本研究通过结晶紫染色方法定量检测肺炎克雷伯菌的生物膜形成量,图3所示的染色实验结果表明相对于对照组,在0.195、0.39 mmol/L 低浓度的H2O2处理组中肺炎克雷伯菌的生物膜形成量均增加;在0.78 mmol/L高浓度 H2O2处理胁迫下肺炎克雷伯菌生物膜生成量增加最明显。结合不同浓度梯度氧化因子对肺炎克雷伯菌生长影响的实验结果,说明在非极端浓度的氧化因子胁迫下,肺炎克雷伯菌通过调控其重要毒力因子生物膜表型以响应该胁迫环境。
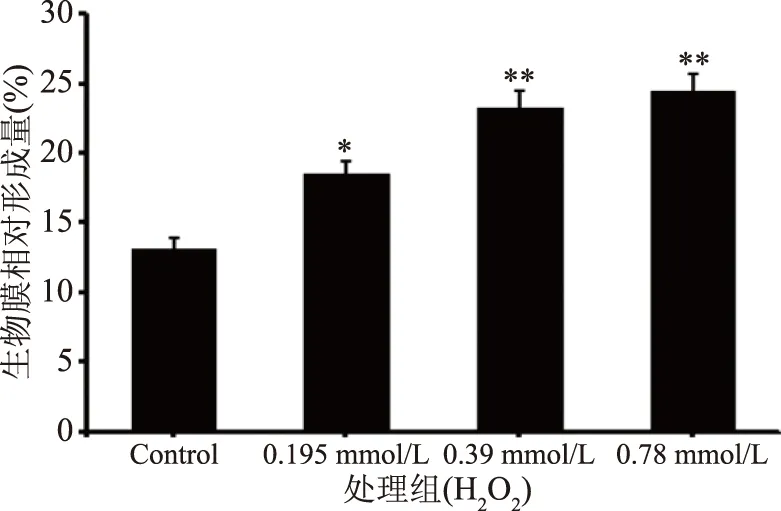
图3 肺炎克雷伯菌氧化胁迫下生物膜形成量的变化Fig.3 Changes of biofilm formation underoxidative stress of Klebsiella pneumoniae注:* 表示处理组与对照组相比,具有显著差异性(P<0.05);**表示处理组与对照组相比,具有极显著差异性(P<0.01),图4同。
2.4 响应氧化胁迫的相关基因表达量变化
为了进一步探究氧化条件下肺炎克雷伯菌的毒力表型相关基因的表达情况。本研究选取了8个荚膜与生物膜形成相关基因bsmpA、bssS、rcsA、LuxR、magA、rmpA、YbaJ、YmgB,其中rmpA、rcsA、magA为荚膜生成相关的基因,其他为生物膜形成相关的基因。结合表型实验结果,0.195、0.39 mmol/L两个浓度H2O2处理组反映了肺炎克雷伯菌荚膜与生物膜表型的典型变化特征,并进一步地利用荧光定量PCR方法检测各靶基因在这2个浓度H2O2氧化胁迫下的表达量;结果显示(图4):在氧化因子H2O2处理条件下,相对于对照组,bsmpA、bssS、LuxR、magA、rmpA、YmgB基因的表达量降低;YbaJ基因相对于对照组均表现出表达量升高,rcsA基因在0.39 mmol/L浓度作用下表达量上调。结合氧化因子影响肺炎克雷伯菌表型实验结果,H2O2抑制荚膜的产生,可能与影响荚膜结构基因magA表达量有关。生物信息分析显示YbaJ基因为生物膜形成调控子,推测该基因表达量的升高而促进肺炎克雷伯菌生物膜形成量增加。说明肺炎克雷伯菌通过调控YbaJ基因的上调表达,促进生物膜的形成,以此响应氧化胁迫。
3 讨论
肺炎克雷伯菌可通过污染食物经胃肠道途径进入人体,此途径会经历胃肠道一系列肠道环境因子的刺激。其中氧化因子是抑制外来微生物的主要因素之一,本研究通过体外实验以H2O2模拟肠道氧化条件进行体外实验检测对肺炎克雷伯菌的生长、表型特征以及毒力基因表达的影响。这些问题的揭示可为细菌与宿主互作、细菌致病机制提供基础数据。
为了分析肺炎克雷伯菌在宿主肠道的氧化条件胁迫时,其生长与相关表型的变化,本研究首先体外模拟分析肺炎克雷伯菌在氧化因子处理下生长,实验结果表明细菌生长的早期阶段受到较明显的抑制。氧化因子H2O2作为一种强氧化剂,即使低浓度也可对包括细菌在内微生物细胞壁具有较强的破坏作用[14,24],故能对肺炎克雷伯菌的生长表现出抑制作用,而在生长后期与对照组相比无明显差异,该结果暗示肺炎克雷伯菌作为肠道途径感染为主的病原菌,在宿主的氧化环境下可能利用某种调控机制参与响应胁迫,最终以适应该不利条件。
当细菌进入宿主体内,面临不利于自身生长、定植等肠道因子时会启动相关基因的表达,可通过调控特定的表型特征变化以应激该不利环境条件,如霍乱弧菌、弯曲杆菌、沙门氏菌等可以通过增加荚膜、生物膜形成量去应激胁迫环境[25-28]。文献报道肺炎克雷伯菌的毒力因子主要包括荚膜、生物膜、菌毛等[29-32]。本文中体外氧化因子H2O2处理条件下肺炎克雷伯菌的荚膜产生量明显降低,说明该因子作用下能够下调荚膜调控或合成相关基因的表达。文献报道,肺炎克雷伯菌的magA为结构基因,是合成荚膜的关键基因[33];qRT-PCR实时定量结果显示在氧化因子H2O2作用下,magA基因表达量发生了明显的下调,可知氧化因子通过影响肺炎克雷伯菌荚膜结构基因magA的下调表达从而降低其荚膜的产生量。转录调控子rmpA、rcsA可参与调控促进肺炎克雷伯菌荚膜的生成[34-35],本研究中在0.195 mmol/L浓度H2O2处理时,rmpA、rcsA基因的表达受到极显著抑制(P<0.01)。同时在0.39 mmol/L浓度组的表达量高于0.195 mmol/L浓度组,暗示可能与转录调控子rmpA、rcsA感应氧化浓度有关;但0.39 mmol/L浓度对肺炎克雷伯菌的氧化损伤与破坏能力更强,抑制破坏荚膜结构的作用更明显;故总体上仍表现出剂量相关性。
肺炎克雷伯菌在生长过程中能形成生物膜,生物膜作为其重要毒力表型,对其致病性与耐药性具有明显的促进作用;本文中生物膜定量检测结果显示在低浓度的H2O2胁迫作用下,肺炎克雷伯菌的生物膜形成量反而增加;这一结果表明肺炎克雷伯菌可能通过提高生物膜形成量以响应氧化因子的胁迫。且进一步的qRT-PCR结果可知肺炎克雷伯菌在该胁迫条件处理时会上调表达生物膜形成相关基因YbaJ的表达,控制生物膜的形成。此外生物膜形成相关基因bsmpA、bssS、LuxR、YmgB在氧化胁迫下表达量均下调,暗示这4个基因可能不参与响应氧化胁迫促进肺炎克雷伯菌生物膜的形成;0.39 mmol/L浓度组的基因表达量高于0.195 mmol/L浓度组,推测可能与其多重生物功能有关,在氧化胁迫时不发挥主效作用。生物膜作为肺炎克雷伯菌的重要毒力因素,其形成能力提高可能是该菌响应氧化胁迫的重要调控机制。
4 结论
综上所述,肺炎克雷伯菌在氧化因子胁迫处理的生长速率实验显示该菌会响应该胁迫而逐渐适应该环境,早期生长变缓而至平稳期细菌的生长不受影响。但氧化胁迫对肺炎克雷伯菌的主要毒力表型特征有明显的影响,表现为降低毒力因子荚膜的生成量,但增加生物膜的形成量。毒力相关基因表达的结果从分子层面验证了表型实验结果,也暗示肺炎克雷伯菌通过调控生物膜的形成相关基因的表达,从而控制该毒力表型以响应氧化胁迫。本研究的结果能够为肺炎克雷伯菌与宿主肠道因子互作及致病机制提供新思路,同时也为食源性肺炎克雷菌感染性疾病的防控提供新靶点。

