欧当归内酯A对实验性纤维化肝脏NO及内皮细胞功能的影响
赵志敏 黄恺 沈丽 刘成海 叶伟成
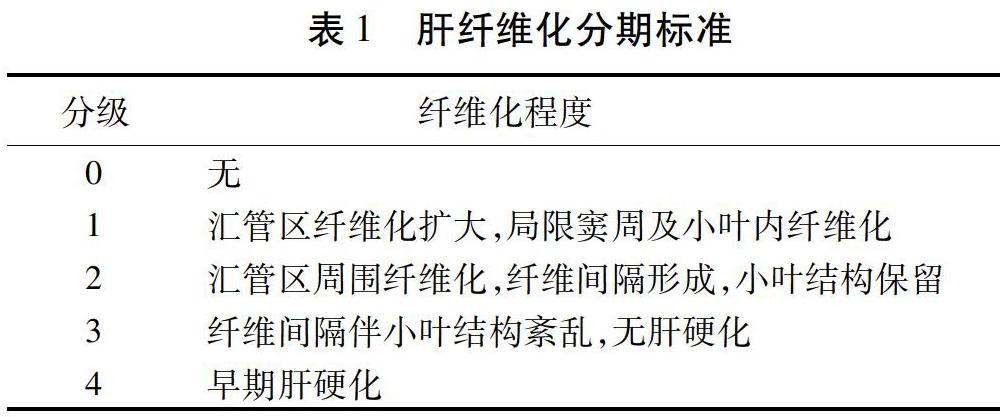
摘要 目的:探讨欧当归内酯A调节纤维化肝脏NO释放的抗肝纤维化作用机制。方法:40只Wistar大鼠随机分为正常组、模型组、欧当归内酯A 3 mg/kg组、欧当归内酯A 6 mg/kg组,每组10只。以四氯化碳(CCl4)与高脂低蛋白饮食复合因素诱导肝纤维化模型,连续6周。药物观察组于造模第4周腹腔注射给药至结束。观察肝组织炎性反应及胶原沉积、eNOS表达及MDA、SOD、NO、NOS水平。体外以800 μmol/L氯化钴作用于SK-HEP-1细胞24 h诱导细胞缺氧损伤,药物处理后观察细胞活力、vWF表达、上清及胞内NO水平。结果:与模型组比较,欧当归内酯A各组肝细胞变性和炎性反应坏死有所减轻,纤维化改善;高剂量组SOD和MDA显著改善,NO和NOS降低,eNOS阳性表达下降(P<0.05)。体外实验显示,药物干预后细胞活力得到改善,vWF平均荧光强度减弱,NO释放显著改善(P<0.05)。结论:欧当归内酯A具有抗肝纤维化的作用,其机制可能与抗脂质过氧化损伤,改善内皮细胞功能,调节NO释放有关。
关键词 肝纤维化;欧当归内酯A;内皮细胞;一氧化氮;机制
Abstract Objective:To explore the effects of levistilide A on anti-hepatic fibrosis mechanism of regulating the release of NO from fibrotic liver. Methods:A total of 40 Wistar rats were randomly divided a control group, a model group, a levistilide A 3 mg/kg group and a levistilide 6 mg/kg group, with 10 rats in each group. The liver fibrosis model was induced by a combination of carbon tetrachloride (CCl4) and a high-fat and low-protein diet for 6 consecutive weeks. The drug treatment group was given intraperitoneal injection to the end on the 4th week of modeling. Liver tissue inflammatory reaction and collagen deposition, eNOS expression and MDA, SOD, NO, NOS levels were observed. In vitro, 800 μmol/L cobalt chloride was applied to SK-HEP-1 cells for 24 h to induce cell hypoxia. After drug treatment, cell viability, vWF expression, supernatant and intracellular NO levels were observed. Results:Compared with those in the model group, the degeneration and inflammatory necrosis of Levistilide A in each group were reduced, and the fibrosis was improved; the high-dose group SOD and MDA significantly improved, NO and NOS decreased, and the positive expression of eNOS decreased (P<0.05). In vitro experiments showed that cell viability was improved after drug intervention, the average fluorescence intensity of vWF was weakened, and the release of NO was significantly improved (P<0.05). Conclusion:Levistilide A can inhibit liver fibrosis, the mechanism may be related to Levistilide A, anti-lipid peroxidation, and regulate the release of NO.
Keywords Liver fibrosis; Levistilide A; Endothelial cell; Nitric oxide; Mechanism
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.19.004
肝纤维化存在于大多数慢性肝脏疾病过程中,肝组织内细胞外基质过度增生与沉积导致肝脏组织结构异常改变,并影响肝脏正常生理功能,是慢性肝病过程中一种可逆的肝组织损伤过度修复反应[1]。血管病理改变与纤维化的进展和消退密切相关。内皮细胞损伤、毛细血管化是纤维化发生的早期事件和原因之一。研究表明,NO通路与血管损伤、活化、增殖、功能紊乱等相关且影响纤维化逆转[2]。欧当归内酯A具有抗肝纤维化作用,可改善肝窦毛细血管化,但对内皮细胞损伤及功能的作用尚不清楚,本研究通过体内、体外实验,进一步研究欧当归内酯A调節纤维化肝脏NO释放的抗肝纤维化作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar大鼠,雄性40只,清洁级,体质量(145±15)g。由中国科学院上海实验动物中心提供(许可证号:2008001615261,伦理审批号:PZSHUTCM18113012),饲养于上海中医药大学动物实验中心,温度18~22 ℃,湿度55%~65%,以12/12 h为光暗周期饲养。
1.1.2 细胞 人内皮细胞(SK-HEP-1购自ATCC)为人内皮来源的腹水瘤细胞,具备肝窦内皮的某些特性[3],常规培养于含10%胎牛血清的MEM培养液,5% CO2及饱和湿度的37 ℃恒温培养箱中,细胞隔天换液,每2~3 d传代1次。
1.1.3 药物 欧当归内酯A,购自上海融禾医药科技发展有限公司,批号:161024,纯度:>98%。
1.1.4 试剂与仪器 CCl4(国药集团化学试剂有限公司,货号:10006480)、橄榄油溶液(国药集团化学试剂有限公司,货号:69018028)、甲醛溶液(国药化学试剂公司,货号:10010018)、二甲苯(国药集团化学试剂有限公司,货号:10023418)。六水合氯化钴(CoCl2·6H2O,Sigma公司,美国,货号:C8661)、甲瓒(MTT)(Sigma公司,美国,货号:M5655)。MEM干粉(GIBCOTM公司,美国,货号:1543170)、胎牛血清(Bovogen公司,澳大利亚,货号:1710B);DMSO(Amresco公司,美国,货号:0231);4%多聚甲醛(北京鼎国生物技术公司,货号:AR-0211);NO荧光探针、细胞核染色液(DAPI)、抗兔FITC荧光二抗(碧云天生物技术研究所,货号:S0019、C1002、P0186)。兔来源血管血友病因子(Von Willebrand Factor,vWF)抗体(Abcam公司,美国,货号:ab6994)、内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)抗体(Abcam公司,美国,货号:ab76198)。移液器(Eppendorf公司,德国,型号:Research plus);超纯水系统(Millipore公司,美国,型号:Direct-Q3);转移脱色摇床(海门其林贝尔仪器制造有限公司,型号:TS-8);高温高压灭菌消毒锅(HIRAYAMA公司,日本,型号:HVE-50);生物安全柜(青岛海尔特种电器有限公司,型号:HR50-IIA2);微孔板分光光度计(BioTek公司,美国,型号:MQX200R);倒置显微镜(Olympus公司,日本,型号:IX70);CO2培养箱(Eppendorf公司,德国,型号:Galaxy 170S)、高内涵筛选分析仪(Thermo Scientific有限公司,美国,型号:ArrayScan VTI)。
1.2 方法
1.2.1 分组给药与动物模型制备 40只大鼠随机分为4组:正常组、模型组、欧当归内酯A低剂量组、欧当归内酯A高剂量组,每组10只。除正常组外,其他各组大鼠均在无菌条件下由皮下注射CCl4,首次剂量为100%CCl4溶液0.5 mL/kg大鼠体质量,后40%CCl4橄榄油溶液(40%CCl4+60%橄榄油)3 mL/kg大鼠体质量,2次/周,连续注射9周。药物观察组于造模后第5周开始分别给予欧当归内酯A高剂量6 mg/(kg·d)、欧当归内酯A低剂量3 mg/(kg·d)腹腔注射。
1.2.2 取材 实验结束,于肝组织最大叶切割组织块3块,0.5 cm×0.5 cm×0.3 cm大小,其中2块放入包埋框,4%甲醛溶液固定,脱水、包埋成石蜡组织块,使用4 μm切片;其余肝组织分装,-80 ℃保存。肝组织二甲苯、多级乙醇脱蜡至水,进行HE、天狼猩红和eNOS免疫组化染色。OlympusBX40显微镜下100倍、200倍观察。Image-pro Express6.3软件摄片,并对天狼猩红染色片进行半定量分析。
1.2.3 肝组织丙二醛(Malondialdehyde,MDA)含量、超氧化物歧化酶(Superoxide Dismutase,SOD)活性、一氧化氮(Nitric Oxide,NO)含量和一氧化氮合酶(Nitric Oxide Synthase,NOS)活性 肝组织MDA含量采用TBA法测定;SOD活性采用羟胺法测定;肝组织NO含量,采用硝酸还原酶法测定;肝组织NOS活性采用比色法测定。
1.2.4 细胞模型制备及药物添加 1)细胞模型制备:每孔8 000个细胞接种于96孔板,待细胞密度为70%左右,加入含氯化钴的培养液(氯化钴终浓度800 μmol/L),每孔100 μL,设空白对照(0.5%FBS)组,孵育24 h。药物在80 μmol/L范围内设6个浓度梯度确定对SK-HEP-1细胞的最大无毒范围(与不加药组比存活率>90%),根据最大无毒浓度再分设3个浓度梯度分别作用于细胞模型。各药物与细胞共孵育24 h同时添加氯化钴溶液。2)MTT法检测:细胞接种于96孔板,长至亚单层,棄原培养液,换为各药物成分培养液,100 μL/孔,4~6个复孔,孵育24 h。弃药物培养液,加入0.5 mg/mL MTT工作液,孵育4 h。可见蓝紫色结晶,小心吸弃工作液,加入DMSO 100 μL/孔,至充分溶解,在微孔板扫描分光光度计上测定吸光度OD490。
1.2.5 免疫荧光法 药物孵育结束后,弃培养液,每孔加入50 μL 4%多聚甲醛室温固定15 min,PBS洗涤,以0.5% Triton X-100孵育10 min,5%BSA/PBS 37 ℃封闭30 min后加入一抗(抗vWF抗体1∶100,稀释在3%BSA/PBS中)37 ℃孵育1 h,PBS洗涤后,加入荧光二抗(1∶100,稀释在3%BSA/PBS中)37 ℃孵育1 h,PBS洗涤后,滴加DAPI染核5 min,PBS洗涤,Cellomics ArrayScan VTI HCS Reader采集图像,Cellomics Cell Health Profiling BioApplication Software对图像进行分析。
1.2.6 荧光探针法 细胞接种于96孔板,长至亚单层,弃原培养液,换为各药物成分培养液,100 μL/孔,4个复孔,孵育24 h。弃药物培养液,原位装载NO探针,100 μL/孔。37 ℃细胞培养箱内孵育20~40 min。PBS洗3次。使用495 nm激发波长,515 nm发射波长,Thermo scientific varioskan flash光谱扫描多功能读数仪上检测。
1.2.7 Griess法 收集细胞培养液上清,96孔板每空加50 μL,在各孔中加入50 μL室温Griess Reagent I,然后各孔中加入50 μL Griess Reagent II,酶标仪540 nm波长测定吸光度。
1.3 统计学方法 采用SPSS 12.0统计软件包进行统计学分析。计量资料均数±标准差用(±s)表示。组间比较使用单因素方差分析。纤维化等级资料采用Ridit分析,免疫组化半定量分析采用image-pro plus 6.1图像分析软件。以P<0.05为差异有统计学意义。
2 结果
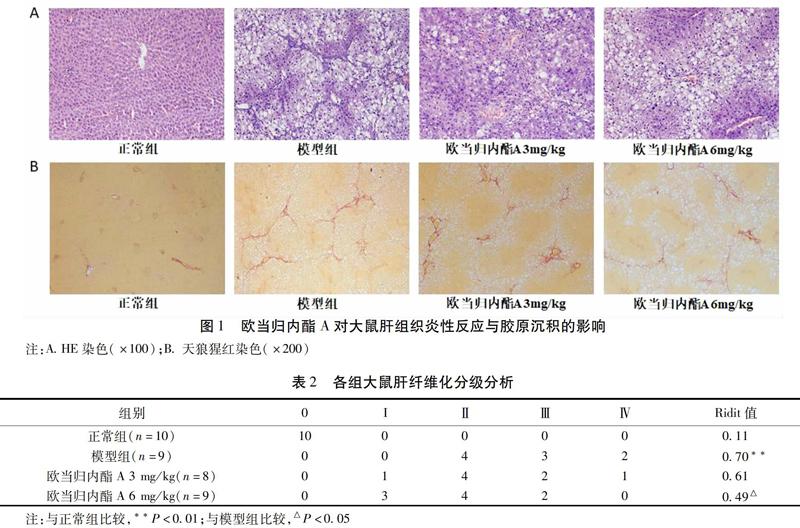
2.1 欧当归内酯A对大鼠肝组织炎性反应与胶原沉积的影响 HE染色可见正常组肝小叶与肝细胞排列整齐,结构完整;模型大鼠肝组织可见肝细胞肿大变圆,脂肪空泡变性明显,肝细胞散在坏死,成纤维细胞大量增生,汇管区及纤维间隔内可见大量炎性细胞浸润。与模型组比较,欧当归内酯A低剂量与高剂量组肝细胞变性和炎性反应坏死有所减轻。
天狼猩红染色可见正常组大鼠肝小叶结构清晰,仅在汇管区有极少量胶原沉积;模型组可见大量胶原纤维沉积,部分形成纤维间隔,严重者偶可见假小叶形成;与模型组比较,欧当归内酯A低剂量和高剂量组胶原沉积减少,高剂量组肝纤维化分级评分比较,差异有统计学意义(P<0.05)。见图1,表2。
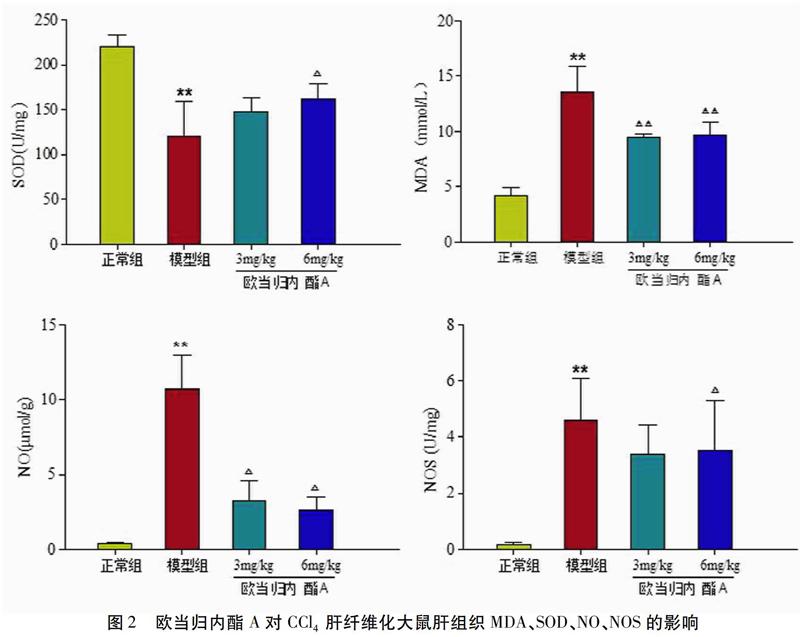
2.2 欧当归内酯A对CCl4肝纤维化大鼠肝组织MDA、SOD、NO、NOS的影响 与正常组比较,模型组SOD显著降低,MDA显著增高(P<0.01);与模型组比较,欧当归内酯A低剂量组MDA显著降低(P<0.01),高剂量组SOD和MDA均显著改善(P<0.05或P<0.01)。与正常组比较,模型组NO、NOS显著升高(P<0.01);与模型组比较,欧当归内酯A低剂量组NO显著降低(P<0.05),高剂量组NO和NOS均显著降低(P<0.05)。见图2。
2.3 欧当归内酯A对CCl4肝纤维化大鼠肝组织eNOS表达的影响 肝组织免疫组织化学染色及半定量分析显示,与正常组比较,模型组肝组织eNOS光密度显著升高(P<0.01);与模型组比较,欧当归内酯A高剂量组eNOS光密度显著降低(P<0.05)。见图3。
2.4 欧当归内酯A对SK-HEP-1细胞毒性及缺氧损伤模型细胞活力的影响 欧当归内酯A设6个浓度:0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L,药物作用24 h,根据MTT结果,选择与对照组比较无显著性差异,且存活率>90%的浓度为最大无毒浓度,欧当归内酯A对SK-HEP-1细胞最大无毒浓度为10 μmol/L。在最大无毒范围内设3个浓度梯度组用于缺氧损伤的细胞,同时设正常和模型对照组,MTT结果显示,欧当归内酯A在2.5 μmol/L、5 μmol/L、10 μmol/L时对SK-HEP-1细胞氯化钴损伤模型细胞活力均有保护作用。图4。
2.5 欧当归内酯A对SK-HEP-1缺氧损伤模型细胞vWF表达的影响 vWF免疫荧光染色显示,与正常组比较,模型组荧光强度显著升高(P<0.01);与模型组比较,欧当归内酯A(2.5 μmol/L、5 μmol/L、10 μmol/L)对vWF荧光强度有不同程度的降低(P<0.01)。见图5。
2.6 欧当归内酯A对SK-HEP-1缺氧损伤模型细胞NO水平的影响 Griess法检测细胞上清NO结果显示,与正常组比较,模型组上清NO水平明显升高(P<0.01);与模型组比较,欧当归内酯A能够显著降低氯化钴损伤模型SK-HEP-1细胞上清NO(P<0.05或P<0.01)。荧光探针法检测胞内NO显示,与对照组比较,模型组NO表达明显降低(P<0.05);与模型组比较,欧当归内酯A 10 μmol/L组NO表达明显升高(P<0.01)。见图6。
3 讨论
慢性肝病过程中血管生成和血管活性物质(NO等)的表达改变、内皮功能障碍、神经激素失调和全身炎性反应状态在调节肝硬化体內病理失衡和异常血管生成反应方面发挥着不同的作用[4]。慢性肝损伤可导致肝窦内皮功能障碍,内皮细胞损伤、毛细血管化是纤维化发生的早期事件和原因之一。肝窦内皮细胞存在于肝窦内壁,具有独特的窗孔结构[5],有利于促进肝细胞氧代谢,增强肝细胞与外界的物质交换;缺氧可使肝窦内皮细胞损伤发生表型改变[6],vWF表达增加,窗孔结构破坏或消失,同时细胞功能障碍,NO等合成释放改变;任其发展将进一步加重肝脏疾病如纤维化并形成难以逆转的血管病理。欧当归内酯A来源于中药当归、川芎等,研究报道其具有抑制肝星状细胞增殖作用[7],我们前期研究发现,欧当归内酯A可显著改善CCl4诱导的大鼠肝组织纤维化程度,抑制TGF-β1诱导的LX-2细胞活化;抑制肝窦毛细血管化,抑制ECGs诱导的肝窦内皮细胞增殖等作用[8]。本研究在此基础上,通过体内外研究进一步探讨欧当归内酯A调节纤维化肝脏NO释放的抗肝纤维化作用机制,动物实验结果显示欧当归内酯A可有效抑制CCl4诱导的大鼠肝纤维化,与前期结果一致。
脂质过氧化是指在自由基的攻击下,不饱和脂肪酸发生过氧化反应,从而生成一系列活性氧的复杂过程[9],可造成器官、组织、细胞损伤。MDA是脂质过氧化的终产物之一,其含量可反映组织中脂质过氧化程度。SOD是机体清除自由基的主要酶,SOD活性高低反映肝组织清除自由基的能力[10]。本研究使用的CCl4诱导的肝纤维化动物模型具有脂质过氧化损伤特点[11],模型组MDA显著升高,SOD显著下降,欧当归内酯A可以升高SOD水平,对脂质过氧化损伤具有调节作用。
内皮细胞损伤时细胞功能变化主要体现在NO的合成释放,vWF是细胞损伤的主要标志物。NO具有神经递质,信使等功能,既是一种强大的血管扩张剂和细胞保护因子,也是细胞毒作用介导物;NOS是调节NO生物合成的重要因素。文献报道,肝损伤可引起血清及肝组织中NO显著升高,引起毒性作用,如抑制线粒体有氧呼吸、抑制肝细胞蛋白合成以及生成具有肝细胞毒性的过氧化亚硝酸盐离子介导免疫性肝损伤。NO还可增加肝脏的血流量从而降低肝脏有氧代谢,从而发挥一定的保护作用[12]。CCl4诱导的急性或慢性肝纤维化动物模型中可观察到血清NO及肝组织NOS活性明显升高[13-14]。我们研究结果显示,模型鼠肝组织NO和NOS显著升高,欧当归内酯A可显著降低NO水平和NOS活性,提示对NO整体释放具有调节作用。eNOS主要存在于內皮细胞、上皮细胞和心肌细胞,在肝纤维化和肝硬化肝组织都有表达[15]。本研究结果表明,在CCl4诱导的肝纤维化模型中,肝组织eNOS明显升高,提示损伤导致内皮细胞产生和释放NO功能发生改变,欧当归内酯A治疗后,随着纤维化的改善肝组织eNOS表达显著减少。氯化钴化学诱导细胞缺氧损伤是体外研究常用的技术方法,广泛应用于神经细胞、癌细胞、血管内皮细胞及平滑肌细胞缺氧研究[16]。体外实验我们采用氯化钴诱导具有肝窦内皮细胞特点的SK-HEP-1细胞建立缺氧损伤模型,损伤后细胞vWF表达显著升高,上清NO水平升高,胞内NO下降,欧当归内酯A可以降低vWF表达及上清NO水平,胞内NO上升,提示该药对肝窦内皮细胞损伤具有保护作用。
综上所述,欧当归内酯A可抑制CCl4大鼠肝纤维化,减轻脂质过氧化损伤,降低肝组织NO和NOS水平,下调eNOS表达;其抗肝纤维化作用机制可能与保护肝窦内皮细胞缺氧损伤,调节NO释放有关。
参考文献
[1]中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南(2019年版)[J].临床肝胆病杂志,2019,35(7):1444-1449.
[2]Marrone G,Russo L,Rosado E,et al.The transcription factor KLF2 mediates hepatic endothelial protection and paracrine endothelial-stellate cell deactivation induced by statins[J].J Hepatol,2013,58(1):98-103.
[3]Cogger VC,Arias IM,Warren A,et al.The response of fenestrations,actin,and caveolin-1 to vascular endothelial growth factor in SK Hep1 cells[J].Am J Physiol Gastrointest Liver Physiol,2008,295(1):G137-G145.
[4]Shenoda B,Boselli J.Vascular syndromes in liver cirrhosis[J].Clin J Gastroenterol,2019,12(5):387-397.
[5]Desroches-Castan A,Tillet E,Ricard N,et al.Bone Morphogenetic Protein 9 Is a Paracrine Factor Controlling Liver Sinusoidal Endothelial Cell Fenestration and Protecting Against Hepatic Fibrosis[J].Hepatology,2019,70(4):1392-1408.
[6]赵志敏,黄恺,孙鑫,等.基于肝窦内皮细胞损伤评价黄芪来源成分的防护作用[J].中西医结合肝病杂志,2017,27(3):155-157,后插5-后插6.
[7]Lee TF,Lin YL,Huang YT.Studies on antiproliferative effects of phthalides from Ligusticum chuanxiong in hepatic stellate cells[J].Planta Med,2007,73(6):527-534.
[8]Zhao ZM,Liu HL,Sun X,et al.Levistilide A inhibits angiogenesis in liver fibrosis via vascular endothelial growth factor signaling pathway[J].Exp Biol Med(Maywood),2017,242(9):974-985.
[9]Eltahir HM,Nazmy MH.Esomeprazole ameliorates CCl4 induced liver fibrosis in rats via modulating oxidative stress,inflammatory,fibrogenic and apoptotic markers[J].Biomed Pharmacother,2018,97:1356-1365.
[10]孙家昌,孙妩弋,厉歆然,等.不同浓度四氯化碳诱导小鼠肝纤维化模型的比较[J].实验动物与比较医学,2018,38(4):255-260.
[11]陈国中,朱飞叶,俞忠明.化痰行瘀汤对肝纤维化大鼠治疗作用及对脂质过氧化的影响研究[J].浙江中医药大学学报,2019,43(9):935-939,944.
[12]余娇,王伟.多烯磷脂酰胆碱对急性肝损伤患者血清NO、NOS水平的影响[J].肝脏,2018,23(3):269-270.
[13]张博,谢云亮.紫草多糖对CCl4诱导的急性肝损伤小鼠的保护作用及机制研究[J].现代免疫学,2018,38(2):135-139.
[14]倪若愚,易建华,曾令兰,等.慢性乙型肝炎肝组织内NO合成酶及其意义[J].中华肝脏病杂志,1996,4(3):145-147.
[15]刘铭.在肝硬化形成过程中eNOS和iNOS在肝肠组织的表达及其意义[D].太原:山西医科大学,2007.
[16]王君妍,叶洁瑜,梁恩瑜,等.血小板生成素通过PI3K/AKT通路防止CoCl2诱导内皮细胞凋亡[J].中国实验血液学杂志,2018,26(2):528-534.
(2020-09-10收稿 责任编辑:王明)

