一种新型过氧化氢传感器的构建及其在牛奶中的应用
徐军军,吴甜甜,席慧婷,叶璀珠,邓丹雯,黄赣辉(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
过氧化氢(H2O2)作为防腐剂在食品加工和环境分析中具有重要的意义[1]。研究表明,过量的过氧化氢会影响牛奶中酪蛋白和血清蛋白的质量,从而降低原料奶的营养价值;除此之外过氧化氢具有致癌、加速细胞衰老等毒副作用,损害消费者的经济利益和健康[2]。因此,很多国家明确规定禁止在乳制品中添加过氧化氢。现有的过氧化氢检测技术主要包括分光光度法[3]、化学发光法[4]、电化学发光法[5]、色谱法[6]等,但这些方法存在灵敏度低、操作复杂、仪器昂贵等缺点。电化学传感器技术由于其具有选择性好、灵敏度高、制备工艺简单、检测时间短等优点而被广泛应用于临床和食品检测中[7]。研究已报道Hb/PdNPs/GR-CS/GCE[8]、Hb/sol-gel/CPE[9]、Hb-collagen-CNTs[10]被构建成电化学生物传感器用于检测过氧化氢,表现出良好的检测限和灵敏性。但这些传感器是将功能性材料滴涂在电极表面,修饰材料易脱落而降低传感器的稳定性。因此研制出一种新型具有高灵敏性、稳定性的过氧化氢传感器具有重要的应用价值。
血红蛋白(Hb)对过氧化氢具有良好的催化活性,可作为辣根过氧化物酶在H2O2生物传感器中的理想替代品[11-12]。然而,血红蛋白的氧化还原活性中心位于蛋白质的深层结构,这意味着血红蛋白与电极表面间的电子传递效率低[11]。因此,选择一种具有良好生物相容性的功能材料固载血红蛋白以保持其生物活性,促进其活性中心与电极之间的电子转移是非常必要的。金属纳米粒子及其氧化物因其比表面积大、生物相容性好、吸附能力强而受到广泛关注[13-15]。纳米镍[16]、纳米银[17]及其氧化物、ZnO[18]等贵金属常被用于构筑电化学传感器的材料用于食品和临床检测;其中,金纳米颗粒具有良好的导电性和生物相容性,可以促进Hb电活性中心与电极间的直接电子转移[19]。同时,聚吡咯(Ppy)是一种独特的导电聚合物,具有良好的导电性、稳定性和生物相容性,是固定化酶或蛋白质的优良材料底物,广泛用于修饰材料以提高电化学生物传感器的导电性[20]。
本文在以聚吡咯膜为基底的玻碳电极上沉积纳米金颗粒并吸附血红蛋白制备Hb/AuNPs/GCE传感器,开发一种新型过氧化氢电化学传感器,研究该传感器的灵敏性、选择性和稳定性,并将其用于检测牛奶中过氧化氢的检测,为传感器的实际生产应用提供更多的理论基础。
1 材料与方法
1.1 材料与仪器
铁氰化钾、亚铁氰化钾 天津大茂试剂有限公司;硫酸 天津致远化学试剂有限公司;氯化钾、硝酸钾、磷酸氢二钾、磷酸二氢钠、过氧化氢(w/v=30%)汕头西隆化工有限公司;氯金酸、吡咯、抗坏血酸、多巴胺、尿酸和L-半胱氨酸 阿拉丁试剂有限公司;牛血红蛋白(99%) Salebo有限公司;牛奶 阳光乳业有限公司提供;电极 上海仙人仪器有限公司。
S-3400N场发射扫描电镜 日本电子股份有限公司;Agilent5500原子力显微镜 美国Agilent technologies;ESCALAB250 X射线光电子能谱 美国Thermo Fisher Scientific;石英晶体微天平(CHI440) 上海辰华仪器有限公司
1.2 实验方法
1.2.1 修饰电极的制备 参考Chen 等[21]的方法对裸玻电极进行预处理。以经预处理的玻碳电极为工作电极,铂(Pt)电极为辅助电极、饱和甘汞电极(HgCl2)为参比电极构成三电极体系。配制0.1 mol/L KCl溶液,在10 mL KCl溶液中添加1 mL 新蒸吡咯,首先,将三电极体系垂直放置在含0.2 mol/L的吡咯单体的0.1 mol/L KCl溶液为支持电解液中,充氮驱氧10 min。运用恒电位法聚合吡咯,恒电位法采用多电位阶跃中的单一电位,设定聚合电位为0.8 V,初始电位根据开路电位方法设置为0.25 V,间隔时间为0.002 s,控制聚合电量手动终止。将得到的电极记为Ppy/GCE电极置于含1 mL HAuCl4的0.1 mol/L KNO3,设置循环伏安电位窗口为-0.2~1.0 V,扫描速度为10 mV/s,扫描圈数为5,使纳米金颗粒沉积在修饰电极上,得到的修饰电极记为AuNPs/Ppy/GCE。用超纯水洗净后垂直放置于含10 mg/mL牛血红蛋白的磷酸缓冲溶液中浸泡2 h,利用静电吸附作用力和Au-SH共价键作用使血红蛋白固载在纳米金颗粒上,得到的电极记为Hb-AuNPs/Ppy/GCE。
1.2.2 Hb/NPs/Ppy/GCE制备条件优化 本文研究吡咯聚合电量、磷酸缓冲液pH、支持电解质pH、差分脉冲伏安法脉冲周期对Hb/AuNPs/Ppy/GCE响应电流的影响。
1.2.2.1 脉冲周期优化 选定吡咯聚合电量1.0×10-3、磷酸缓冲溶液pH7.0、支持电解质pH7.0时,脉冲周期分别为0.1、0.2、0.3、0.4、0.5,以差分脉冲伏安法响应电流为评价指标,研究脉冲周期对传感器检测效果的影响。
1.2.2.2 吡咯聚合电量优化 选定磷酸缓冲液pH7.0、支持电解质pH7.0、脉冲周期0.3,吡咯聚合电量分别为1.0×10-3、1.5×10-3、2.0×10-3、2.5×10-3、3.0×10-3、3.5×10-3C,以差分脉冲伏安法的响应电流为评价指标,研究吡咯聚合电量对传感器检测效果的影响。
1.2.2.3 磷酸缓冲溶液pH优化 选定吡咯聚合电量1.0×10-3、支持电解质pH7.0、脉冲周期0.3时,磷酸缓冲溶液pH分别为6.0、6.5、7.0、7.5、8.0,以差分脉冲伏安法的响应电流为评价指标,研究磷酸缓冲溶液pH对传感器检测效果的影响。
1.2.2.4 支持电解质pH优化 选定吡咯聚合电量1.0×10-3、磷酸缓冲液pH7.0、脉冲周期0.3,支持电解质pH分别为3.0、4.0、5.0、6.0、7.0,以差分脉冲伏安法的响应电流为评价指标,研究支持电解质溶液pH对传感器检测效果的影响。
1.2.3 Hb/AuNPs/Ppy/GCE修饰电极的物理表征
1.2.3.1 SEM表征 在上述最优条件下制备修饰电极,将样品在37 ℃烘箱中干燥1 h,将干燥的电极头固定在样品台上,利用环境扫描电镜在低中空模式下进行扫描,选择执行电压15.0 kV,放大倍数为50.0 K观察修饰电极的微观结构。
1.2.3.2 AFM表征 在上述最优条件下制备修饰电极,将样品在37 ℃烘箱中干燥1 h。将干燥的电极头固定在样品台上,采用原子力显微镜在真空下对样品进行观测,探针共振为330 kHz,固定力大小为48 N/m,速率为0.6 Hz,测试温度为25 ℃。
1.2.3.3 XPS表征 在上述最优条件下制备修饰电极,将样品在37 ℃烘箱中干燥1 h。将干燥的电极头固定在样品台上,利用ESCALAB 250型X射线能谱仪在真空条件下对修饰电极的组成元素进行分析,可以准确的判断各材料是否成功的修饰到电极表面。
1.2.4 Hb/AuNPs/Ppy/GCE修饰电极的电化学表征
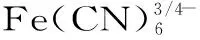

1.2.5 过氧化氢检测方法 以玻碳电极为基底的修饰电极为工作电极、铂电极为辅助电极,饱和甘汞电极作为参比电极构成三电极体系。差分脉冲伏安法(DPV)的检测电位窗口为-0.8~0 V,支持电解质为0.1 mol/L KCl溶液。评价指标为DPV方法的响应电流。
1.2.6 样品处理及检测 参考Karimi等[22]的牛奶预处理方法,将20 mL 1 mol/L H2SO4与80 mL牛奶混合,离心(20 min,8000 rad/s),收集上清液,用1 mol/L NaOH调整溶液pH为7.0,得到牛奶标准溶液。在牛奶标准样液中分别添加10、20、50、100 μmol/L H2O2,根据差分脉冲伏安法所得到的响应电流计算该传感器在牛奶样品中检测过氧化氢的加标回收率。
1.3 数据处理
以上实验均平行三次,从CHI440C石英晶体微天平中将原始数据导出到Excel,经分列等处理后,导入到Origin 8.0专业作图软件绘制图形。
2 结果与分析
2.1 修饰电极的物理表征
2.1.1 SEM表征 如图1A1所示,Ppy/GCE表面呈现凸起的海岛状结构,这表明聚吡咯膜修饰成功,该结构能够增膜的比表面积,从而固载更多的纳米金颗粒。较Ppy/GCE而言,AuNPs/Ppy/GCE修饰电极的表面形貌发生了明显的变化,一层球状颗粒均匀的分布在聚吡咯膜上(图1A2)。X射线能谱对AuNPs/Ppy/GCE修饰电极的组成元素进行表征,如图1A3所示,其主要组成元素为C和Au,其中C元素可能来源于聚吡咯膜或者GCE,而Au元素只可能来自金,表明金颗粒成功地修饰到电极表面。
2.1.2 AFM表征 图1B展示了各修饰电极的AFM形貌,图1B1也展示了Ppy/GCE修饰电极海岛状结构,与SEM表征结果一致,聚吡咯膜的厚度约为11 nm,海岛状的结构极大的增加其比表面积,这为固载纳米金颗粒提供更多的结合位点。图1B2表面均匀地分布着30 nm左右的球状颗粒,可能是纳米金颗粒。Hb/AuNPs/Ppy/GCE表面密集的分布着直径约为15 nm左右颗粒,极有可能为血红蛋白(图1B3)。
2.1.3 XPS表征 XPS用来表征各电极修饰材料的组成元素,结果如图1C所示,Ppy的组成元素为C、N、O(图1C1),其中C既可能来自于聚吡咯膜,也可能来自于玻碳电极中的C。AuNPs/Ppy的组成元素为Au、C、O,而且Au所占的比例很大(图1C2)表明纳米金颗粒成功到沉积到电极表面,同时也验证了SEM和AFM表征图中均匀分布的粒径约为30 nm的球状颗粒为纳米金粒子。Hb/AuNPs/Ppy的XPS谱图中Au所占的比例大幅度减少,相反,O和N的比例均增加,同时Fe元素出现在能谱图中,这些事实表明血红蛋白成功的吸附在纳米金颗粒上。

图1 各修饰电极的物理表征Fig.1 Physical characterization of modified electrode注:A为修饰电极的SEM图(A1:Ppy/GCE,A2:AuNPs/Ppy/GCE,A3:能谱图);B为AFM图(B1:Ppy/GCE,B2:AuNPs/Ppy/GCE,B3:AuNPs/Ppy/GCE);C为XPS图(C1:Ppy/GCE,C2:AuNPs/Ppy/GCE,C3:AuNPs/Ppy/GCE)。
2.2 修饰电极的电化学表征


2.2.3 传感器催化能力测试 图2C展示了各修饰电极在含有1 mmol/L H2O2的KCl溶液中的循环伏安曲线,GCE在-0.8V左右出现一个小而宽的还原峰,表明玻碳电极在通电条件下能够使过氧化氢分解(曲线4),AuNPs/Ppy/GCE的还原峰响应电流增加,表明聚吡咯和纳米金颗粒对过氧化氢具有一定的催化能力。曲线1展示了Hb/AuNPs/Ppy/GCE的循环伏安曲线,还原峰响应电流显著增加,约为裸玻碳电极的6.2倍,表明血红蛋白对过氧化氢具有良好的催化效果。与此同时,循环伏安法被用来研究Hb/AuNPs/Ppy/GCE修饰电极在添加H2O2前后的KCl溶液的电化学行为。如图2D所示,在不含过氧化氢条件下,较小的氧化峰和还原峰出现在分别约为-0.42和-0.48 V(曲线a),这是典型的血红蛋白氧化还原峰[23]。当在支持电解质中添加1 mmol/L H2O2后,阳极峰消失,阴极峰电流显著增加(曲线b),这是因为血红蛋白催化过氧化氢还原促使H2O2的还原峰显著增加,其机理可以概括为血红蛋白中的Hb-Fe2+被过氧化氢氧化转化为Hb-Fe3+,又迅速在电极表面被还原成Hb-Fe2+[24-25]。
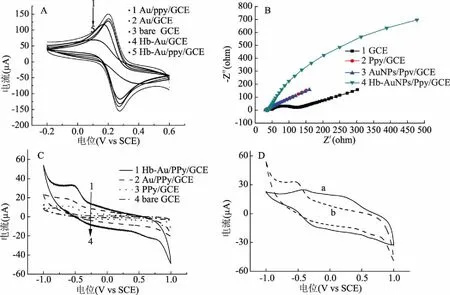
图2 各修饰电极的电化学表征Fig.2 electrochemical characterization of each modified electrode注:A为各修饰电极在含0.1 mol/L KCl的5 mmol/L 溶液中的循环伏安曲线,B为各修饰电极的EIS图,C为各修饰滴电极在含有1 mmol/L H2O2的KCl溶液中的循环伏安曲线。D为Hb/AuNPs/Ppy/GCE在含有或不含H2O2的KCl溶液中的循环伏安曲线。(a为不含H2O2,b为含H2O2)。
2.3 传感器参数优化
2.3.1 脉冲周期的选择 不同脉冲周期对Hb/AuNPs/Ppy/GCE传感器的电流响应图如图3A所示,传感器的响应电流值随脉冲周期的增加先变大后减小,在差分脉冲伏安法的脉冲周期为0.2 s时,传感器的响应电流值最大,因此,本实验的差分脉冲伏安的脉冲周期选定为0.2 s。
2.3.2 吡咯聚合电量的选择 吡咯聚合电量与形成的聚吡咯膜具有一定的关系,当聚合电量低时表面粗糙度低,当聚合电量高时Ppy呈现三维增长,导致薄膜表面粗糙度增加[26]。由图3B可知,聚合电量在1.0×10-3~3.5×10-3C范围内,差分脉冲伏安法响应电流逐渐增大,表明修饰电极的导电性随着沉积电荷的增加而增加,因为当聚合电量变大时,聚吡咯逐渐生长,厚度增加,增加其导电性。当聚合电量达3.0×10-3C,修饰电极的相应电流减小,这是因为聚吡咯薄膜在较高电流密度下非常粗糙和脆弱,导致电流响应下降。因此选择吡咯聚合电量为3.0×10-3C。
2.3.3 PBS溶液pH选择 如图3C所示,当磷酸缓冲溶液的pH为6.5时,差分脉冲伏安法的响应电流最强,可能因为血红蛋白的等电点为7.1,此时带正电荷的血红蛋白与带负电荷的纳米金颗粒通过相互静电作用最强,纳米金颗粒上吸附的血红蛋白更多,导致响应电流更大,当pH超过6.5时,血红蛋白与纳米金之间的吸附作用下降,导致催化能力下降[27]。因此选择磷酸缓冲液的pH为6.5。
2.3.4 KCl溶液pH 如图3D所示,Hb/AuNPs/Ppy/GCE在pH为7.0的支持电解质中催化H2O2还原的差分脉冲伏安法的响应电流最大。因此选择支持电解质的pH为7.0。在上述最优条件下制备修饰电极。
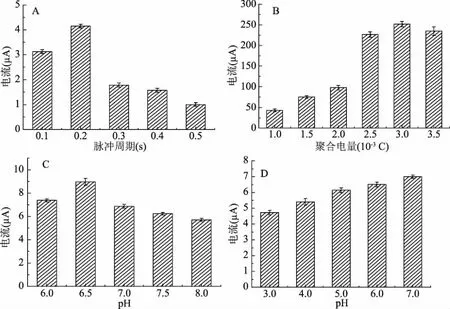
图3 传感器的参数优化Fig.3 The effects of the different factor注:A:脉冲周期;B:吡咯聚合电量;C:PBS缓冲液的pH;D:KCl溶液的pH。
2.4 标准曲线与检出限
H2O2浓度对Hb/AuNPs/Ppy/GCE生物传感器电流响应的影响如图4A所示,当支持电解质中的H2O2浓度成梯度增加时,还原峰的响应电流值呈线性增加。响应电流值与H2O2浓度的线性关系如图4B所示,两者间的线性方程为I(μA)=9.25924+0.00995C(μmol/L),其中线性相关系数R2为0.99567。根据国际纯粹与应用化学联合会(IUPAC)推荐方法[21]计算得出Hb/AuNPs/Ppy/GCE生物传感器对过氧化氢的检出限为0.2 μmol/L,并且该传感器的检测时间低至12 s,可以满足实际样品的在线检测。

图4 不同H2O2含量与响应电流的差分伏安曲线图(A)及H2O2含量与响应电流的线性关系图(B)Fig.4 Different H2O2 content and response current differential volt-ampere curve diogram(A)and H2O2concent and response current linear relationship diagram(B)
2.5 抗干扰实验
Hb/AuNPs/Ppy/GCE生物传感器对过氧化氢、抗坏血酸、多巴胺、等物质的抗干扰性研究如图4B所示,I-t图直观的描绘了该传感器在添加入一定量抗干扰物质的电流变化曲线图。50 s时,在支持电解质中加入20 μmol/L H2O2,电流骤然增加,这是因为过氧化氢将血红蛋白中的Fe2+氧化为Fe3+,氧化还原过程中产生的电子在电极表面传递,导致电流增加。分别在100、150、200、250 s时加入200 μmol/L抗坏血酸、多巴胺等物质,响应电流没有明显变化,当在300 s时再次加入过氧化氢时,响应电流再次骤然增加,表明该传感器对抗坏血酸、多巴胺、等物质具有良好的抗干扰性,为用于实际样品中的过氧化氢检测奠定理论基础。
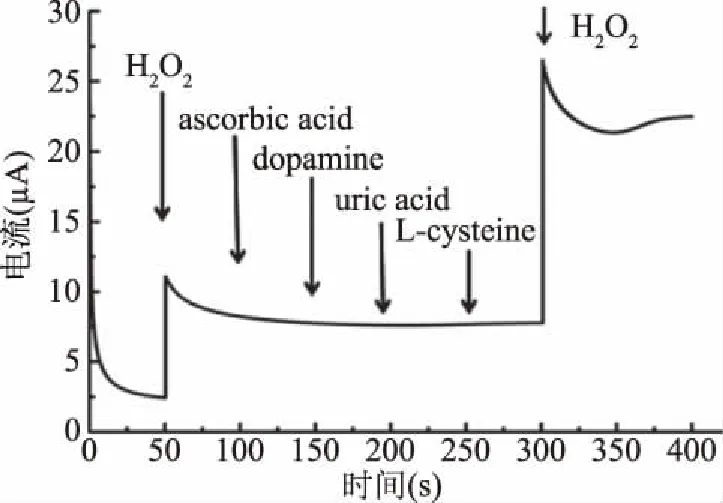
图5 Hb-AuNPs/Ppy/GCE在添加20 μmol/L H2O2和200 μmol/L AC、DA、UC、L-Cys时的计时电流响应Fig.5 Amperometric i-t response of Hb-AuNPs/Ppy/GCE for adding 20 μmol/L H2O2and 200 μmol/L ascorbic acid(AC),dopamine(DA),uric acid(UC),L-cysteine(L-Cys)into the slightly stirred 0.1 mol/L KCl solution respectively
2.6 稳定性实验
生物传感器在含有20 μmol/L H2O2的KCl中差分脉冲伏安法重复测定5次。结果如图6所示,差分脉冲伏安法的响应电流在9.5×10-6A附近,5次平行实验的响应电流的相对标准偏差为3.2%,间接表明过氧化氢与血红蛋白间的氧化还原反应是可逆的。

图6 Hb/AuNPs/Ppy/GCE修饰电极在含20 μmol/L H2O20.1 mol/L KCl溶液中测定5次的差分脉冲伏安响应电流Fig.6 DPV response current of Hb/AuNPs/Ppy/GCE measured 5 times in 0.1 mol/L KCl with 20 μmol/L H2O2
2.7 实际样品检测
将Hb/AuNPs/Ppy/GCE生物传感器用于牛奶中过氧化氢检测,结果如图表1所示,该传感器的回收率在92.7%~116.0%之间,平均标准差为3.8%,表明我们所构建的传感器可以用于实际样品中过氧化氢的检测。

表1 传感器在牛奶样品中的过氧化氢回收率Table 1 The recovery rates of hydrogen peroxide in milk
3 结论与讨论
本实验成功构建一种新型的H2O2生物传感器,以聚吡咯膜为基底沉积纳米金颗粒,并利用静电作用将血红蛋白分子吸附在金粒子上构建Hb/AuNPs/Ppy/GCE修饰电极。我们提出的生物传感器具有良好的敏感性、选择性和稳定性,AuNPs和Hb对H2O2具有良好的协同催化作用。将构建的传感器用于牛奶样品中的过氧化氢检测,其回收率为92.7%~116.0%之间,并且检测时间低至12 s,可以用于实际样品中过氧化氢残留量的在线检测。
本研究利用电化学修饰材料的特异性检测,初步构建了可用于过氧化氢检测的Hb/AuNPs/Ppy/GCE传感器,并对该传感器的检测方法进行优化,但是要将这种方法投入到实践中还需进行深入的研究:如该传感器的储存时间及更广范围内的应用,本课题组将针对这两个问题做进一步研究。

