MR3.0T 3D-ASL在胶质瘤术前分级的应用价值
林楚荣,皮 姗
(中山大学附属第三医院医学影像科 广东 广州 510000)
脑胶质瘤起源于脑胶质细胞,是颅内最常见的原发性脑肿瘤,占所有脑恶性肿瘤的80%[1]。脑胶质瘤按2016 WHO分级分为I、Ⅱ、Ⅲ、IV级,其中I~Ⅱ级为低级别,Ⅲ~IV级为高级别[2]。低级别胶质瘤的预后较好,高级别胶质瘤的则预后则较差,五年生存率较低。所以,准确评估肿瘤的级别和类型对于患者后续治疗和手术具有至关重要意义[3]。但目前还没有非常理想的影像学技术,但对于术前脑肿瘤分级的替代方法仍有很大的需求。磁共振成像(magnetic resonance imaging,MRI)是脑肿瘤患者术前常规检查,是评估胶质瘤肿瘤分级的一个非常实用的方法。三维动脉自旋标记(3D-ASL)成像是一种完全无创的磁共振灌注成像方法,以自身动脉血内的H质子作为内源性示踪剂,主要用于测量脑内血流量(cerebral blood flow,CBF),反映脑实质灌注情况。测量肿瘤病变,能够较为准确地评估肿瘤新生血管情况和脑组织血流灌注信息[4]。
本研究通过对高、低级别和不同WHO分级的脑胶质瘤的CBF的测量以探讨3.0TMRI 3D-ASL在胶质瘤术前分级的应用价值。
1 资料与方法
1.1 一般资料
收集2015年5月—2020年6月在本院神经外科手术并且术后病理证实胶质瘤的32例患者,其中男18例,女14例,年龄6~74岁,平均45.84±15.02岁。患者病理标本根据WHO 2016年中枢神经系统肿瘤分类标准[2],分为I、Ⅱ、Ⅲ、IV级,其中I、Ⅱ级为低级别,Ⅲ、IV为高级别。本研究经本院伦理学委员会批准,所有入组患者均已在检查前签署知情同意书。
1.2 数据采集
采用GE Discovery MR750 3.0T磁共振扫描仪,配有8通道头颅相控阵线圈,常规行头部轴位平扫T1WI、T2WI以及T2-FLAIR序列扫描以及增强T1WI序列,全脑3D-ASL序列在增强之前扫完。3D-ASL序列参数:FOV 240mm×240mm,层厚4mm,层间距0mm,TR 4844.0ms,TE 10.5ms,矩阵=512×8,采集次数(NEX)3次,标记延迟时间(PLD)2.0s,总扫描时间4min41s。
1.3 3D-ASL数据后处理
原始图像回传到GE AW4.6工作站,利用 funCTool软件的3D-ASL数据处理模块对数据进行后处理,得到CBF伪彩图,其中蓝色区域代表低灌注,红色区域代表高灌注,参考常规扫描序列图像,选取肿瘤实性部分最大横断层面,在瘤体实质部分内放置感兴趣区(region of interests,ROI),避开钙化、出血或坏死等影响实际测量值的区域,软件自动得出肿瘤内的灌注值(CBFt)。为了消除患者个体血供差异和年龄等因素对脑灌注值造成的影响,在正常侧肿瘤镜像区域白质区绘制与同样大小的ROI,得到正常白质的灌注值(CBFn)。肿瘤灌注值CBFt与正常白质CBFtn值分别测量3次,并取各自平均值,并计算脑肿瘤的相对灌注值rCBFt(rCBFt=CBFt/CBFtn)。同时测量肿瘤周围水肿区域CBFe及其相对应的正常侧镜像区域白质区CBFen,计算水肿区的相对灌注值rCBFe(rCBFe=CBFe/CBFen)。
1.4 统计学分析
记录所测得数据并使用SPSS23.0统计软件进行数据分析,高、低级别胶质瘤组之间CBF测量值比较,采用非参数秩和检验(Mann-Whitney U test),不同WHO级别脑胶质瘤与肿瘤灌注之间的相关性分析则采用Spearman相关分析,均以P<0.05表示差异有统计学意义。
2 结果
2.1 32例患者的病理结果
(依据2016 WHO分级) 所有患者肿物经手术后病理证实均为胶质瘤,各级分类数量:其中I级3例,Ⅱ级13例,Ⅲ级4例,IV级12例,其中I~Ⅱ级为低级别组(16例),Ⅲ~IV级为高级别组(16例)。
2.2 3D-ASL测量结果
经非参数秩和检验分析(Mann-Whitney U test),16例低级别胶质瘤以及16例高级别胶质瘤肿瘤实质部分的CBFt、rCBFt、瘤周水肿CBFe、rCBFe值以及其相对应的正常侧镜像区域白质区CBF值(详见表1)。高、低级别胶质瘤的瘤周水肿CBFe、rCBFe值P分别为0.498和0.880,无明显统计学差异。高级别胶质瘤组的rCBFt(1.75±0.84)高于低级别胶质瘤组rCBFt(1.14±0.56),P为0.013,两组之间的差异有统计学意义(P<0.05)。经Spearman相关检验分析,32例胶质瘤病理级别的高低与其CBFt、rCBFt的大小呈正相关性且P<0.05,详见表2。
3 讨论
胶质瘤的生物学特性复杂,术前诊断胶质瘤的级别、瘤体内灌注情况对手术指导及预后评价有极其重要的价值。单纯CT术前诊断不足以评估肿瘤的良恶性,而且往往诊断准确率较低,出现误诊甚至耽误治疗,因此脑胶质瘤MRI已成为常规术前检查。但临床上常把常规MRI增强扫描和灌注成像概念混淆,前者仅反映血脑屏障是否完整以及破环后对比剂渗透至血管外组织间隙的程度,但胶质瘤内部的微血管生长程度和肿瘤灌注情况难以显示,肿瘤恶性度并不能只用肿瘤强化程度强弱反映[5],而灌注加权成像检査能较真实反映病变的微循环灌注信息。肿瘤的生长、细胞的增殖离不开肿瘤微循环的形成,临床可以通过灌注加权成像(PWI)定量评估肿瘤组织的血管生成情况。灌注加权成像能较好地显示胶质瘤内部异常增殖血管及微循环的丰富程度,进而预测胶质瘤的病理组织变化、诊断分级以及预后情况[6-7]。
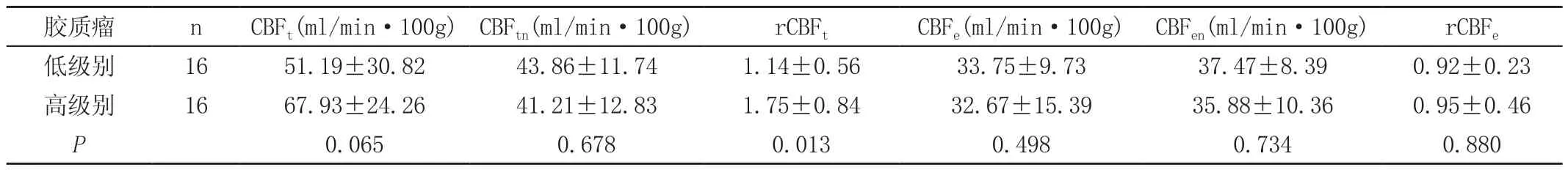
表1 高、低级别胶质瘤肿瘤实质及其水肿区CBF值、rCBF值的差异比较结果表

表2 胶质瘤不同病理级别与其CBF、rCBF值的相关性分析结果表
现阶段灌注加权成像主要有2类,一类是使用外源性示踪剂,还有一类是使用内源性示踪剂,前者是测量外源性对比剂流经毛细血管网的弛豫或者磁敏感效应导致的信号变动,从而获得反映组织灌注信息,包括T1动态增强灌注成像(dynamic contrast-enhanced MRI,DCE-MRI)、动态磁敏感灌注(dynamic susceptibility contrast,DSC)成像及等;后者则属于ASL技术,是一种较新的磁共振灌注成像技术,其依赖内源性示踪剂,成像的基本原理是利用反转射频脉冲对成像平面上游动脉血中的水分子进行标记,待被标记的水分子进入组织内毛细血管网后,组织内的灌注信息则由标记像与非标记像相减获得[8]。ASL依赖内源性失踪剂,无需对比剂,能避免受到血脑屏障破坏干扰,量化反映岀肿瘤内部血流灌注情况及微血管分布情况,进而有助于评定肿瘤分级[9]。
本研究主要通过对高、低级别和不同WHO分级脑胶质瘤的CBF的测量以探讨3D-ASL在胶质瘤术前分级的应用价值。研究发现高级别胶质瘤组的rCBFt(1.75±0.84)高于低级别胶质瘤组rCBFt(1.14±0.56),P为0.013,差异有统计学意义(P<0.05),说明胶质瘤的肿瘤级别越高,其肿瘤内的相对灌注量越高(图A~B)。高、低级别胶质瘤的瘤周水肿CBFe、rCBFe值P分别为0.498和0.880,无明显统计学差异,一定程度说明肿瘤周围水肿区域血脑屏障及微循环未受到破坏。同时经Spearman相关检验分析32例胶质瘤病理级别的高低与其CBFt、rCBFt的大小呈明显正相关性且P均<0.05,胶质瘤的级别越高,其肿瘤实质内的灌注越高,侧面反映肿瘤内部微血管及微循环越密集,与以往文献报道大致相同[10]。其机制可能为胶质瘤的微血管环境及増殖程度是其病理分级的主要依据之一,肿瘤异常增殖的微血管不仅可以为肿瘤细胞的生长提供营养,还可能是肿瘤向周围浸润的重要途径。此外,还存在高、低级别胶质瘤之间CBFt无统计学意义,可能的原因是因为数据样本量不足或病人存在个体差异(如年龄、性别、脉率、血管特别是微血管灌注情况等等)。
本研究中还存在3例高级别胶质瘤出现低灌注(图C~D),同时出现低级别胶质瘤中出现3例高灌注(图E~F),低级别肿瘤的血流灌注量高估,有研究表明,可能是因为肿瘤内基因突变相关[11];而高级别出现低灌注可能部分高级别胶质瘤这样出血、坏死较多,也可能是局部新生微血管较密集、迂曲致使局部血流较为缓慢,使肿瘤灌注值较低。

图A~B男,74岁,右侧额叶胶质母细胞瘤(WHO Ⅳ级)。A.T2-FLAIR序列示肿瘤呈高信号;B.3D-ASL序列示肿瘤呈高灌注;图C~D女,41岁,左侧额顶叶胶质母细胞瘤(WHO Ⅳ级)。C.T2-FLAIR序列示肿瘤呈周围高信号,中央混杂信号,部分病灶出血、坏死;D.3D-ASL序列示肿瘤呈低灌注;图E~F女,39岁,左侧额叶少突胶质细胞瘤(WHOⅡ级)。E.T2-FLAIR序列示肿瘤呈高信号;F.3D-ASL序列示肿瘤呈高灌注。
本研究存在一些不足之处:首先,本研究样本量较少,特别是Ⅰ级、Ⅲ级胶质瘤患者较少,可能存在一定的偏倚,也无法评价Ⅰ级与Ⅱ级、Ⅲ级与IV级胶质瘤间灌注的差异;其次,本研究在测量3D-ASL序列的CBF值时是手动的,虽然有软件辅助测量,比如镜像生成ROI,仍可能因放置ROI的位置、面积、形状不能完全一致而产生误差。
综上所述,3.0T磁共振3D-ASL技术作为一种无创的、反映脑灌注的序列,可以较好的反映肿瘤组织学、病理学等方面的信息,不依赖于对比剂,扫描及后处理简单易行、可重复性好,提高了脑胶质瘤术前分级精准性,为手术和后续治疗提供了依据。

