泰乐菌素高效液相色谱检测方法的建立
王丽霞 李生龙 陈砀桐 王君
摘要 [目的]为了更加简便快速地检测出产品中泰乐菌素的含量,建立了泰乐菌素高效液相色谱检测方法。[方法]检测波长290 nm,流速 0.6 mL/min,进样量20 μL,色谱柱选用C 18,柱温30 ℃,流动相选用乙腈∶甲醇∶0.025 mol/L磷酸二氢铵=25∶30∶5。[结果]进样浓度在0.5~50.0 μg/mL与峰面积呈良好的线性关系(R2=0.999 9);回收率较高,均在80%以上,变异系数在允许范围内(0~5%);仪器重现性试验中,对照品连续进样10次,峰面积RSD为1.55%。[结论]高效液相色谱法检测泰乐菌素及其制剂的含量准确可靠,稳定性、重复性好,精密度高,适用于兽药企业对泰乐菌素及其制剂质量自控。
关键词 泰乐菌素;高效液相色谱法;检测方法;含量测定
中图分类号 S859.84 文献标识码 A
文章编号 0517-6611(2020)20-0206-04
doi:10.3969/j.issn.0517-6611.2020.20.055
Establishment of HPLC Method for Determination of Tylosin
WANG Li-xia,LI Sheng-long,CHEN Dang-tong et al (Anhui Huaao Biotechnology Co.,Ltd.,Hefei,Anhui 231131)
Abstract [Objective] In order to detect the tylosin content in the product more simply and quickly, a tylosin high performance liquid chromatography method was established.[Method]The detection wavelength was 290 nm,and the flow rate was 0.6 mL/min,and the injection volume was 20 μL,and the liquid chromatography was carred out by C 18,and the column temperature was 30 ℃.With the mobile phase was acetonitrile∶methanol∶0.025 mol/L ammonium dihydrogen phosphate=25∶30∶45.[Result]The injection concentration of 0.5-50.0 μg/mL had a good linear relationship with the peak area (R2=0.999 9); the recovery rate was above 80%, and the coefficient of variation was within the allowable range (0-5%).In the instrument reproducibility test,ten successive injections of reference,the peak area RSD was 1.55%.[Conclusion]The detection of tylosin and its preparations by high performance liquid chromatography is accurate and reliable, with good stability, reproducibility and high precision. It is suitable for veterinary drug companies to control the quality of tylosin and its preparations.
Key words Tylosin;High performance liquid chromatography;Detection method;Content determination
泰樂菌素(tylosin)是一种大环内酯类抗生素 [1],以淡黄色或白色粉末存在,易溶于水 [2]。因其在肠道内吸收好,在体内扩散得快,在临床上多用于治疗药物,其作用机理是能与病原微生物的核糖体结合、阻碍肽链增长,抑制细菌蛋白质的合成,起到杀菌作用 [3]。泰乐菌素可分为酒石酸泰乐菌素和磷酸泰乐菌素等。
泰乐菌素是支原体的首选药,它不仅对革兰氏阳性菌而且对部分革兰氏阴性菌都具有很强的杀灭作用 [4],泰乐菌素的这种特性使其成为治疗畜禽疾病的常用药物 [5]。孙志良等 [6]报道,饲料中添加20 mg/kg的酒石酸泰乐菌素对肉鸡有明显的促生长作用。陈冰 [7]用鸡支原体强毒人工接种AA雏鸡(14日龄),24 h后口服浓度为500 mg/L的酒石酸泰乐菌素溶液,发现雏鸡成活率和增重率均达95%以上。随着酒石酸泰乐菌素的广泛使用,出现了许多问题,如滥用药和不规范使用,造成了药物残留,美国明尼苏达大学曾做过这样的研究,发现许多猪肥料样本中泰乐菌素含量高达 5.2 mg/L [8],所以关于泰乐菌素的检测也越来越迫切。
《中华人民共和国兽药典》 [9]中泰乐菌素的检测方法是采用抗生素微生物检定法,但该方法操作繁琐、耗时较长且对检测人员经验要求比较高,很难满足兽药生产企业实现对产品快速检测的需求。高效液相色谱法是一种高效能、高灵敏度、快速的现代分析手段 [10]。因此,为兽药企业能有一种简便、快捷的方法对泰乐菌素及其制剂进行质量控制,积极摸索建立一种泰乐菌素高效液相色谱检测方法。
1 材料与方法
1.1 试剂 乙腈、磷酸二氢铵、磷酸、高氯酸钠均为分析纯,甲醇为色谱纯,均购于国药集团化学试剂有限公司;盐酸购于上海振企化学试剂有限公司。
1.2 药品 泰乐菌素标准品由中国兽药监察所提供;泰乐星(10%酒石酸泰乐菌素可溶性粉)由安徽华澳生物技术有限公司提供。
1.3 主要仪器
高效液相色谱仪(美国安捷伦科技有限公司),Eclipse-C 18色谱柱,用十八烷基硅烷键合硅胶为填充剂,手动进样器;DELTA 320 pH计测定仪;电子天平(METTLER TOLEDO),最高精确度为0.000 01 g;单级旋片式真空泵(温岭市挺威真空设备有限公司);超声波清洗器(昆山市超声仪器有限公司);高压锅、杯式过滤器、紫外分光光度计、恒温箱、烘干箱(安徽华澳生物技术有限公司)。
1.4 主要试液的配制
1.4.1 0.025 mol/L磷酸二氢铵。准确称取0.718 88 g 磷酸二氢铵于250 mL容量瓶中,先用部分超纯水溶解,然后定容至刻度,摇匀,用磷酸调节其pH为2.5,待用。
1.4.2 2 mol/L高氯酸钠溶液。称取 28.092 g高氯酸钠于100 mL容量瓶中,先用部分超纯水溶解,然后定容至刻度,摇匀,用1 mol/L浓度的盐酸调节pH(2.5+0.1)后,待用。
1.4.3 15%甲醇溶液。用量筒量取15 mL甲醇,另加85 mL超纯水混合,摇匀,待用。
1.4.4 泰乐菌素标准储备液。精确称取0.050 00 g泰乐菌素标准品置于100 mL容量瓶中,先加10 mL甲醇溶解,再加超纯水定容至100 mL,使溶液中含泰乐菌素500 μg/mL。
1.4.5 泰樂菌素标准稀释液。分别吸取一定量的泰乐菌素标准储备液置于50 mL容量瓶中,用超纯水稀释定容,配制成50.0、20.0、10.0、5.0、2.0、1.0、0.5 μg/mL。
1.4.6 生理盐水。准确称取9 g氯化钠,加入100 mL纯水 溶解。
1.5 方法的建立
1.5.1 波长的确定。
用紫外分光光度计对50 μg/mL泰乐菌素标准稀释液进行全波长扫描,根据扫描光谱确定最大吸收波长。
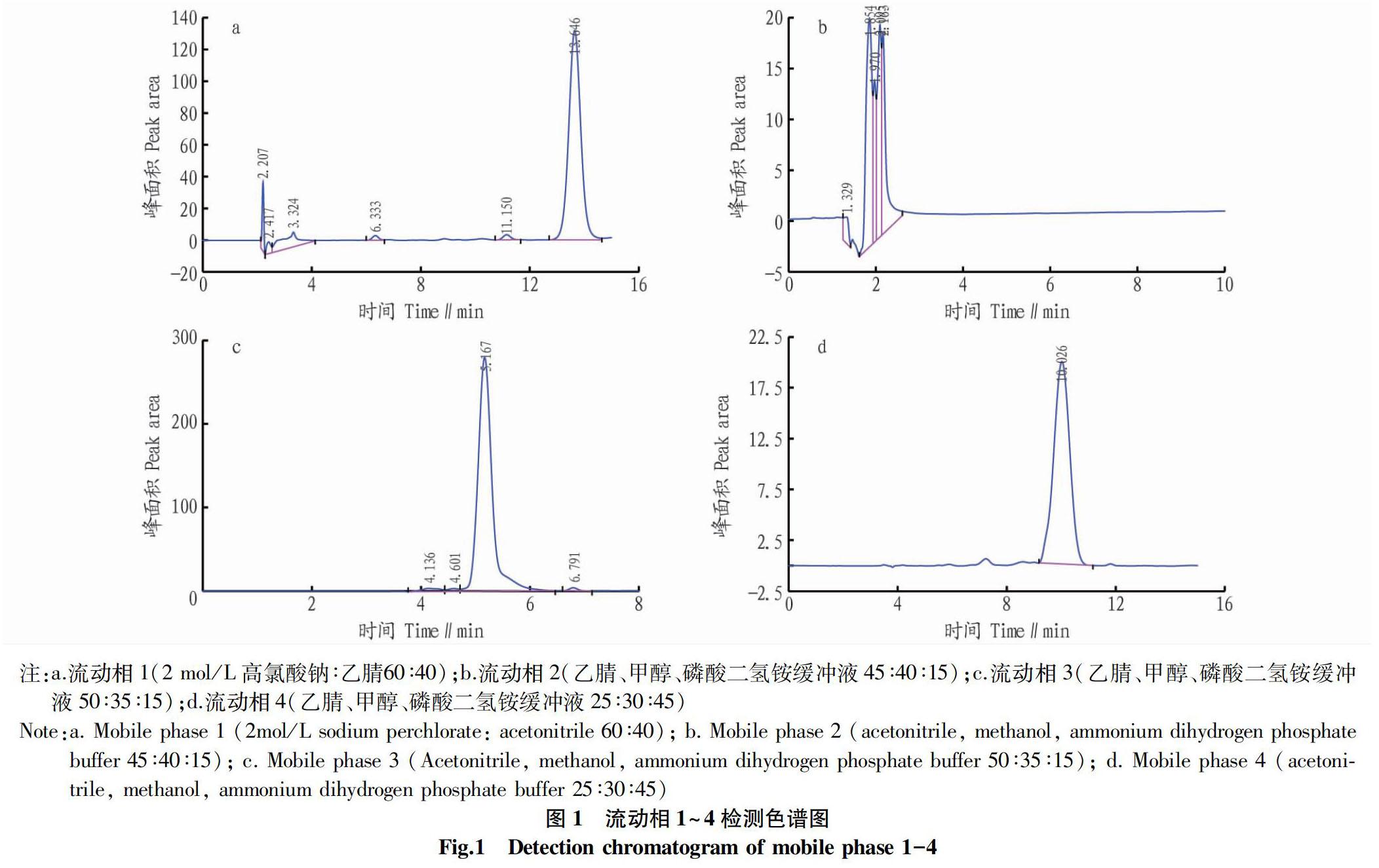
1.5.2 流动相的确定。流动相1(2 mol/L高氯酸钠∶乙腈60∶40),流动相2(乙腈、甲醇、磷酸二氢铵缓冲液60∶30∶10),流动相3(乙腈、甲醇、磷酸二氢铵缓冲液50∶35∶15),流动相4(乙腈、甲醇、磷酸二氢铵缓冲液25∶30∶45)。上述流动相过有机滤膜并超声处理后检测,检测波长为“1.5.1”确定的波长,流速为1 mL/min。
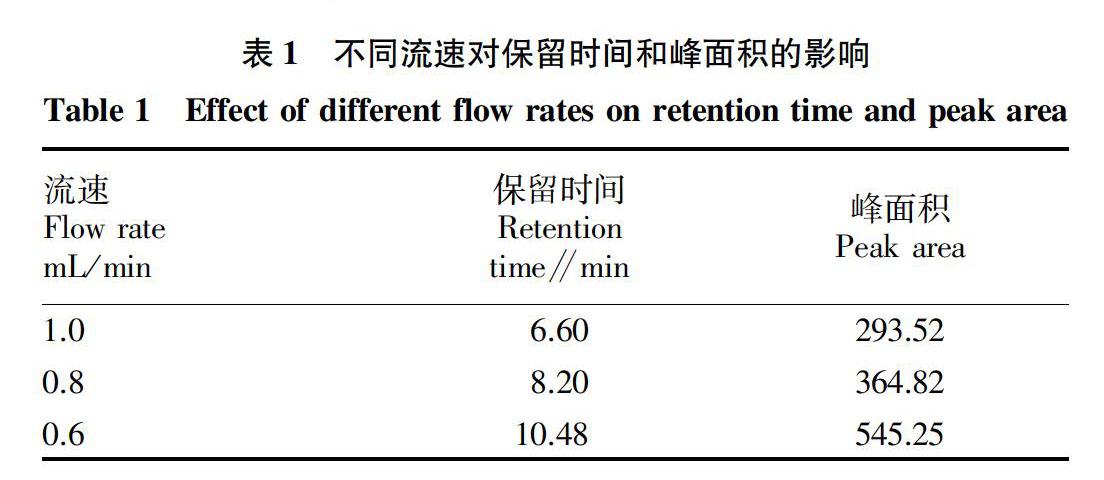
1.5.3 流速的确定。流速分别设为1.0、0.8和0.6 mL/min,取10 μg/mL泰乐菌素标准稀释液上机检测,液相条件为 “1.5.1”和“1.5.2”选定的波长和流动相,通过比较相应的峰面积和出峰时间等因素,确定流速。
1.5.4 提取液的确定。准确称取0.020 0 g泰乐星于100 mL容量瓶中,分别用乙腈、40%乙腈、10%甲醇和甲醇溶解并定容,超声溶解并过有机膜过滤,不同提取液配制的溶液重复检测3次,记录出峰时间与面积,与泰乐菌素标准稀释液峰面积比较,用外标法计算回收率。
1.6 验证试验
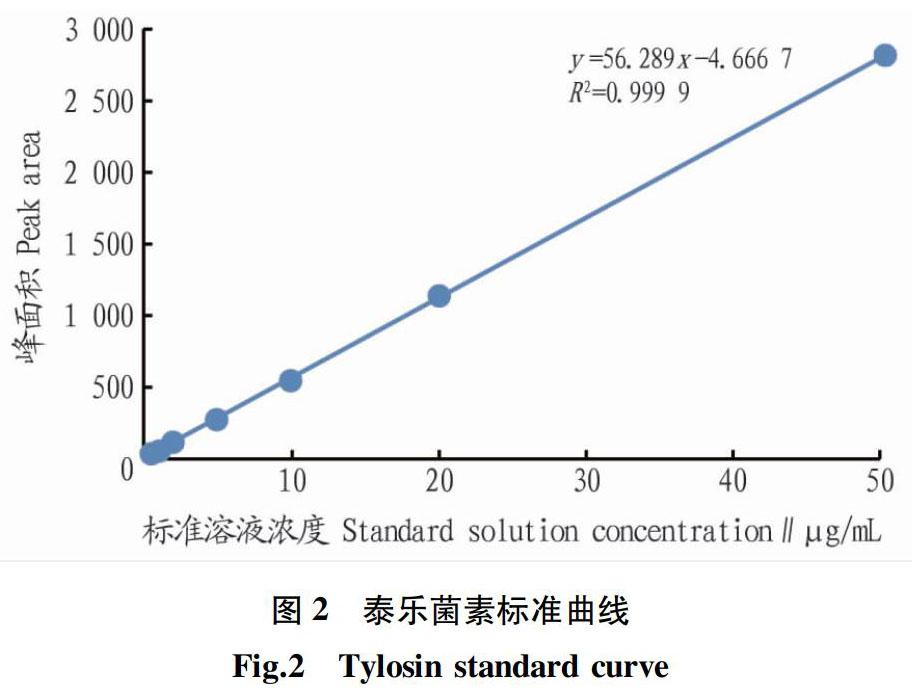
1.6.1 线性范围及建立标准曲线。取0.5、1.0、2.0、5.0、10.0、20.0、50.0 μg/mL泰乐菌素系列标准稀释液,分别上高效液相色谱仪检测,每种浓度重复检测3次,记录峰面积和浓度,并绘制标准曲线。
1.6.2 回收率和变异系数的测定。第1组准确称取 0.500 0 g无水葡萄糖,第2组准确称取0.450 0 g无水葡萄糖和 0.050 0 g 泰乐菌素标准品,混匀。各组分别称取0.050 0、 0.020 0、 0.001 0 g,用“1.5.4”中优选出的提取液定容至 100 mL,配成浓度为50、20、1 μg/mL工作液,用“1.5”中优选出的条件建立方法,上机检测,每个浓度重复检测5次,记录峰面积,取平均值,计算回收率。连续做3个批次,将测得的批内和批间的色谱峰面积代入标准曲线进行校准,计算变异 系数。
1.6.3 仪器的重复性。取浓度为5 μg/mL的泰乐菌素标准稀释液,上机检测,检测条件为“1.5”中优选出的条件,重复10次,计算变异系数。
1.6.4 定量限的考察。取“1.6.2”配制的浓度为1 μg/mL的工作液进行稀释,至浓度为0.5和0.2 μg/mL,将这2个浓度分别上机检测,检测条件为“1.5”中优选出的条件,观察液相色谱仪上是否有响应,并检测其回收率和变异系数。
1.7 泰乐星的含量测定 精确称量泰乐星0.020 0 g,用 “1.5.4”中优选出的提取液定容至100 mL,用“1.5”中优选出的液相条件上机检测,进样量20 μL,重复检测3次,记录峰面积,代入标准曲线计算含量。
2 结果与分析
2.1 波长的确定
用紫外分光光度计对50 μg/mL泰乐菌素标准稀释液进行全波长扫描,可见其在290 nm处有最大吸收峰。
2.2 流动相的确定 泰乐菌素有A、B、C、D 4个组分,其中A峰面积最大,大约占泰乐菌素总面积的90%。从图1可以
看出,采用流动相1(2 mol/L高氯酸钠∶乙腈60∶40)和流动相4(乙腈、甲醇、磷酸二氢铵缓冲液25∶30∶45)检测的泰乐菌素A组分峰形和分离效果比较好,采用流动相1检测,虽然能将泰乐菌素的4个组分分开,但因重复性不好,不能采用。采用流动相4检测出的图谱虽然没有采用流动相1得到的组分B、C、D峰形效果好,但因泰乐菌素的主要组分为A,所以流动相4能基本满足泰乐菌素的液相检测需求。
2.3 流速的确定 从表1可以看出,流速越大,保留时间越小,易受到杂质影响,峰面积降低;在流速为0.6 mL/min时,达到很好的分离,且峰面积大。
2.4 提取液的确定 比较乙腈、甲醇、10%甲醇、40%乙腈4种提取液对泰乐星产品的提取效果发现,乙腈、甲醇提取分离都没有达到要求,无法计算回收率,10%甲醇提取的回收率为96.0%,高于40%乙腈提取的回收率(90.3%),且峰形比较好看。因此确定泰乐星的提取液为10%甲醇。
2.5 方法验证
2.5.1 方法的线性关系。按照“1.6.1”方法操作,以标准溶液浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线(图2),进行线性回归, 两者呈现良好的线性关系,得出回归方程为y=56.289x-4.666 7(R2=0.999 9),表明标准溶液浓度在0.5~50.0 μg/mL与峰面积线性关系较好。
2.5.2 回收率和变异系数的测定。由表2可知,该方法的平均回收率均在90%以上,说明该方法准确适用,适于生产中用来检测。由表3中日间和日内变异系数结果可知,在同一天,不同浓度进行检测,日内变异系数均小于5%,1和 20 g/mL 的日间变异系数大于5%,说明配制的标准溶液中有效成分可能会发生降解,所以在日常检测中,标准溶液或是样品溶液最好现配现用,这样才能保证结果的准确性。
2.5.3 仪器的重复性。由表4可知,仪器的重复性较好,但要保证结果的准确、一致,最好是同一人在同一时间段检测,排除其他干扰因素。
2.5.4 定量限的测定。由表5可知,样品含量在0.2 μg/mL时测得变异系数超过了5%,说明数据波动较大,浓度太小时回收率降低;在0.5 μg/mL时,平均回收率为85%,变异系数为3.6%,在能接受的范围,最终确定该试验所选方法的定量限为0.5 μg/mL。
2.6 泰乐星含量的测定 由表6可知,泰乐星中泰乐菌素的含量为9.8%,与标示量10%结果一致。
3 讨论与结论
该方法的建立重点在流动相的摸索,在进行试验之前,查阅了大量的资料,国内多是用高氯酸钠乙腈溶液作为流动相,它能很好地分离出4个组分,但是何绮霞等 [11]的试验结
果表明用高氯酸钠乙腈溶液组成的流动相出现4个峰,且每次4个峰的含量不一样,难以进行定量,故不宜采用。通过查阅资料和试验结果可知,泰乐菌素中A组分的面积占总面积的85%以上,其他3个占有很小,所以在实际生产测量中,可以通过测定A组分含量来计算产品中泰乐菌素的含量,因此,寻找一种能有效分离泰乐菌素中A组分的流动相是该方法建立的关键步骤。国外报道多是用乙腈、甲醇和磷酸盐缓冲液不同比例的配比作为流动相 [12],虽然这种流动相分离不出4个峰,但能分离出一个最大峰进而可排除其他峰的干扰,且流动相很稳定,出峰时间快。该试验比较发现流动相4(乙腈、甲醇、磷酸二氢铵缓冲液25∶30∶45)能很好地将泰乐菌素中A组分分离,能满足兽药企业对泰乐菌素日常检测的需求。
对泰乐星提取条件的优化,综合比较提取后的液相色谱图谱、峰形、回收率和提取液的稳定性,最终选择了10%甲醇作为样品前处理的提取液。
泰乐菌素标准溶液浓度在0.5~50.0 μg/mL与峰面积呈良好的线性关系(R2=0.999 9)。在准确度与适应性试验中,对已知含量的泰乐星进行测定时,测定出来的结果与真实含量相差不大,具有很好的检测性。仪器重现性试验中,将泰乐菌素标准溶液重复检测10次,得出的峰面积RSD为 1.55%,对于同一浓度的标准溶液重复10次测出的含量相差较小,在误差允许的范围之内,表明该方法精密度良好。与《中华人民共和国兽药典》中关于对泰乐菌素含量的抗生素微生物检定法相比,该研究建立的高效液相色谱法,检测结果相对准确可靠、稳定性好、重复性好、精密度高,适用于兽药企业对泰乐菌素及其制剂质量自控。
参考文献
[1]
田宇.泰乐菌素高产菌株的选育及其培养条件的优化[D].武汉:华中农业大学,2006:7-13.
[2] 曲宁.酒石酸泰乐菌素颗粒质量研究[D].济南:山东大学,2013:30-40.
[3] 赵东峰,任翔,朱丽.泰乐菌素及其衍生物研究进展[J].医药产业资讯,2006,3(15):46-48.
[4] 王德智.酒石酸泰樂菌素明胶微球制备及药动学研究[D].哈尔滨:东北农业大学,2007:14-15.
[5] 刘恒,滕茉莉.泰乐菌素的性能、药物疗效和促生长作用简介及抗生素饲料添加剂应用现状和前景浅谈[J].饲料广角,2004(14):16-19.
[6] 孙志良,谭超,曹迎春,等.泰乐菌素对肉用仔鸡促生长作用研究[J].湖南畜牧兽医,2000(4):6-7.
[7] 陈冰.“泰乐星”牌酒石酸泰乐菌素对鸡支原体抑菌效果及增重试验[J].吉林农业科技学院学报,2005,14(4):9-10,30.
[8] CARLSON J C,MABURY S A.Dissipition kinetics and mobility of chlortetracycline,tylosin and monensin in an agriculturai soil in Northmberland County,Ontrio,Canada[J].Environmental toxicology and chemistry,2006,25(1):1-10.
[9] 中国兽药典委员会.中华人民共和国兽药典(一部二O一O年版)[S].北京:中国农业出版社,2010:179-180,附录121.
[10] SINGH N,TIPPA D M R.Development and validation of stability indicating HPLC method for simultaneous estimation of amoxicillin and clavulanic acid in injection[J].American journal of analytical chemistry,2010,1(3):95-101.
[11] 何绮霞,叶瑞英.HPLC法测定复方制剂中的酒石酸泰乐菌素[J].中国兽药杂志,2002,36(6):29-30.
[12] 张眉.高效液相色谱仪检测饲料中泰乐菌素方法的研究[D].杨凌:西北农林科技大学,2008.

