6-BA处理对猕猴桃贮藏保鲜的影响
臧建磊 李明月 万如意 田风霞

摘要 为探讨不同浓度的人工合成的细胞分裂素(6-苄氨基腺嘌呤,6-BA)处理对猕猴桃低温贮藏期间内部品质、感官品质及生理生化的影响,以河南南阳西峡“华美2号”猕猴桃果实为试材,于猕猴桃盛花后60 d开始第一次采样,此后每隔15 d采收1次,直至盛花期后120 d。同时,对盛花期后160 d进行采摘且用不同浓度6-BA对猕猴桃进行浸泡处理。取材后测定果实重量、果形指数、硬度、可溶性固形物含量(SSC)、细胞膜渗透率、相关酶活、叶绿素含量和丙二醛含量等指标。结果表明:随着猕猴桃的生长发育,果实生长状况良好;3种浓度的6-BA处理均可以提高猕猴桃的低温贮藏保鲜效果,其中以10 mg/L的6-BA处理效果相对较好,既保持果实硬度和可溶性固形物含量,抑制果实叶绿素的降解,保持膜细胞完整性,又抑制酶活的下降,较好地保证了果实品质。
关键词 6-BA;“华美2号”猕猴桃;采前生理;保鲜效果
中图分类号 TS255.3 文献标识码 A
文章编号 0517-6611(2020)20-0187-05
doi:10.3969/j.issn.0517-6611.2020.20.050
Effect of 6-BA Treatment on the Storage and Preservation of Kiwifruit
ZANG Jian-lei, LI Ming-yue, WAN Ru-yi et al (College of Life Science and Technology, Nanyang Normal University, Nanyang,Henan 473061)
Abstract In order to discuss the effects of different concentrations of synthetic cytokinin, 6-BA (6-benzylaminopurine) on the internal quality, sensory quality, physiological and biochemical indices of kiwifruit during the cold storage period, “Huamei 2” kiwifruit fruits produced in Xixia County, Nanyang City of Henan Province were used as test materials, the first sampling of the kiwifruit began from the 60 th day after flowering, and then harvested every 15 days until 120 days after flowering. Simultaneously, the kiwifruit fruits were picked on the 160 th day after flowering and soaked with different concentrations of 6-BA. The fruit weight, fruit shape index, hardness, soluble solid content(SSC), cell membrane permeability, relevant enzyme activity, chlorophyll content, and malondialdehyde content were measured after sampling. The results showed that with the growth and development of kiwifruit, the growth status of fruits was good. Three concentrations of 6-BA treatment could improve the preservation effect of kiwifruit during low temperature storage, the effect of 10 mg/L 6-BA was relatively good, which not only maintained the hardness of fruit and soluble solids content, inhibited the degradation of chlorophyll in fruit, maintained the integrity of membrane cells,but also inhibited the decline of enzyme activity, maintained better quality of fruits.
Key words 6-BA;“Huamei 2” kiwifruit;Pre-harvest physiology;Fresh-keeping effect
獼猴桃(Actinidia chinensis),隶属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.),为多年生攀援性落叶藤本果树。猕猴桃含有丰富的维生素C、有机酸、胡萝卜素等其他微量元素,在人体保健方面具有较高的价值,可以降血脂、血压,增强免疫力,有一定的抗癌效果,对肠道疾病也有缓解作用。猕猴桃采后,常温下极易软化腐烂,失果率高。民间有“七天软,十天坏,半月坏一半” [1]的说法。采收和运输过程中的机械损伤对猕猴桃果实的品质有很大影响,会造成果实失水、霉变腐烂,不易储存,经济价值降低。
植物内源激素是由植物体自身合成的激素,其在果实生长发育和品质形成过程中均发挥着重要作用,使用外源植物生长调节物质可在一定程度上对其进行调节,进而达到改善果实品质的目的 [2-3]。6-苄基腺嘌呤(6-BA)是一种人工合成的植物生长激素,具有促进植物生长发育的作用 [4]。研究表明,小麦经过喷施6-BA后能够促进小麦叶片的光合作用,提高叶绿素含量,提高小麦产量 [5]。6-BA具有防止老化等作用,是细胞分裂素类特有的生理作用。笔者以河南南阳西峡“华美2号”猕猴桃果实为试材,探讨不同浓度的人工合成的细胞分裂素(6-BA)对猕猴桃低温贮藏期间内部品质、感官品质及生理生化的影响,了解猕猴桃生长发育和成熟衰老过程和贮藏保鲜中叶绿素代谢与其生理代谢的关系,旨在为猕猴桃采后贮藏保鲜提供理论依据和实践基础。
1 材料与方法
1.1 试材及取样
来自西峡采摘的“华美2号”猕猴桃,无病虫侵扰,个头一致,成熟度相似的果实作为试材。
1.2 试剂
考马斯亮蓝G250、无水乙醇、蒸馏水、pH 7.8磷酸缓冲盐溶液(phosphate buffer saline,PBS)、pH 7.0的PBS溶液、100 g/L三氯乙酸(trichloroacetic acid,TCA)溶液、 6.7 g/L 硫代巴比妥酸(thiobarbituric acid,TBA)溶液、过氧化氢酶(catalase,CAT)反应液、65 mmol/L甲硫氨酸(DL-methionine,Met)、500 μmol/L/硝基氯化四氮唑蓝(nitrotetrazolium blue chloride,NBT)、100 μmol/L乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-Na2)、 20 μmol/L 核黄素、抗坏血酸过氧化物酶(APX)反应液、过氧化物酶(POD)反应液、液氮等。
1.3 仪器
TU-1901双光束紫外可见分光光度计,由北京普析通用仪器有限责任公司生产;CT18RT台式冷冻离心机,由上海天美科学仪器有限公司生产;PAL-1折射计,由广州市爱拓科学仪器有限公司生产;DDSJ-308F型电导率仪,由上海仪电科学仪器股份有限公司生产;美耐特数显卡尺(0~150 mm),由上海美耐特实业有限公司生产;GY-4果实硬度计,由温州一鼎仪器制造有限公司生产;FA2104舜宇电子天平,由上海舜宇恒平科学仪器有限公司生产;其他仪器。
1.4 试材处理
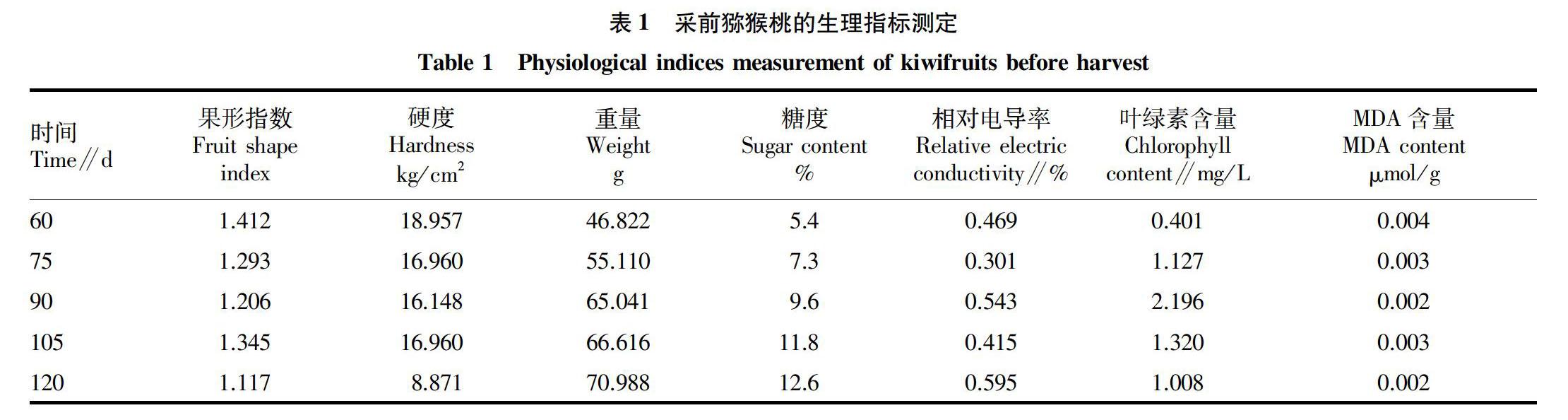
成熟前:猕猴桃盛花后60 d开始第一次采样,直至盛花期后120 d。每间隔15 d取样1次,每次取15个猕猴桃,12个测定果形,其中6个测糖度、硬度、相对电导率;剩余果实各取3个1 g、1个5 g放入液氮3~5 h后于冰箱冷冻室保存,待完全取材后集中测定其他生理指标。
成熟后:盛花期后160 d进行采摘,分别配制0、5、10、15、20、25 mg/L的6-BA水溶液在盆中对猕猴桃进行浸泡,每个盆里放9个猕猴桃,分别浸泡5 min。将处理后的猕猴桃每9个装入塑料薄膜袋中。马书尚等 [6]研究表明用0.06 mm厚的塑料薄膜袋包装果实,可减少果实失水,防止果实皱缩,抑制果实硬度下降。每袋放不同浓度浸泡过的猕猴桃各3个,放入冰箱中,设置温度为0 ℃,每隔15 d取样1次,进行硬度、糖度、相对电导率的测定,而后取猕猴桃果皮下2 mm下的果肉,称取3个5 g和5个1 g樣品,再用锡箔纸包裹严密将其放入液氮罐中进行冷冻,3~5 h后取出,放入冰箱冷冻室,待15和30 d取材结束后,进行其他生理指标的测定。
1.5 测定指标及方法
1.5.1 果形指数的测定。使用数显卡尺测量果实腰部最大处的横茎(mm)和果实的纵茎(mm),按以下公式计算果形指数:果形指数=纵茎/横茎。
1.5.2 果实硬度的测定。使用GY-4型果实硬度计,在果实的赤道处间隔等距离的3个位置测定硬度,计算平均值和标准偏差。
1.5.3 平均果实重量的测定。将果实放在电子天平上称量,记录果实的重量(g),计算平均果实重量。
1.5.4 可溶性固形物含量的测定。
将糖度计调零,清洁棱镜表面,滴约0.3 mL被测样液至棱镜表面,按“START”键进行测定。显示器上显示Brix值,即样品液中可溶性固形物含量,以质量分数(%)表示。重复3次,计算平均值和标准 偏差。
1.5.5 相对电导率的测定。
去皮,取2 mm厚薄猕猴桃果肉细条,用去离子水漂洗3次,加去离子水15 mL,室温下平衡 3 h,期间多次摇动试管,测定初电导率;沸水浴30 min,冷却至室温,测其终电导率;空白管添加去离子水,作为空白对照。按照以下公式计算相对电导率:
相对电导率=(初电导率-空白对照)/(终电导率-空白对照)(1)
1.5.6 叶绿素含量的测定。取1 g果肉置于研钵中,向其中加入5 mL 95%的乙醇和适量石英砂,研磨至匀浆,静置2 min再加入95%乙醇继续研磨至组织变白,静置3 min后提取。取一张滤纸,折叠后置于漏斗中,用95%乙醇润湿,沿玻璃棒将提取液倒入漏斗中,过滤到50 mL棕色容量瓶中,冲洗研钵研棒和残渣数次,最后,连同残渣一起倒入漏斗中,用乙醇溶液冲洗,直至滤纸和残渣中无绿色为止。最后,用95%乙醇溶液定容至50 mL并摇匀。
以95%乙醇溶液为空白参比调零,用1 cm光径比色皿在663和645 nm波长处分别测定提取液的吸光度,重复3次。根据Lambert-Beer定律,计算提取液中叶绿素a和叶绿素b的浓度。
Ca=12.7A 663 nm-2.69A 645 nm(2)
果实采摘后,一切生命活动均靠果实组织中一些糖类物质氧化释放出的能量来维持。由图2可知,在正常情况下猕猴桃采摘后糖度呈先快速上升后缓慢上升的变化趋势,在 0 ℃下不同浓度6-BA处理后的猕猴桃糖度呈下降趋势,在贮藏15 d时猕猴桃糖度稳定下降。这说明适宜浓度的6-BA处理对猕猴桃贮藏中糖度的上升有减缓作用。
由图3可知,随着6-BA浓度的增加,在0 d处理的猕猴桃相对电导率先下降后上升;在15 d,随着6-BA浓度的不断增加,相对电导率先上升后下降,且在6-BA浓度为5 mol/L时相对电导率达到峰值,约42%;30 d时,随着6-BA浓度的不断增加,相对电导率先上升后下降,且在6-BA浓度为15 mol/L时相对电导率达到峰值,约39%。与空白对照相比,随着不同浓度处理贮藏时间的延长,相对电导率明显降低。这说明6-BA处理对细胞膜渗透率的增加有减缓作用。
由图5可知,在同一时间不同浓度处理下,猕猴桃叶绿素含量呈现先缓慢上升后缓慢下降的变化趋势。随着贮藏时间的增加,猕猴桃叶绿素含量呈缓慢上升的变化趋势,在贮藏30 d时当6-BA浓度为25 mol/L时猕猴桃叶绿素含量相对较低。这说明6-BA处理对叶绿素含量下降有减缓作用,可抑制叶绿素的 降解。
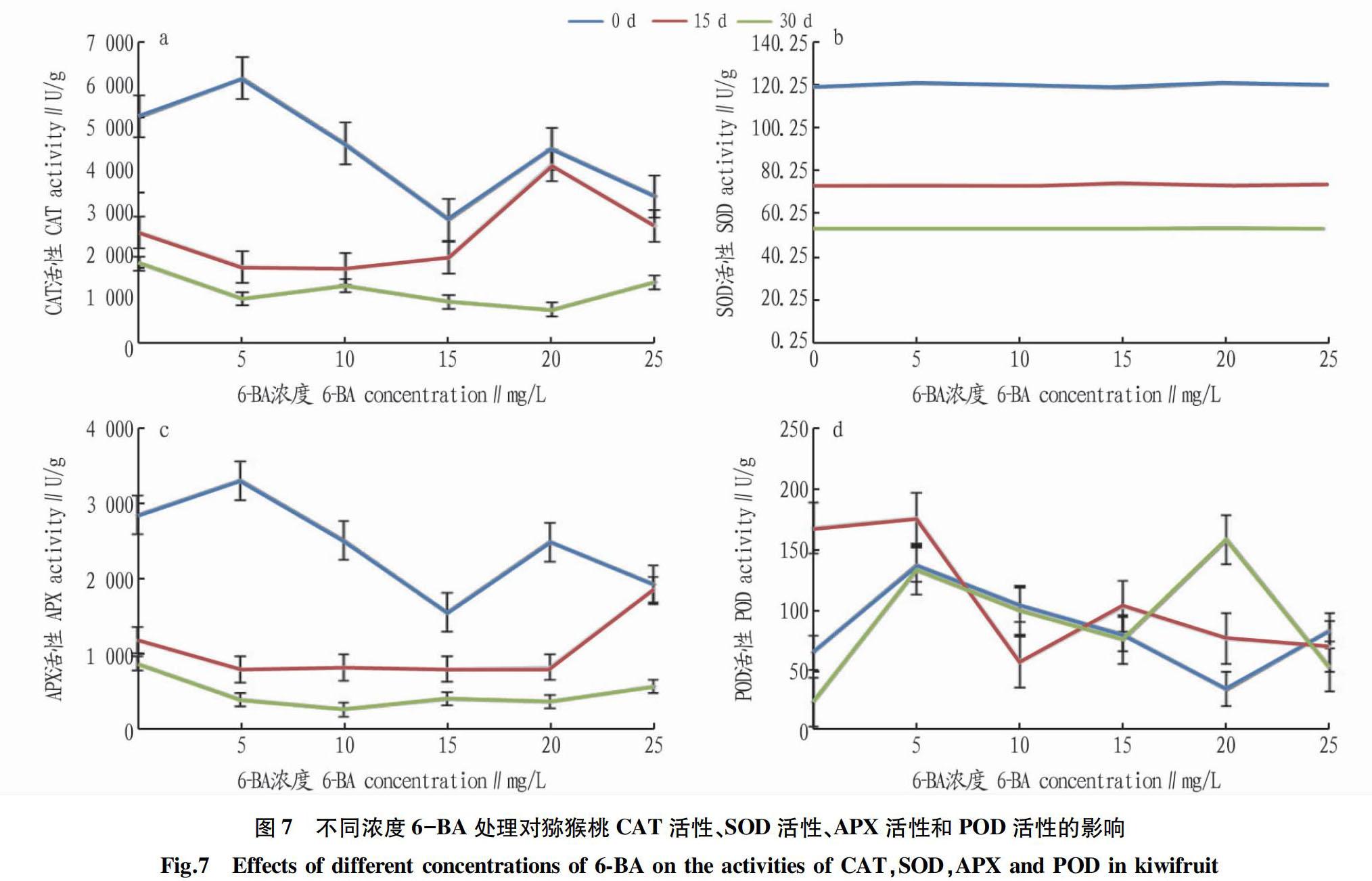
由图7a可知,随着贮藏时间的延长,猕猴桃果实内CAT活性呈降低趋势。在贮藏0 d时,CAT活性先缓慢上升后急剧下降。在贮藏15 d时,CAT活性先缓慢上升后有所下降。在贮藏30 d时,CAT活性最低,且随着6-BA浓度的增长,整体上CAT活性的变化幅度不大。这说明在贮藏前期6-BA处理抑制了CAT活性的降低。
由图7b可知,在0、15、30 d SOD活性随着不同浓度6-BA处理的变化不大,且0 d时SOD活性保持在较高水平,15、30 d时SOD活性均有所降低,说明在贮藏过程中SOD活性随着时间的延长,SOD活性有所下降。但6-BA处理总体上能显著减缓果实SOD活性的下降,保持防御活性氧或其他过氧化物自由基对细胞膜系统造成伤害的能力。
由图7c可知,在6-BA处理下,随着贮藏时间的延长,APX活性整体上呈下降趋势。在贮藏0 d时,APX活性先上升后急剧下降;在0和30 d,随着6-BA浓度的上升,APX活性先降低后稳定后上升,相较于0 d时APX活性相对较低。
在果实成熟衰老过程、抗病、抗氧化、抗逆境胁迫中,POD活性不断发生变化,它能催化过氧化氢分解,减少过氧化氢对果实细胞膜结构的伤害 [7]。由图7d可知,在贮藏过程中,随着贮藏时间的延长,POD活性呈先上升后下降而后趋于下降的变化趋势。6-BA处理减缓猕猴桃内自由基的侵害,果实保持良好状态。
3 讨论
研究表明,呼吸跃变型果实在成熟时呼吸速率等其他生理反应升高,因此未熟时采收可实现果实的长期贮藏 [8]。同时,在成熟之前对猕猴桃做相应保鲜技术处理,对后期贮藏有一定的积极作用。李东等 [9]认为采前处理保鲜技术是猕猴桃保鲜技术体系的一大有效补充,对猕猴桃的保鲜能起到十分积极的作用,值得进行推广。在果实成熟过程中叶绿素分解含量下降,可使其他种类色素如类胡萝卜素、花青素的颜色得以呈现;检测叶绿素含量体现猕猴桃果品质量。综合考虑猕猴桃自身生理特性确定采收时间,增加猕猴桃贮藏 时间。
在采收后,猕猴桃贮藏保鲜对于果农和经销商来说至关重要。而活性氧代谢快慢与高低对果实成熟与衰老起着关键性作用,活性氧在果实机体内的积累,促进了细胞膜脂过氧化,进而对细胞膜造成严重的伤害作用,导致果实软化衰老 [10]。因此,细胞膜脂过氧化的最终产物丙二醛的积累在一定程度上反映了体内活性氧含量的动态变化且对细胞具有很强的毒性 [11]。在植物组织内,CAT、SOD、APX和POD是清除活性氧的主要保护酶,果实成熟衰老过程是活性氧和抗氧化酶系统作用的过程,是活性氧代谢失调与累积的过程 [12-13]。CAT催化分解组织中的H2O2,降低H2O2产生的OH-对机体造成的危害 [14],其与POD一起作为H2O2的解毒剂,在植物代谢中起重要作用。普遍存在于果实中的SOD能作用于生物细胞中的O2,-,并通过歧化反应生成H2O2和O2,降低了O2,-对果实的侵害。APX是植物活性氧代谢中重要的抗氧化酶之一,尤其是叶绿体中清除H2O2的关键酶,又是维生素C代谢的主要酶类。POD是果实后熟衰老中的保护性酶类,它可以清除自由基,从而减少自由基对膜的损伤,达到延缓细胞衰老的目的 [15]。
6-苄基腺嘌呤作为一种细胞分裂素,可阻止植物体叶绿素、蛋白质等的降解,具有避免果实衰老起到保鲜作用。经过6-BA处理过且在0 ℃保存的獼猴桃硬度、糖度均有良好改善,对细胞膜渗透率也有减小作用,抑制其代谢速率;同时,可以降低丙二醛的积累,缓解叶绿素的降解,对各种酶活性的减弱也有所抑制作用。6-BA对猕猴桃的作用主要表现在2个方面:一方面,6-BA阻碍内源抗氧化剂的分解,保持猕猴桃果肉的活性氧的代谢平衡;另一方面,6-BA阻碍与活性氧代谢相关酶活性的下降,降低膜脂过氧化作用,减小了质膜的损伤程度,即减缓猕猴桃的生理代谢,延迟采摘后衰老的进程,对猕猴桃保鲜有一定的效果。
4 结论
笔者探讨不同浓度的人工合成的细胞分裂素(6-BA)处理对猕猴桃低温贮藏期间内部品质、感官品质及生理生化的影响。结果发现,经过6-BA处理过且在0 ℃保存的猕猴桃硬度、糖度均有良好改善,对细胞膜渗透率也有减小作用,抑制其代谢速率。同时,可以降低丙二醛的积累,减慢了叶绿素的降解,对各种酶活性的减弱也有所抑制。该方法仍有待进一步改进,以达到了解猕猴桃生长发育和成熟衰老过程和贮藏保鲜中叶绿素代谢与其生理代谢的关系,为猕猴桃采后贮藏保鲜提供理论依据和实践基础。
参考文献
[1]
王胜男,任小林,任艳.1-MCP对猕猴桃货架期品质的影响[J].西北农林科技大学学报(自然科学版),2010,38(7):149-154.
[2] RADEMACHER W.Plant growth regulators:Backgrounds and uses in plant production [J]. Journal of plant growth regulation,2015,34(4):845-872.
[3] MILI C′ B,CˇABILOVSKI R,KESEROVI C′ Z,et al. Nitrogen fertilization and chemical thinning with 6-benzyladenine affect fruit set and quality of golden delicious apples[J].Scientia horticulturae,2012,140(6):81-86.
[4] 王萌,廉华,马光恕,等.外源6-BA对甜瓜幼苗生理特性和产量形成的影响[J].现代化农业,2018(6):32-34.
[5] 杨东清,王振林,尹燕枰,等.外源ABA和6-BA对不同持绿型小麦旗叶衰老的影响及其生理机制[J].作物学报,2013,39(6):1096-1104.
[6] 马书尚,周瑗月.秦美猕猴桃自发气调贮藏技术研究初报[J].中国果树,1994(3):22-23.
[7] 吴彩娥,王文生,寇晓红.果实成熟衰老与保护酶系统的关系[J].保鲜与加工,2000(1):5-8.
[8] PICHA D H. Effects of harvest maturity on the final fruit composition of cherry and large fruited tomato cultivars [J]. Journal of the American society for horticultural science,1986,111(5):723-727.
[9] 李东,谭书明,夏之行,等.猕猴桃采前处理保鲜技术研究进展[J].食品工业,2015,36(8):251-255.
[10] 张刚,李里特,丹阳.果蔬成熟衰老中的活性氧代谢[J].食品科学,2004,25(S1):225-230.
[11] 葛培,郭广芳,晏月明.小麦抗旱机理研究进展[J].生物技术通报,2010(4):22-27.
[12] MITTLER R.Oxidative stress, antioxidants and stress tolerance[J].Trends in plant science,2002,7(9):405-410.
[13] MITTLER R,VANDERAUWERA S,GOLLERY M,et al. Reactive oxygen gene network of plants [J].Trends in plant science,2004,9(10):490-498.
[14] 袁海娜.冬瓜貯藏过程中PPO、POD和CAT活性及同功酶研究[J].食品研究与开发,2005,26(1):61-63.
[15] 任亚梅,宋小青,贺晓颖,等.猕猴桃生长过程中果肉和叶绿体的生理特性研究[J].中国食品学报,2014,14(8):116-122.

