骨髓间充质干细胞外泌体miR-190a-5p通过靶向KLF15抑制肺癌细胞迁移和侵袭
刘克强,姜晶晶,马静波,谭健,丁萌萌,张卫强,裴迎新,赵京
解放军总医院 a.第七医学中心胸外科,北京 100700;b.京西医疗区厢红旗门诊部,北京 100091
肺癌是常见肿瘤之一,是癌症相关死亡的主要原因,发病率和死亡率均居首位[1]。研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够转移到肿瘤组织[2],并通过外泌体的形式影响肿瘤组织的发生发展[3-5]。外泌体是30~150 nm大小,由膜包被的囊泡,可以运输蛋白质、脂质和核酸等物质到受体细胞。最近,BMSCs外泌体已被证明可将功能性RNA转移到受体细胞,特别是,外泌体可以携带参与癌细胞增殖、分化和凋亡的microRNA(miRNA)[6-7],且外泌体中的特异性miRNA水平升高与癌症进展有关[8-10],如BMSCs来源的外泌体miR-126-3p通过调控ADAM9的表达抑制胰腺癌的进展[11]。miR-190a-5p在各类型癌症中的作用鲜见探究,通过靶基因预测软件发现Krüppel样因子15(Krüppel-like factor15,KLF15)可 能 是 miR-190a-5p的靶基因。已知KLF15是KLFs家族中的一种转录因子,在多种类型的癌症,如肺癌[12-13]、胃癌[14]等中发挥功能,抑制KLF15表达会促进肿瘤发生[15-16]。因此,本研究探究了miR-190a-5p在肺癌细胞、BMSCs及其外泌体中的含量差异,以及BMSCs外泌体miR-190a-5p对肺癌细胞KLF15的表达调控,继而探讨对肺癌细胞迁移和侵袭的影响。
1 材料与方法
1.1 材料
肺癌细胞系 A549、LK79、H1975和 HCC827,人正常上皮细胞BEAS-2B购自中国科学院典型培养物保藏委员会细胞库;人BMSCs购自广州吉妮欧生物科技有限公司;DMEM培养基、TRIzol试剂、Super-ScriptⅡ逆转录酶试剂盒及SYBR Green Master Mix购自Thermo Fisher Scientific公司;CD63、CD9、HSP70、KLF15及 GAPDH 抗体购自Abcam公司;All-in-one miRNA qRT-PCR检测试剂盒购自GeneCopoeia公司;LipofectAMINE 2000转染试剂购自Invitrogen公司;双萤光素酶报告试剂盒购自Promega公司;PVDF膜购自Millipore公司;Transwell小室购自BD公司;化学显色剂购自Bio-Rad公司;透射电子显微镜为日立公司产品。
1.2 外泌体的分离与鉴定
待BMSCs生长融合至80%后,用PBS漂洗,再放至含有无外泌体胎牛血清的DMEM培养基中培养2 d。采用超速离心法提取外泌体[11],首先收集细胞培养液,500 r/min离心12 min去除细胞,然后5000 r/min离心30 min去除细胞碎片。将上清液通过220 nm滤膜过滤,过滤后的滤液低温超速离心2 h,取沉淀并溶解在PBS中以备后续实验使用。用透射电镜观察外泌体形态。取1 mL外泌体重悬液,用Nanosight NS300分析仪检测外泌体粒径分布,并采用蛋白印迹法检测外泌体特异性标志蛋白CD63、CD9及HSP70[17]以鉴定外泌体。
1.3 外泌体处理细胞
处理前24 h将肺癌细胞植入6孔板,当细胞生长融合至70%时,将200 μL外泌体直接添加到6孔板中,与细胞共孵育48 h,对照组加入PBS,最后收集细胞进行实验[18]。
1.4 细胞转染
转染前24 h将肺癌细胞接种于6孔板(2×105/孔),当细胞融合率达60%~80%时进行转染,按照说明书使用LipofectAMINE2000转染10 nmol/L miR-190a-5p mimics[5'-UGAUAUGUUU GAUAUAUUAGGU-3'(sense链)]、miR-190a-5p inhibitor[5'-ACCUAAUAUAUCAAACAUAUCA-3'(sense链)]。
1.5 实时荧光定量PCR(qRT-PCR)
TRIzol法提取总RNA,然后采用Super-ScriptⅡ逆转录酶试剂盒对RNA进行逆转录,采用SYBR GreenMasterMix进行qRT-PCR检测KLF15的相对含量,以GAPDH为内参。利用Allin-one miRNA qRT-PCR检测试剂盒检测miR-190a-5p 的表达,以 U6 为内参。通过 2-ΔΔCt方法将基因表达进行标准化。各基因qRT-PCR引物序列见表1。
1.6 双萤光素酶报告基因检测
将肺癌细胞接种于24孔板,24 h后与KLF15野生型或突变型的萤光素酶报告基因质粒、miR-190a-5p模拟物或对照共转染,24 h后收集细胞,用双萤光素酶报告试剂盒分析各组细胞的发光值,每组3个重复。

表1 qRT-PCR引物及序列
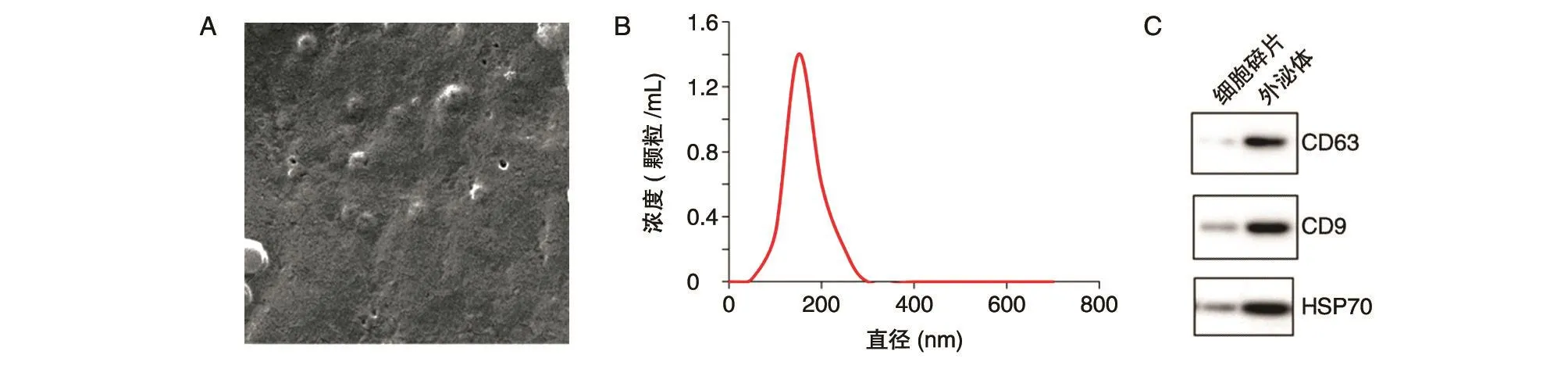
图1 BMSCs外泌体鉴定
1.7 蛋白印迹法分析
经含蛋白酶抑制剂的裂解液裂解后,11 000 r/min离心20 min,取上清加入变性缓冲液混匀,沸水浴5 min。变性蛋白样品经SDS-PAGE分离后电转到PVDF膜上,用PBST配制5%的脱脂牛奶封闭,随后加入一抗(1∶10 000)于4℃孵育过夜,TBST清洗后,用辣根过氧化物酶标记的二抗(1∶5000)孵育1 h。在膜上加入化学显色剂,反应5 min,放置在凝胶显影仪中曝光成像。
1.8 细胞迁移与侵袭实验
Transwell法检测细胞迁移。将Transwell小室放入24孔板中,上室加入2×105细胞,下室加入细胞迁移趋化物500 μL培养基,每组3个重复,在37℃、5% CO2条件下培养48 h后取出小室,DPAI染色,显微镜观察,拍照,计数。
Transwell侵袭试验是将稀释后的Matrigel基质凝胶加到上室,其余步骤与Transwell迁移实验相同。
1.9 统计学方法
应用GraphPad Prism 7进行统计学分析。计量数据以x±s表示,经S-W检验均符合正态分布。2独立组均值间差异采用t检验,3组以上的组间比较采用方差分析法(One Way ANOVA),2因素数据进行2因素检验分析,组内两两多重比较采用LSD-t检验。检验水准α=0.05(双侧)。
2 结果
2.1 BMSCs外泌体鉴定
如图1,BMSCs外泌体多呈圆形,纳米颗粒示踪分析(nanoparticle tracking analysis,NTA)表明颗粒直径多介于100~200 nm。以提取外泌体过程中得到的细胞碎片为对照,蛋白印迹法检测外泌体表面标志物CD63、CD9和HSP70,结果显示分离得到的外泌体组中3种标志蛋白均表达。
2.2 miR-190a-5p在BMSCs外泌体中高表达
图2A结果显示,4种肺癌细胞A549、LK79、H1975、HCC827中miR-190a-5p相对表达量均低于正常肺细胞BEAS-2B,差异具有统计学意义;而BMSCs中miR-190a-5p相对表达量高于肺癌细胞系和BEAS-2B,差异具有统计学意义。为了进一步检测miR-190a-5p是否存在于外泌体中,选取4肺癌细胞中miR-190a-5p表达相对最高的A549外泌体,对比正常肺细胞BEAS-2B外泌体和BMSCs外泌体,发现BMSCs外泌体中miR-190a-5p含量也明显高于BEAS-2B和肺癌细胞A549,差异均具有统计学意义(图2B)。该结果提示,miR-190a-5p在肺癌细胞中下调表达,而在BMSCs外泌体中高表达。
2.3 miR-190a-5p靶向调控KLF15表达
为了探究miR-190a-5p在肺癌中的作用机制,我们通过Targetsan预测发现KLF15可能是miR-190a-5p的作用靶基因。随后通过萤光素酶报告基因检测发现,在肺癌细胞LK79和H1975中过表达miR-190a-5p均抑制了野生型KLF15 3'UTR萤光素酶活性,差异具有统计学意义,但是对突变型KLF15 3'UTR却没有影响。进一步检测miR-190a-5p对KLF15表达的影响发现,过表达miR-190a-5p降低了肺癌细胞中KLF15的mRNA和蛋白表达水平,差异有统计学意义。该结果提示,miR-190a-5p可能通过靶向调控KLF15的表达,从而影响肺癌进展。结果见图3。

图2 miR-190a-5p在细胞及其外泌体中的表达
2.4 KLF15促进肺癌细胞的迁移和侵袭
为了探究KLF15在肺癌细胞中的功能,将shKLF15分别转染肺癌细胞LK79和H1975,肺癌细胞中KLF15的蛋白表达被抑制。Transwell结果显示,敲低KLF15抑制了肺癌细胞LK79和H1975的迁移和侵袭,也说明KLF15能够促进肺癌细胞的迁移和侵袭(图4)。
2.5 BMSCs外泌体miR-190a-5p抑制肺癌细胞迁移和侵袭
图5结果显示,BMSCs外泌体和miR-190a-5p mimics均使肺癌细胞中miR-190a-5p含量升高,抑制了KLF15的mRNA和蛋白表达,肺癌细胞迁移和侵袭细胞胞数量减少;而miR-190a-5p inhibitor能够减弱BMSCs外泌体miR-190a-5p对KLF15表达和对肺癌细胞迁移侵袭的的抑制作用。该结果提示BMSCs外泌体miR-190a-5p能够通过提高肺癌细胞中的miR-190a-5p含量,抑制KLF15表达,从而抑制肺癌细胞的迁移和侵袭。
3 讨论
作为发生率和死亡率均是世界第一的肺癌,其整体5年生存率低于18%,因此,探究肺癌新的诊断治疗策略仍至关重要。研究表明,BMSCs能够转移到肿瘤组织[2],并通过外泌体的形式影响肿瘤组织的发生发展[3-5]。miRNAs因其能够作为癌症生物标志物,以及与肿瘤发生、细胞增殖、分化和凋亡等多种生理和病理发展密切相关而备受关注[7,19-22]。本研究明确了BMSCs来源的外泌体miR-190a-5p对肺癌细胞生物学功能的影响。

图3 miR-190a-5p靶向调控KLF15表达。
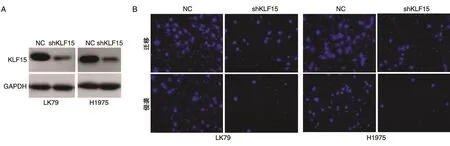
图4 KLF15促进肺癌细胞的迁移和侵袭
通过starBase在线分析,我们发现miR-190a-5p在肺癌组织中低表达,与本研究结果一致,miR-190a-5p在肺癌细胞中的表达含量低于正常肺细胞,而在BMSCs中miR-190a-5p表达含量显著高于正常肺细胞,且不同细胞外泌体中miR-190a-5p的含量检测结果与细胞检测结果一致。本研究推测BMSCs可以通过外泌体的形式运输miR-190a-5p参与肺癌细胞功能。
但miR-190a-5p影响肺癌细胞生物学功能的机制仍不清楚,因此我们通过Targetscan靶基因预测软件以及萤光素酶报告基因检测证明KLF15是miR-190a-5p的靶基因,miR-190a-5p能够靶向抑制KLF15的表达。一些研究表明,KLFs家族成员参与细胞的多种生物学功能[23-24],如细胞增殖、分化和凋亡。KLF15参与多种肿瘤发生发展,但在不同肿瘤甚至同种肿瘤中的研究结果也存在差异,如Sun等[14]发现KLF15通过上调CDKN1A/p21和CDKN1C/p57的表达来抑制胃癌细胞的增殖;Wang等[12]的研究结果显示KLF15能够抑制肺腺癌细胞生长;但也有研究显示KLF15能够促进肺腺癌细胞增殖和迁移[13]。本研究结果表明KLF15能够促进肺癌细胞的迁移和侵袭,且KLF15的表达受miR-190a-5p靶向调控。
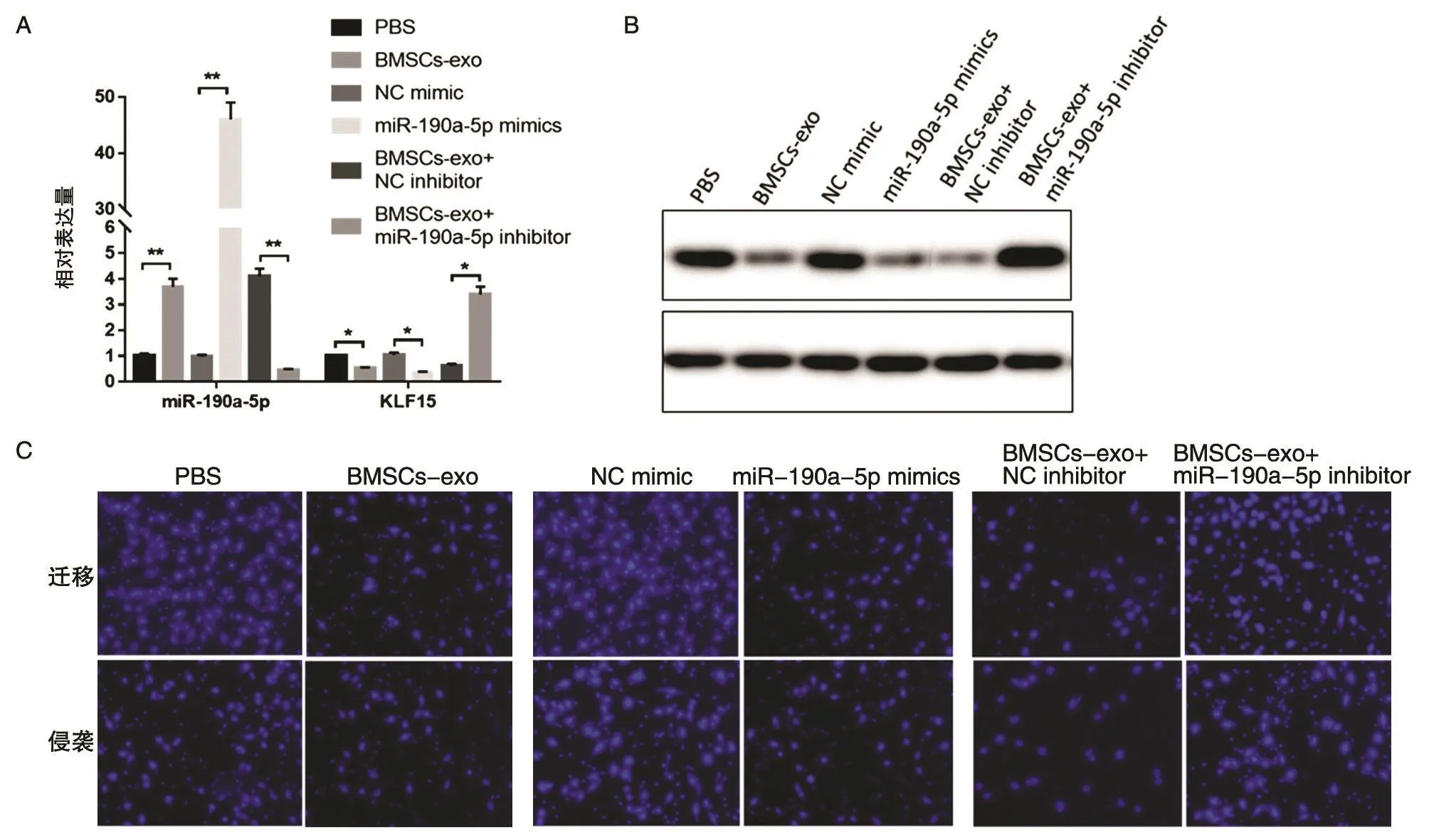
图5 BMSCs外泌体miR-190a-5p抑制KLF15的表达并促进肺癌细胞迁移和侵袭
本研究发现miR-190a-5p在BMSCs外泌体中的含量很高,为了探究BMSCs外泌体miR-190a-5p是否会影响肺癌细胞中的miR-190a-5p含量,并参与肺癌细胞的生物学功能,因此本研究将BMSCs外泌体与肺癌细胞共培养,发现BMSCs外泌体组与miR-190a-5p mimic组一样会使肺癌细胞中miR-190a-5p含量增加,抑制KLF15表达,抑制肺癌细胞的迁移和侵袭,且miR-190a-5p inhibitor能够减弱BMSCs外泌体miR-190a-5p对KLF15表达和对肺癌细胞迁移侵袭的抑制作用。因此,虽然miR-190a-5p在肺癌细胞中含量较低,但BMSCs外泌体miR-190a-5p可以提高肺癌细胞中的miR-190a-5p含量,从而抑制KLF15表达,抑制肺癌细胞的迁移和侵袭。
综上所述,BMSCs外泌体miR-190a-5p能够增加肺癌细胞中的miR-190a-5p含量,靶向抑制KLF15的表达,抑制肺癌细胞迁移和侵袭,为肺癌的诊断和治疗提供了新的思路。

