载体对固体碱催化剂1,4-丁二醇乙烯化催化性能的影响
武瑞芳,吕婷婷,王永钊,赵永祥
(山西大学 精细化学品教育部工程研究中心,山西 太原 030006)
乙烯基醚聚合物广泛用于涂料、黏合剂和聚羧酸系减水剂等领域[1-2]。工业上合成乙烯基醚主要采用以液体碱(如KOH、醇钾等)为催化剂的工艺,该工艺存在副产物多、催化剂分离困难且不可重复使用等诸多问题。创制一种绿色环保的固体碱催化剂,解决液体碱催化剂存在的不足,具有重要的理论意义与实用价值。彭春睿[1]考察了KOH/Al2O3和KOH/AC 等固体碱催化1,4-丁二醇(BDO)乙烯化合成羟丁基乙烯基醚(HBVE)反应,发现尽管KOH/Al2O3催化性能较好,但HBVE 收率也仅为7.1 %。ZrO2具有酸碱两性和氧化还原性,且热稳定性高,作为催化剂载体可与活性组分产生协同作用,对许多反应表现出优异的催化性能。张凯等[3]发现Mo/ZrO2催化剂上Mo 物种易于硫化形成MoS2活性位,因而表现出比Mo/Al2O3催化剂更优异的甲烷化催化性能。Li 等[4]将Co/Al2O3和Co/ZrO2催化剂用于费托合成,发现Co/ZrO2因具有适宜的活性组分与载体间相互作用而形成更多Co 活性物种,表现出较好的催化性能。Silvester 等[5]考察了Ni/Al2O3和Ni/ZrO2催化剂的水蒸气重整催化性能,后者因具有优异的氧化还原性而表现出更高的催化活性。目前,以ZrO2为载体的固体碱催化剂在BDO 乙烯化合成HBVE 反应中鲜见报道。
本工作采用浸渍研磨法制备了K/ZrO2和K/Al2O3固体碱催化剂,通过一系列的表征,考察了不同载体制备的催化剂结构性质与BDO 乙烯化催化性能之间的关系。
1 实验部分
1.1 主要试剂
ZrOCl2·8H2O:分析纯,上海阿拉丁生化科技股份有限公司;Al(NO3)3·9H2O:分析纯,天津大茂化学试剂厂;氨水:分析纯,上海沃凯生物技术有限公司;硝酸银:分析纯,天津光复科技发展有限公司;KOH:分析纯,国药集团化学试剂有限公司。
1.2 载体及催化剂的制备
称 取20.921 9 g ZrOCl2·8H2O 溶 于50 mL 去离子水中,在快速搅拌下将10%(φ)的氨水逐滴加到上述溶液中,调节溶液pH=9.5 后继续搅拌1 h,使它们充分反应,得到Zr(OH)4白色沉淀,室温下老化12 h,抽滤,同时用蒸馏水洗涤至滤液中检测不到Cl-为止。抽滤结束后,将沉淀物在120 ℃下干燥8 h,300 ℃下焙烧3 h,制得ZrO2载体。
称取18.395 9 g Al(NO3)3·9H2O 溶 于50 mL去离子水中,搅拌使其溶解成透明溶液,在剧烈搅拌下将10%(φ)的氨水逐滴加到上述溶液中,当溶液pH=8.5 后老化12 h,抽滤,同时用蒸馏水洗涤至滤液呈中性。抽滤结束后,将沉淀物在120 ℃下干燥8 h,300 ℃下焙烧3 h,制得Al2O3载体。
将4 g KOH 固体和16 g ZrO2载体混合均匀,加入适量的蒸馏水并充分研磨,然后在120 ℃下干燥6 h,再在500 ℃下焙烧4 h 制得KOH 负载量为20%(w)的KOH/ZrO2催化剂,标记为K/ZrO2。按同样的方法,制得KOH/Al2O3催化剂,标记为K/Al2O3。
1.3 催化剂的表征
采用德国Bruker 公司D8 Advance 型X 射线粉末衍射仪进行XRD 表征,CuKα射线,λ=0.154 06 nm,工作电压40 kV,工作电流40 mA,扫描范围2θ=10°~80°,扫描速率6(°)/min;采用美国Micromeritics 公司ASAP-2020 型物理吸附仪进行低温N2吸附-脱附表征,催化剂预先在150 ℃真空条件下脱气预处理5 h,然后在液氮浴下进行测定;采用德国Bruker 公司Tensor27 型傅里叶变换红外光谱仪对催化剂进行FTIR 表征,催化剂与溴化钾以质量比为1∶100 混合,研磨制片,室温下进行测定,分辨率4 cm-1;采用德国NETZSCH 公司STA449C 型热重分析仪进行催化剂的TG 表征,将8 mg 催化剂放入坩埚中,以10 ℃/min 的升温速率从35 ℃升至800 ℃,载气为高纯N2,流量为60 mL/min;采用ESCALAB 公司250Xi 型光电子能谱仪进行XPS 表征,使用AlKα射线(hν=1 486.6 eV),结合能以碳的C1s的结合能284.8 eV 为基准进行校正;采用Varian 公司710ES 型电感耦合等离子体原子发射光谱(ICP-AES)仪确定反应滤出液中K+的浓度,平行测定3 次,结果取平均值;采用美国Micromeritics 公司Autochem Ⅱ2920 型化学吸附仪进行CO2-TPD 表征,将0.1 g 催化剂(40 ~60 目)置于反应管中,先升温至300 ℃,N2处理1 h,然后降温至50 ℃,将N2切换为高纯氦气,流量30 mL/min,同时采用脉冲法多次注入CO2至催化剂吸附饱和,以10 ℃/min 的升温速率升至700 ℃,TCD 检测,以未进行CO2吸附的催化剂升温过程检测的信号为背景。
1.4 催化性能测试
在装有温度计、导气管与冷凝管的三口烧瓶中加入3 g 催化剂和20 g BDO,启动磁力搅拌器,搅拌转速为400 r/min,同时通入N2并开始加热,N2流量为30 mL/min,待反应温度升至150 ℃时,将N2切换为乙炔,调节乙炔气体流量为40 mL/min。反应9 h 后,停止加热,将乙炔切换为N2进行保护降至室温。为降低实验误差,每个催化剂上催化性能测试平行做3 次,结果取平均值。
1.5 反应产物HBVE 的定量分析
采用Agilent 公司7890B 型气相色谱仪进行试样分析,柱型为OV1701,气化温度为240 ℃,检测温度为240 ℃;柱室温度为初温80 ℃,保温3 min,升温速率为20 ℃/min,终温为220 ℃;进样量0.02 μL;归一化法定量分析。
2 结果与讨论
2.1 催化剂的XRD 表征结果
图1a 为载体及对应催化剂的XRD 谱图。由图1a 可 知,Al2O3在2θ=14.3°,28.5°,37.6°,39.3°,46.2°,67.3°处出现峰形相对宽化的衍射峰,分别归属于γ-Al2O3的(111),(220),(311),(222),(400),(440) 晶 面(JCPDS No.10-0425)。与载体Al2O3相比,K/Al2O3催化剂中Al2O3的衍射峰强度有所减弱,表明结晶度降低。这说明催化剂中KOH 并不是简单地负载在Al2O3载体表面,而是与Al2O3发生了相互作用,Al2O3结构被KOH 破坏,从而导致结晶度有所降低。值得注意的是,K/Al2O3催化剂在30°~33°区间内出现了新的非常弥散的衍射峰,可归属于K—O—Al 物种的特征衍射峰[6],说明焙烧过程中,催化剂上部分KOH 与载体Al2O3相互作用形成了KAlO2物种。载体ZrO2仅在2θ=31°处出现了一个微弱的衍射峰,表明ZrO2以无定形态存在。与ZrO2相比,K/ZrO2催化剂在2θ=30.3°,35.5°,50.9°,59.6°,62.2°处出现了明显的衍射峰,分别归属为四方相ZrO2的(011),(110),(020),(013),(211)晶面(JCPDS No.17-0923)[7]。可见,K/ZrO2催化剂经500 ℃焙烧后载体由无定形态转变为四方相。四方相ZrO2的形成使得KOH 与ZrO2载体的相互作用难以体现。图1b 给出了经500 ℃焙烧后ZrO2载体(500-ZrO2)的XRD 谱图。由图1b 可知,500-ZrO2晶体结构亦呈四方相,但K/ZrO2催化剂中四方相ZrO2的特征衍射峰明显减弱,同时峰位置有所偏移,原因同样是由于焙烧过程中KOH 与ZrO2发生相互作用,且部分K+进入ZrO2晶格。K/ZrO2催化剂的XRD 谱图中未观察到类似于KAlO2的新物相,这是由于ZrO2固有空位结构小于γ-Al2O3,因此推测只有部分K+嵌入ZrO2载体表面的空位中形成了K—O—Zr 物种[8]。此外,K/ZrO2和K/Al2O3催化剂的XRD 谱图中均未检测到KOH 的特征衍射峰,这表明未进入载体晶格的KOH 物种高度分散于载体表面。
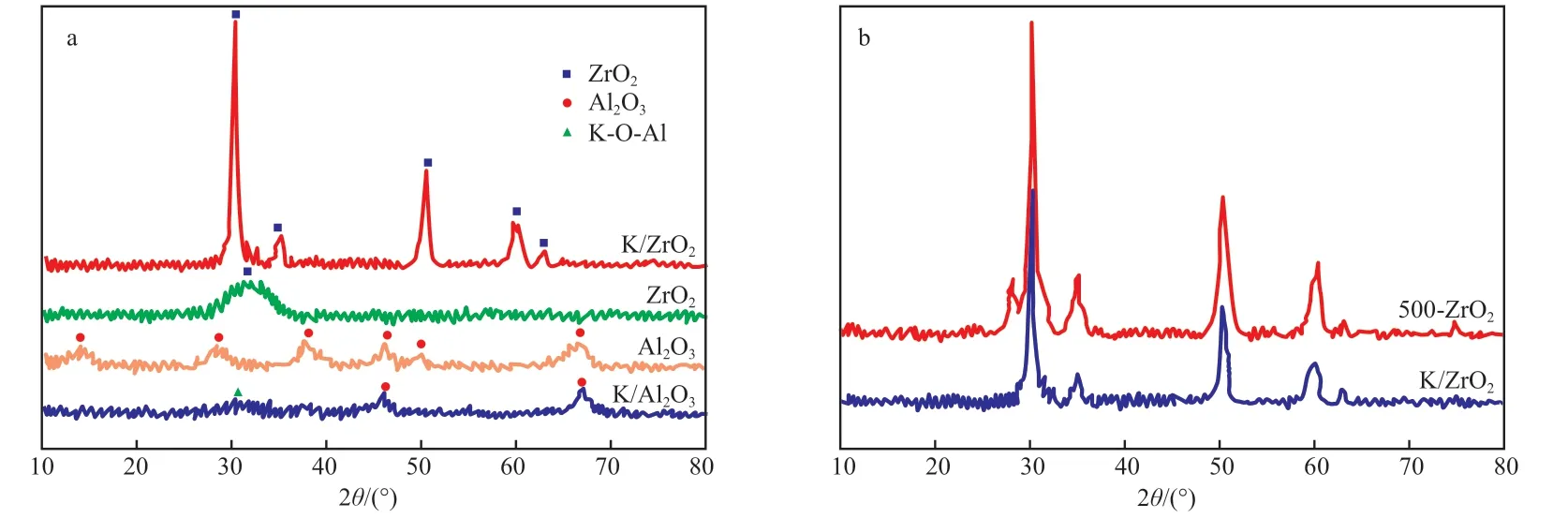
图1 载体和催化剂的XRD 谱图Fig.1 XRD patterns of supports and catalysts.
2.2 催化剂的N2 吸附-脱附表征结果
表1 为载体及催化剂的织构性质。由表1 可知,载体的比表面积差别较大,其中ZrO2的比表面积为142 m2/g,而Al2O3的比表面积则高达345 m2/g。与载体相比,在负载KOH 后,催化剂的比表面积均显著降低。K/Al2O3的比表面积从345 m2/g 急剧下降到54 m2/g,而K/ZrO2的比表面积也仅有8 m2/g。同时,催化剂的孔体积也明显减小,但平均孔径却增大。这主要是由于一方面在催化剂制备过程中,负载的KOH 分布在载体表面以及孔道中,堵塞了载体中原有的部分孔道;另一方面为了更好地形成稳定的碱性位点,催化剂的焙烧温度相比载体进一步提高,更高的焙烧温度引起载体不同程度的烧结和部分孔道坍塌;此外,根据XRD 表征结果可知,KOH 的强碱性对载体结构,尤其是Al2O3载体结构也造成了一定的破坏。
2.3 FTIR 表征结果
图2 为K/Al2O3和K/ZrO2催 化 剂 的FTIR 谱图。由图2 可知,K/Al2O3催化剂在3 430 cm-1处附近出现了明显的红外吸收峰,这归因于催化剂表面物理吸附水及自身表面—OH 的伸缩振动[8]。1 630 cm-1处出现的吸收峰是由H—O 键弯曲振动所致[9]。1 526 cm-1处的吸收峰归属于Al2O3垂直纵向声子吸收振动[10],1 384 cm-1处的吸收峰归属于配位羟基的吸收峰[8]。此外,在757,584 cm-1处出现的红外吸收峰归属于Al—O 键的振动[11]。K/ZrO2催化剂在3 430,1 630,1 384 cm-1处也分别出现了红外吸收峰,同样是由催化剂表面物理吸附水和表面羟基的伸缩振动、弯曲振动引起的。500 ~1 000 cm-1之间出现的红外吸收峰归属于四方相ZrO2中Zr—O 键的伸缩振动[12-13],这与XRD 表征结果相一致。与K/Al2O3相比,K/ZrO2催化剂在3 430 cm-1处附近的吸收峰强度显著减小,可见K/ZrO2催化剂上的吸附水和表面羟基数量少于K/Al2O3催化剂。

表1 载体和催化剂的织构性质Table 1 Texture properties of the supports and catalysts

图2 催化剂的FTIR 谱图Fig.2 FTIR spectra of the catalysts.
2.4 TG 表征结果
图3 为K/Al2O3和K/ZrO2催化剂的TG 曲线。由图3 可知,K/ZrO2催化剂在整个升温过程中失重缓慢,且失重速率较为均匀,总失重率为8.22%。35 ~115 ℃区间的失重率为2.32%,这主要是由催化剂表面吸附水的逐渐脱除引起的。115 ~260℃区间失重率为3.35%,这可归因于部分结合水在这一阶段的脱除。在260 ~600 ℃区间内,随着温度的不断升高,TG 曲线失重更为缓慢,质量损失约为2.55%,可归因于催化剂表面Zr—OH 的脱除。结合XRD 表征结果,该过程中KOH 与ZrO2产生了较强的相互作用,部分K+进入了ZrO2表面空位中形成了K—O—Zr。600 ℃以上K/ZrO2催化剂的TG 曲线基本不再发生变化。与K/ZrO2催化剂相比,K/Al2O3催化剂在整个升温过程中持续失重且失重较为明显,总失重率高达20.3%,远高于K/ZrO2催化剂在相应温度区间内的失重。200 ℃前的失重归因于催化剂表面吸附与结合水的脱除,质量损失率为5.94%,340 ~700 ℃的质量损失率为9.25%,这是催化剂表面Al—OH 脱除造成的。可见,K/Al2O3催化剂更高的失重率表明结构中含有更多的物理吸附水和表面—OH,这与FTIR 结果一致。

图3 催化剂的TG 曲线Fig.3 TG curves of the catalysts.
2.5 XPS 表征结果
图4 为K/Al2O3和K/ZrO2催化剂的O1sXPS 谱图。由图4 可知,经分峰拟合,催化剂在528.8 ~529.2 eV,529.9 ~530.9 eV 和531.7 ~531.9 eV 范围内均出现了3个峰,分别归属于表面晶格氧(Oα)、表面吸附氧(Oβ)和吸附羟基与表面吸附水中的氧物种(Oγ)[14]。与K/Al2O3催化剂相比,除吸附羟基和表面吸附水中的氧物种外,K/ZrO2催化剂上其他两类氧物种的O 1s结合能明显降低,表明该催化剂上氧物种的电荷密度高于K/Al2O3催化剂[15]。这是由于两种催化剂中形成了K—O—Zr 或K—O—Al物种,前者结构中Zr4+的电负性比后者结构中Al3+的电负性小,导致与它们相邻的氧物种电荷密度较高。此外,根据峰面积计算出Oγ占整个氧物种数量的比值Oγ/(Oα+Oβ+Oγ),K/Al2O3催化剂上Oγ所占的比例(0.19)明显高于K/ZrO2(0.13),可见,K/Al2O3催化剂表面含有更多的吸附羟基和表面吸附水,这与FTIR 和TG 表征结果一致。

图4 催化剂的O1s XPS 谱图Fig.4 XPS spectra of O1s over the catalysts.
2.6 CO2-TPD 表征结果
图5 为K/Al2O3和K/ZrO2催化剂的CO2-TPD曲线。CO2脱附温度区间可分为3 个阶段:50 ~200 ℃,200 ~400 ℃,400 ~600 ℃,各阶段产生的脱附峰(Ⅰ~Ⅲ)分别对应于弱碱性、中强碱性以及强碱性位点。由图5 可知,K/Al2O3催化剂在79 ℃和173 ℃处出现了两个强弱不同的CO2脱附峰,均归属于Al2O3载体表面的弱碱性位点[16],301 ℃处的脱附峰则可归属于催化剂表面的中强碱性位点。K/ZrO2催化剂分别在103 ℃和192 ℃处出现了一个小的尖峰和一个不对称的弱峰,均归属于载体ZrO2表面的弱碱性位点[17],在400 ~600℃之间有一个宽而强的CO2脱附峰,归属于催化剂表面的强碱性位点[18]。

图5 催化剂的CO2-TPD 曲线Fig.5 CO2-TPD curves of the catalysts.
进一步通过对CO2-TPD 曲线上各脱附峰面积进行定量分析,表2 给出了两种催化剂上不同碱性位点数量和对应的碱性位密度。由表2 可知,K/Al2O3催化剂表面存在弱碱性位和中强碱性位,位点数量分别为67.4,158.3 μmol/g,对应的碱性位密度分别为1.2,2.9 μmol/(g·cm2),未出现强碱性位点。K/ZrO2催化剂表面存在弱碱性位和强碱性位,位点数量分别为64.8,160.4 μmol/g,对应的碱性位密度分别为8.1,20.1 μmol/(g·cm2),未出现明显的中强碱性位。可见,虽然两种催化剂上总碱性位点数量差别不大,但与K/Al2O3催化剂相比,K/ZrO2催化剂具有更高的碱强度,且表面总碱性位密度约为K/Al2O3的7 倍。结合催化剂O 1s的XPS 表征结果可知,由于Zr4+的电负性比Al3+的电负性小,导致周围O2-上的电子云密度更高,因此K/ZrO2催化剂碱性更强,且碱性位密度更高[18]。

表2 催化剂表面不同碱性位点的数量及碱性位密度Table 2 The number and density of different basic sites on the catalyst surface
2.7 催化性能评价结果
图6 为K/Al2O3和K/ZrO2在BDO 乙烯化反应中的催化性能。

图6 催化剂的BDO 乙烯化催化反应性能Fig.6 Catalytic performance of the catalysts for 1,4-butanediol(BDO) vinylation.Reaction conditions:m(catalyst)∶m(BDO)=0.15,150 ℃,acetylene flow rate 40 mL/min,stirring speed 400 r/min.HBVE:hydroxybutyl vinyl.
由图6 可知,K/Al2O3催化剂上产物HBVE 收率较低,3 次平行实验结果平均仅为0.76%;在相同反应条件下,K/ZrO2催化剂上HBVE 收率平均高达35.91%。此外,文献[1]曾报道活性炭和4A分子筛负载KOH 催化BDO 乙烯化反应,在相近的反应条件下,HBVE 的收率分别为0.1%和1.8%。与Al2O3、活性炭以及4A 分子筛等载体相比,以ZrO2为载体负载KOH 制得的K/ZrO2催化剂对BDO 乙烯化合成HBVE 反应具有更高的催化性能。
2.8 操作参数对K/ZrO2 催化剂催化性能的影响
2.8.1 催化剂用量的影响
图7 为催化剂用量对K/ZrO2催化剂BDO 乙烯化催化性能的影响。由图7 可知,m(催化剂)∶m(BDO)=0.05 时,HBVE 收率仅为5.98%,这是由于催化剂用量少,催化剂的活性中心数量较少,造成HBVE 收率偏低。随着催化剂用量的增加,活性中心的绝对数量随之增加,HBVE 收率也呈现上升趋势。当m(催化剂)∶m(BDO)=0.15 时,HBVE 收率为35.91%。而当m(催化剂)∶m(BDO)由0.15 进一步提高至0.25 时,HBVE 收率没有得到明显提高。因此,取催化剂用量m(催化剂)∶m(BDO)=0.15 最适宜。

图7 催化剂用量对HBVE 收率的影响Fig.7 The effect of catalyst dosage on the yield of HBVE.Reaction conditions:150 ℃,acetylene flow rate 40 mL/min,stirring speed 400 r/min.
2.8.2 反应温度的影响
图8 为反应温度对K/ZrO2催化剂BDO 乙烯化催化性能的影响。由图8 可知,HBVE 选择性随反应温度升高变化较大。当反应温度为130 ℃时,BDO转化率6.1%,HBVE 选择性高达99.8%(HBVE 收率仅为6.09%)。随反应温度上升,BDO 转化率明显增大,但HBVE 选择性几乎不变。当反应温度超过150 ℃时,BDO 转化率增长趋势缓慢,此时HBVE 选择性开始骤降,导致HBVE 收率也逐渐下降。这是由于BDO 乙烯化为放热反应,过高的反应温度不仅不利于反应的进行,同时还导致了副反应的发生。因此,取反应温度为150 ℃最适宜。
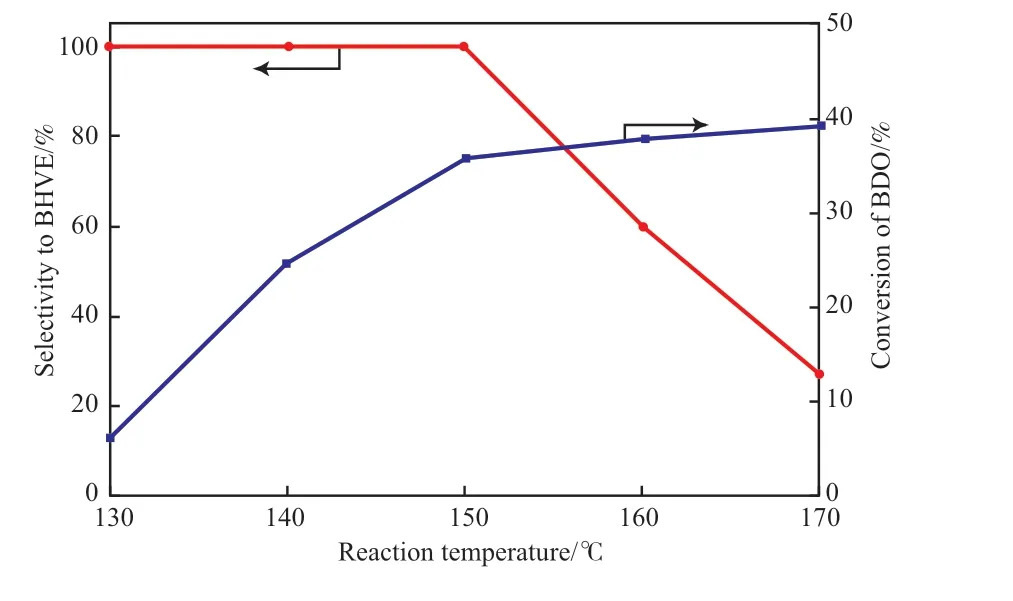
图8 反应温度对HBVE 选择性的影响Fig.8 The effect of reaction temperature on the selectivity to HBVE.Reaction conditions:m(catalyst)∶m(BDO)=0.15,acetylene flow rate 40 mL/min,stirring speed 400 r/min.
2.8.3 乙炔流量的影响
图9 为乙炔流量对K/ZrO2催化剂BDO 乙烯化催化性能的影响。由图9 可知,当乙炔流量为10 mL/min 时,HBVE 收率低于10%,这是由于较低流量下单位时间内提供的参与反应的乙炔量较少。随着乙炔流量的增加,HBVE 收率逐步提高,当乙炔流量为40 mL/min 时,HBVE 收率为35.91%。继续提高乙炔流量对HBVE 收率影响甚微。因此,取乙炔流量为40 mL/min 最适宜。

图9 乙炔流量对HBVE 收率的影响Fig.9 The effect of acetylene flow rate on the yield of HBVE.Reaction conditions:m(catalyst)∶m(BDO)=0.15,150 ℃,stirring speed 400 r/min.
2.9 催化剂使用稳定性测试结果
图10为K/ZrO2催化剂的稳定性。由图10可知,新鲜K/ZrO2催化剂首次使用时,HBVE 收率较高,可达35.91%。当第2 次使用时,HBVE 收率下降至23.36%,推测原因为由于负载在ZrO2载体表面的部分K 物种与载体相互作用较弱,在首次反应过程中发生了流失。为了证实这一点,对反应滤出液进行ICP-AES 测试,结果表明K+质量浓度为7.4 mg/mL。从第2 次及此后几次的催化性能评价结果可以看出,随着使用次数的增加,HBVE 收率基本保持稳定,同时对每次的反应滤出液进行ICPAES 测试发现,几乎都不含K+。当重复使用5 次后,K/ZrO2催化剂上HBVE 收率仍达21.65%,表现出较高的重复使用稳定性。

图10 K/ZrO2 催化剂的稳定性Fig.10 The stability of the K/ZrO2 catalyst.Reaction conditions referred to Fig.6.
综上所述,与K/Al2O3催化剂相比,K/ZrO2催化剂具有较低的比表面积和孔体积。两种催化剂中均形成了部分K—O—Al 或K—O—Zr 结构,除了弱碱性位点外,K/ZrO2表面还存在大量的强碱性位点,而K/Al2O3催化剂表面仅存在大量的中强碱性位点,且碱性位密度远低于K/ZrO2。结合两种催化剂的BDO 乙烯化催化反应性能可知,对于K/Al2O3和K/ZrO2催化剂而言,比表面积不是影响催化性能的主要因素,表面碱性强弱与碱性位密度是影响该反应的决定性因素。K/ZrO2催化剂表面强碱性位点的存在以及较高的碱性位密度使其在BDO 乙烯化催化反应中表现出优异的催化性能。结合催化剂的使用稳定性测试可知,K/ZrO2催化剂不仅具有高的催化活性,还具有较优的使用稳定性,是一种性能优良的固体碱催化剂。
3 结论
1)利用沉淀法制备了Al2O3和ZrO2载体。KOH高度分散在两种载体上,并部分形成了K—O—Al或K—O—Zr 结构。除弱碱性位点外,K/Al2O3表面仅存在中强碱性位点,而K/ZrO2表面则生成了大量的强碱性位点,表面总碱性位密度约是K/Al2O3的7 倍。
2)在相同的反应条件下,K/ZrO2催化剂的BDO 乙烯化催化活性远高于K/Al2O3催化剂。催化剂的比表面积高低不是影响催化性能的主要因素,表面碱性强弱以及碱性位密度是决定该反应的关键因素。
3)KOH 的负载量为20%(w),在m(催化剂)∶m(BDO)=0.15、反应温度150 ℃、乙炔流量40 mL/min 时,K/ZrO2催 化 剂 上HBVE 收 率 高 达35.91%。重复使用5 次后,K/ZrO2催化性能保持稳定,是一种性能优良的固体碱催化剂。

