耐草甘膦转EPSPS/GAT大豆多重PCR检测体系的建立及应用
文静,郭勇,邱丽娟
(1东北农业大学农学院,哈尔滨150030;2中国农业科学院作物科学研究所/国家农作物基因资源与遗传改良重大科学工程/农业部作物种质资源与生物技术重点开放实验室,北京100081)
0 引言
【研究意义】自1994年第一个商业化的转基因植物(FlavrSavr tomato)被批准上市以来,植物基因工程技术在现代农业中得到了广泛的应用[1]。目前已有24个国家/地区种植了转基因作物,42个国家/地区进口转基因作物用于粮食、饲料和加工。全球转基因作物的种植面积从1996年的170万hm2增加到2018年的1.917亿hm2,增长了113倍,而转基因大豆作为种植面积最大的转基因作物,种植面积达到全球转基因作物种植面积的 50%[2]。随着转基因作物产业化和商业化程度的不断扩大,全球对转基因食品安全、环境风险和伦理问题的争议加剧[3],越来越多的国家和地区要求对转基因食品和成分进行标识[4]。部分国家要求转基因生物(genetically modified organism,GMO)含量需要低于一定阈值水平的限制。例如,欧盟将非转基因背景下的转基因物质的阈值设定为0.9%[5]。因此,标准化的转基因成分检测和鉴定方法是转基因发展和商业化的关键步骤,也在转基因生物的安全评估和风险管理中发挥了重要作用[6]。现有的转基因检测方法大多基于聚合酶链反应(polymerase chain reaction,PCR),并由于其具有通用性、敏感性、特异性和高通量的特点,可用于复杂转基因成分分析,包括筛查外源调控元件和目的基因,并对特定的转基因成分进行鉴定[7]。多重PCR技术是在同一个PCR反应体系中加入多对特异性引物,实现对多个靶标的扩增,更能节省转基因生物检测中时间和成本[8-9]。【前人研究进展】吕山花等[10]应用PCR检测方法,以大豆凝集素(lectin)基因为内参,检测了4个抗草甘膦转基因大豆品种及草甘膦敏感大豆品种豫豆12的外源CaMV35S启动子、NOS终止子和CP4-EPSPS成分。目前,中国允许进口的转基因大豆有 16种(具体包括 A2704-12、CV127、MON87701、MON87769、GTS40-3-2、MON87708、305423、A5547-127、FG72、MON89788、SYHT0H2、MON87701×MON89788、DAS-44406-6、305423×GTS40-3-2、MON87705 和 356043,其中 MON87701×MON89788和305423×GTS40-3-2为复合性状转基因大豆),农业部针对这些转基因大豆品系发布的检测方法以核酸检测为主,但是其方法均为单重 PCR检测。针对转基因大豆建立系统的、高通量的由“公共引物”介导的多重PCR转基因大豆检测体系,可大幅降低检测成本、提高检测效率,为转基因安全评价提供新的检测技术和方法[11]。多重PCR检测体系并不是多个单重 PCR体系检测体系的简单叠加,它需要对PCR体系和程序进行反复试验、优化和验证,保证多重PCR具有足够的特异性、灵敏性和适用性,最终实现多个目标片段的同时扩增,因此,与普通PCR相比,难度更大[12]。近年来,国内外有诸多学者对其进行研究,并建立了许多关于通用元件、基因特异性和转化事件特异性的多重PCR检测体系[8,13-16]。尹全等[17]以抗草甘膦大豆GTS40-3-2的通用元件作为检测参数,建立了大豆内源基因lectin、CaMV35S启动子、NOS终止子和CP4-EPSPS的四重PCR检测体系。AO等[18]根据外源基因的特异性建立了适用于转基因大豆、玉米、水稻中CP4-EPSPS、Cry1A(b)、BAR、PAT检测的多重PCR方法。KIM等[19]针对RRS、GTS40-3-2、A2704-12、DP356043-5、MON89788、A5547-127 和DP305423-1 6个商业化转基因大豆特异性事件,建立了包含内参基因的七重PCR检测体系。付伟等[20]以转基因大豆 DAS44406-6品系为研究对象,利用Multiplex PCR技术与其他技术相结合,建立了多重实时荧光PCR检测体系,检测灵敏度为0.01%。【本研究切入点】目前,大多数转基因大豆的多重PCR技术都是针对通用元件和基因特异性进行检测,或者针对多个商业化特异性转化事件进行筛选,而单一转化事件特异性鉴定鲜见报道[21]。在转基因生物检测中,转化事件特异性检测的目标片段是外源基因和宿主DNA之间的连接区域,故比单纯基因特异性检测和通用元件检测具有更高的特异性[22-23]。【拟解决的关键问题】本研究基于转基因成分检测技术及要求,以转基因大豆 ZH10-6为研究对象,针对内参基因、外源基因和侧翼序列设计 5对特异性引物,构建了转EPSPS/GAT大豆ZH10-6多重PCR反应体系,并用本研究建立的多重 PCR检测体系检测了ZH10-6的 11个衍生品系,为中国抗草甘膦转基因大豆新品种目标基因鉴定提供信息和方法。
1 材料与方法
1.1 试验材料
转基因大豆ZH10-6、受体中黄10及11个ZH10-6衍生品系均为中国农业科学院作物科学研究所大豆基因资源挖掘与利用实验室保存样品。
1.2 样品基因组DNA的提取
参照植物基因组提取试剂盒说明书提取样品DNA,用紫外分光光度计测量DNA样品质量及浓度,并用1×TE缓冲液将DNA 稀释至50 ng·μL-1。
1.3 引物的设计及筛选
使用软件 Primer Premier 5.0 进行引物设计,设计时遵从多重PCR检测引物设计与筛选的原则,根据抗草甘膦大豆 ZH10-6和受体中黄 10的分子特征,设计大豆内源参考基因(Actin)、外源基因(G2-EPSPS和GAT)以及侧翼序列(G2EPSPS-2/ZH10P2和ZH10P1/GAT-2)的特异性引物(表1)。将各个检测基因的上、下游引物使用灭菌的超纯水稀释为10 μmol·L-1。

表1 多重PCR标记及其相关信息Table 1 The markers for multiplex PCR and their related information
1.4 引物特异性和适用性检测
单重 PCR 反应体系为 25 μL,包括 DNA 2 μL(50 ng·μL-1)、Ex Taq 酶 0.2 μL、10×ExTaq Buffer 2.5 μL、dNTP 2 μL、引物(10 μmol·L-1)0.6 μL 和ddH2O 17.7 μL。
多重 PCR 反应体系为 25 μL,包括 DNA 2 μL(50 ng·μL-1)、Ex Taq 酶 0.2 μL、10×ExTaq Buffer 2.5 μL、dNTP 2 μL、引物(10 μmol·L-1,GmActin11 F/R 0.6 μL、G2-EPSPS F/R 0.6 μL、GAT F/R 0.6 μL、ZH10P1/GAT 0.6 μL、G2/ZH10P2 0.6 μL)和 ddH2O 15.3 μL。
单重和多重 PCR 反应程序为 95℃ 5 min;95℃ 30 s,58℃ 30 s,72 ℃ 1 min20 s 35个循环;72℃ 8 min;4℃保存。
用1%琼脂糖凝胶电泳检测多重PCR产物,并利用凝胶成像系统观察。
1.5 多重PCR反应体系和程序的优化
以转基因大豆ZH10-6和受体中黄10的DNA为模板,将 5对引物的用量设置为 GmActin11 F/R 0.4 μL、G2-EPSPS F/R 0.6 μL、GAT F/R 0.4 μL、ZH10P1/GAT 0.6 μL 和 G2/ZH10P2 0.6 μL,DNA 模板量设置为100、150、200和250 ng 4个梯度,退火温度设置为55℃、58℃和60℃,延伸温度设置为 68℃和 72℃ 2 个梯度,dNTP 含量为 2、3、4 和 5 μL 4 个梯度,分别进行多重PCR扩增,筛选出五重PCR体系的最优反应条件。
1.6 多重PCR灵敏度检测
为了验证多重PCR体系灵敏性,将相同浓度的转基因大豆ZH10-6和受体中黄10的基因组DNA按质量比混合,制备成100%、50%、10%、5%、1%、0.5%、0.1%和0的DNA样品。使用1.5建立的多重PCR体系及程序进行多重PCR方法灵敏度检测。
1.7 多重PCR体系的应用
用建立的多重PCR体系对转基因大豆ZH10-6衍生品系进行检测,包括东北地区和黄淮地区材料,进一步验证多重PCR体系的实用性。
2 结果
2.1 样品 DNA 检测
使用NanoDrop 2000/2000c超微量分光光度计测定样品DNA浓度和质量,经测定,样品OD260/OD230比值均为 2.0—2.2,OD260/OD280比值均为 1.8—2.0,说明提取的样品DNA质量较好。用1%琼脂糖凝胶电泳对DNA样品进行检测,仅1号样品第三条带有降解,该样品不在后续试验中使用,其余样品几乎无降解,符合多重PCR试验要求(图1)。将样品DNA浓度稀释至 50 ng·μL-1,备用。

图1 1%琼脂糖凝胶电泳DNA检测结果Fig. 1 DNA detection results of 1% agarose gel electrophoresis
2.2 引物特异性和适用性检测
以转基因大豆ZH10-6和受体中黄10的DNA为模板进行5对引物特异性和适用性检测。单引物扩增时,5对引物均可在目的位置处观察到特异性条带,未观察到明显的非特异性条带。5对引物同时扩增时,转基因大豆 ZH10-6可以扩增出多条特异性条带,但个别条带相对微弱(图2),表明这5对引物可以用于多重PCR区别ZH10-6和受体中黄10,但是需要进一步调整扩增条件。
2.3 多重PCR检测体系的建立
多重PCR体系中,将5对引物用量均设置为0.6 μL时,部分条带不能被扩增(图2)。可以看出在多重PCR中,引物存在强弱之分,需要减少相对较强引物GmActin11 F/R和GAT F/R的用量。以条带亮度作为参考,最终将5对引物的用量设置为GmActin11 F/R 0.4 μL、G2-EPSPS F/R 0.6 μL、GAT F/R 0.4 μL、ZH10P1/GAT 0.6 μL 和 G2/ZH10P2 0.6 μL。将 DNA模板量、退火温度、延伸温度和dNTP含量均设置为不同梯度,进行同时扩增(图3),筛选多重PCR最适温度和体系。
通过不同体系检测(图4),多重PCR扩增最适体系为:DNA 2—4 μL、Ex Taq 0.2 μL、10×ExTaq Buffer 2.5 μL、dNTP 2 μL、引物(GmActin11 F/R 0.4 μL、G2-EPSPS F/R 0.6 μL、GAT F/R 0.4 μL、ZH10P1/GAT 0.6 μL 和 G2/ZH10P2 0.6 μL),ddH2O补足 25 μL。多重 PCR 扩增最适程序为 95℃ 5 min;95℃ 30 s,60℃ 30 s,68 ℃ 1 min20 s ,35个循环;72 ℃ 1 2 min;4℃保存。最终扩增产物长度为内参基因 126 bp、外源基因G2-EPSPS430 bp、外源基因GAT338 bp、侧翼序列 ZH10P1/GAT-2 810 bp、侧翼序列 G2EPSPS-2/ZH10P2 1 626 bp。其中,受体中黄10除了可以扩增出Actin内参序列以外,还可以扩增出ZH10-6 2对侧翼序列的上游引物ZH10P1和下游引物ZH10P2的632 bp片段,而在ZH10-6中,由于插入外源基因过大,此段序列无法被扩增出。因此,受体中黄 10可以被扩增出 2条带,而转基因材料ZH10-6可以被扩增出 5条带,此体系可以用于鉴定ZH10-6和受体中黄10。
2.4 多重PCR体系灵敏度检测
将模板DNA稀释至设定浓度,通过多重PCR灵敏度试验(图5),随着受体中黄10质量分数的上升,特异性片段632 bp的条带逐渐变亮,而ZH10-6的5条带则出现不同程度的减弱,特别是外源基因G2-EPSPS的 430 bp条带和侧翼序列 G2EPSPS-2/ZH10P2为1 626 bp条带。因为在转基因大豆ZH10-6和非转基因大豆中黄 10混合后,相对于原有的多重PCR体系中增添了一重PCR反应。灵敏度是非转基因样品中转基因成分的最低检测限,虽然图5转外源基因G2-EPSPS的430 bp条带和侧翼序列G2EPSPS-2/ZH10P2为1 626 bp条带相比于其他条带较弱,但是仍可以看出条带所在位置。因此,只要样品中含有0.5%以上的ZH10-6转基因成分,利用此体系都能检测出目标条带。说明建立的多重 PCR体系灵敏度可达0.5%,符合欧盟有关转基因产品标识的要求。
2.5 多重PCR体系的应用
以转基因大豆ZH10-6衍生品系的DNA为模板,将 DNA 浓度稀释成 50 ng·μL-1。用建立的多重 PCR体系待测大豆进行多重扩增,根据不同的条带类型,判断ZH10-6衍生品系中外源基因和侧翼序列情况(图6)。主要检测到5种带型(表2),类型1出现与受体中黄10相同带型,认为是未发生杂交的野生型;类型2出现与ZH10-6相同带型;类型3和类型4分别以NZC400和NZK001为例,认为是其他转化事件;第5类带型包含ZH10-6和受体ZH10的全部6条带型,认为是转基因杂合材料。在11份ZH10-6衍生品系中,NZC100和NZC400为黄淮材料,剩余为东北材料。用单重PCR对该扩增结果进行验证,与多重PCR鉴定结果完全一致,证明建立的多重PCR体系可以鉴定转基因大豆ZH10-6和受体中黄10,也可以鉴定不同地区的ZH10-6衍生品系,应用性较为广泛。

图2 单基因特异性检测结果Fig. 2 Single gene specific test results
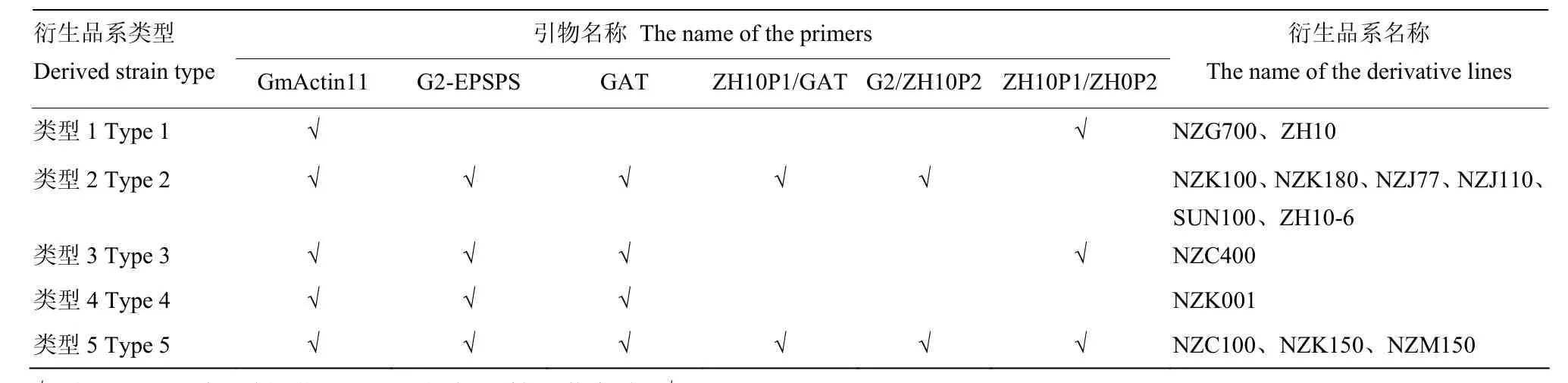
表2 ZH10-6衍生品系类型Table 2 The derived lines of ZH10-6
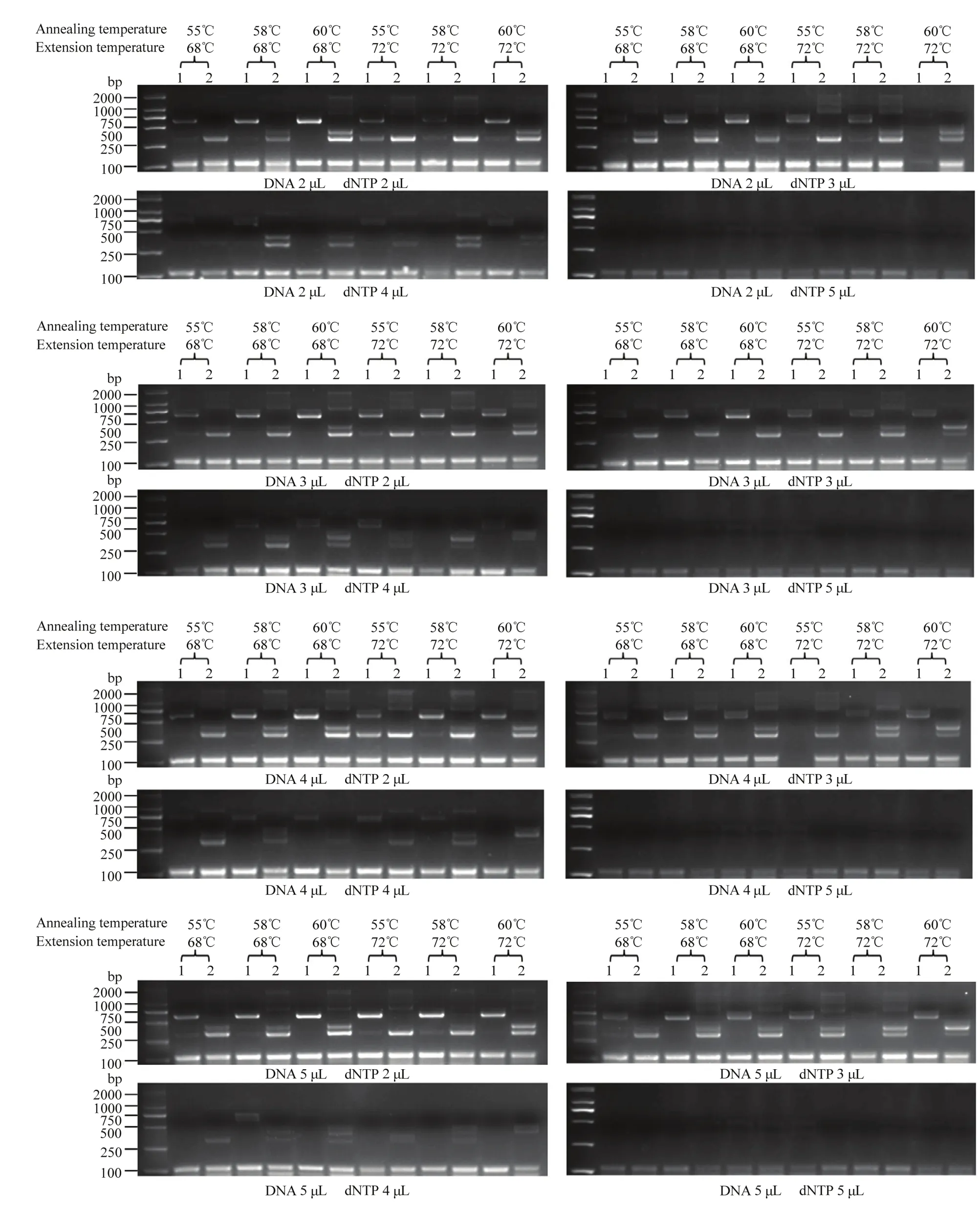
图3 梯度多重PCR检测结果Fig. 3 Results of gradient multiple PCR
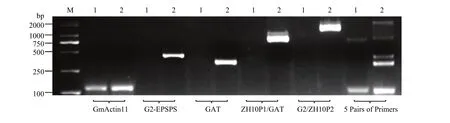
图4 单重及多重PCR检测ZH10-6及中黄10Fig. 4 Single and multiple PCR detection of ZH10-6 and ZH10
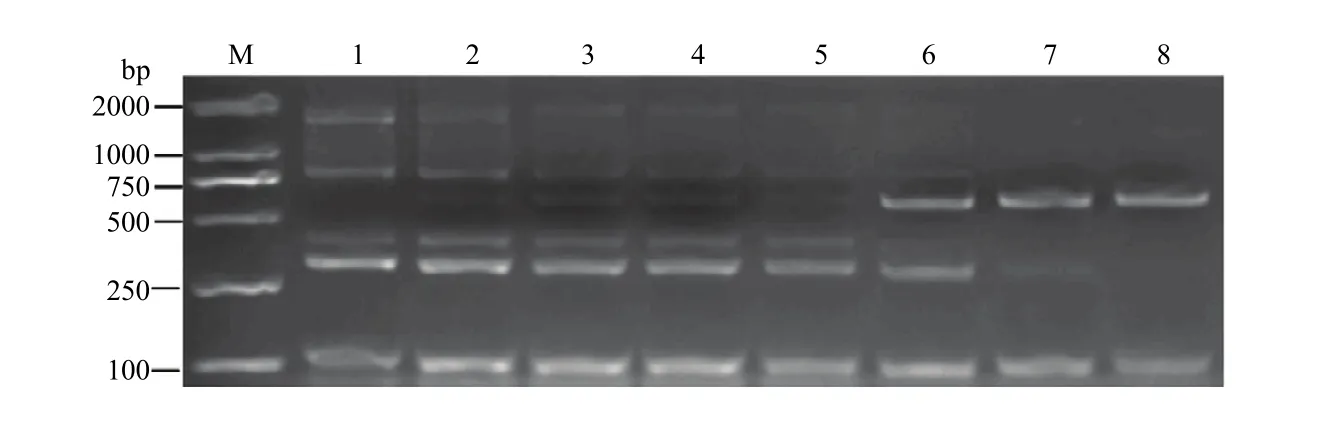
图5 多重PCR灵敏度检测Fig. 5 Results of multiple PCR sensitivity detection
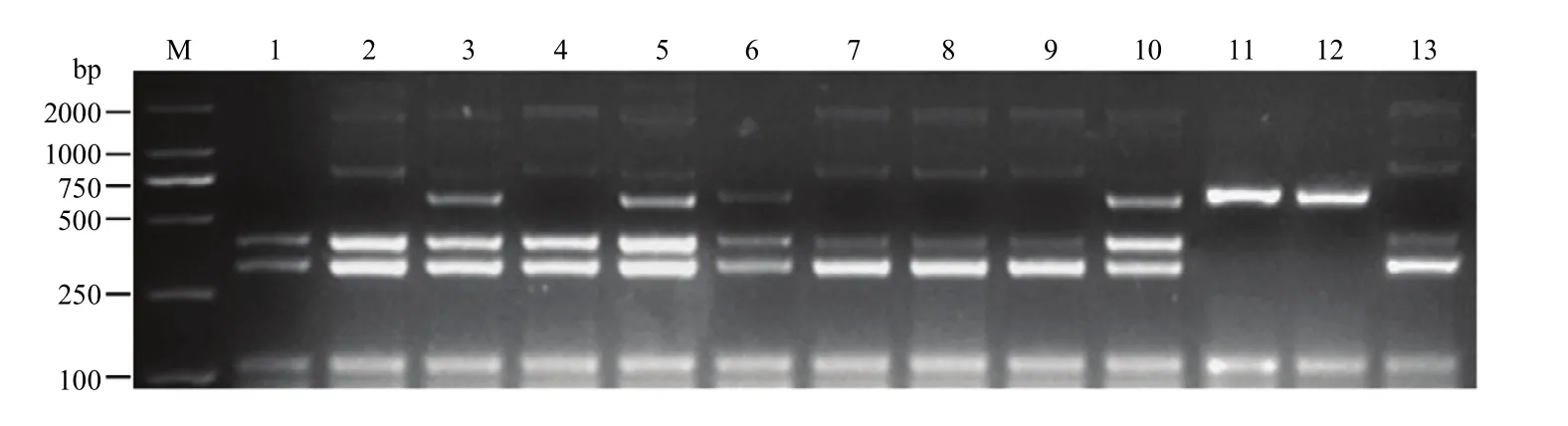
图6 ZH10-6衍生品系检测Fig.6 Test results of ZH10-6 derivative lines
3 讨论
PCR检测技术是转基因作物及产品中外源基因检测的重要手段[24-25],相比于普通PCR,多重PCR只需一个反应和一次电泳就可同时检出多个目标片段,可极大地节约试剂和时间[26-27],目前,已被广泛应用到医学及生物等领域[28]。在研究过程中发现,不同引物序列的多重PCR在实际应用中会受各项参数直接影响。
3.1 多重PCR体系中引物选择的直接依据
本研究中选择特异性强、引物二聚体少的5对引物进行扩增,其中包括起质量控制作用的内源基因,以避免转基因检测的假阴性结果出现。多重PCR扩增时,各个引物的扩增并非均一的,本研究通过5对引物等量加入时的条带亮度对引物进行强弱判断,选择各基因扩增效率相对一致的引物浓度配比条件建立了多重PCR体系。引物设计是多重PCR反应成败的关键,需要遵循PCR引物设计通用准则,即单条引物长度一般为18—25个碱基,且4种碱基的比例要适当,G+C含量一般为40%—60%。同时,选择的引物必须高度特异,彼此之间无同源性,且连续互补的碱基不超过 4个,避免出现交叉错配等现象[29]。引物之间TM值尽可能相差较小,可以实现在同一退火温度下的扩增。
3.2 不同反应体系和条件对多重 PCR体系建立的影响
在建立多重PCR反应体系时,反应体系和条件是关键因素[30-31]。反应体系主要包括DNA模板量、dNTP含量等。本研究将DNA模板量从100 ng增加至250 ng时,扩增效果没有明显变化,说明 DNA模板量对多重PCR体系扩增影响较小。同时发现在多重PCR扩增中,dNTP含量可以同单重 PCR扩增设置一致,dNTP含量过高反而会抑制反应。
反应条件是另一个关键因素,主要包括退火温度和延伸温度。一般情况下,可以依据引物的TM值减少 5℃直接选择退火温度,但有时结果与预期并不一致。较为简单的方法就是设置54℃为初始退火温度,如果多重PCR扩增产生非特异性条带,需适当提高引物退火温度,反之则降低引物退火温度[32]。退火温度应在Tm值允许范围内选择较高的温度,以确保PCR反应的特异性。但在这个过程中会出现目标片段扩增变弱的现象,可以通过延长延伸时间来消除。同时适当降低延伸温度有利于目标条带的产生。本研究中设置了55℃、58℃和60℃ 3个退火温度,68℃和72℃2个延伸温度,最终在退火温度为60℃,延伸温度为68℃时,多重PCR体系扩增效果最好。
3.3 目标片段的选择对多重PCR体系灵敏度的影响
在多重PCR目标片段的选择时,目标片段必须具有高度特异性,避免目标片段之间的竞争性扩增,才能实现高效灵敏的扩增反应,建议PCR产物片段大小在200 bp以内时,片段间隔大于30 bp;产物在500 bp以上时,片段间隔要大于 70 bp[33]。此外,各个目的片段长度应差异明显,以便于鉴别,但最大和最小片段最好相差不超过400 bp,否则会导致多重PCR体系灵敏度降低,且体系建立的难度较大。目前转基因大豆多重PCR技术中,董立明等[34]选择商品化早、种植面积大的5种转基因大豆品系305423、MON89788、CV127、GTS40-3-2、356043及大豆内源基因Lectin为研究对象,选用相应的国家标准和文献中的引物,建立了能同时检测5种转基因大豆品系和大豆内源基因的六重PCR检测体系,检测最大片段和最小片段相差400 bp,该体系能够从0.1%及以上含量的阳性对照样品中检测出全部6种靶标成分。本研究检测的目标片段是外源基因和宿主 DNA之间的连接区域,具有更高的特异性,扩增最大目标片段与最小片段之间高达1 500 bp,但灵敏度也能达到0.5%,完全符合欧盟有关转基因标识的要求。同时,该多重 PCR体系在ZH10-6和受体中黄10混合体系中,实现了六重PCR扩增。
4 结论
通过设计内参基因、外源基因和侧翼序列引物并对反应体系和条件进行优化,建立的转EPSPS/GAT大豆多重PCR检测体系具有高通量、特异性强、操作简便和应用广泛的优点,并且能够快速、准确地检测转基因大豆ZH10-6及其衍生品系。

