滋肾活血方对血管性痴呆大鼠BDNF/TrkB/PI3K/Akt信号通路的影响
张发友,伍大华,葛金文,刘春华,谢瑶,邓毫斌,周卫强
论著·实验研究
滋肾活血方对血管性痴呆大鼠BDNF/TrkB/PI3K/Akt信号通路的影响
张发友1,2,伍大华1,2,葛金文1,刘春华1,谢瑶2,邓毫斌2,周卫强2
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药研究院附属医院,湖南 长沙 410006
观察滋肾活血方对血管性痴呆(VD)大鼠BDNF/TrkB/PI3K/Akt信号通路的影响,探讨其可能的作用机制。采用改良的双侧颈总动脉结扎法(2-VO法)建立大鼠VD模型,将大鼠随机分为假手术组、模型组、滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组,每组8只。给药28 d后,HE染色观察大鼠海马组织CA1区变化,免疫组化和Western blot分别检测大鼠脑组织p-Akt、Akt、TrkB和BDNF蛋白的表达。HE染色结果:与假手术组比较,模型组大鼠海马组织CA1区损伤较严重,细胞核破裂,胞质浓缩,胞体变小;与模型组比较,滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组大鼠海马组织CA1区损伤均明显减轻;免疫组化染色结果:与假手术组比较,模型组大鼠脑组织p-Akt和Akt蛋白表达均明显升高(<0.05),TrkB和BDNF蛋白表达均明显降低(<0.05);与模型组比较,滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组大鼠脑组织p-Akt和Akt蛋白表达均明显降低(<0.05),TrkB和BDNF蛋白表达均明显升高(<0.05);Western blot检测结果:与假手术组比较,模型组大鼠脑组织p-Akt蛋白表达显著升高(<0.05),TrkB和BDNF蛋白表达均明显降低(<0.05);与模型组比较,滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组大鼠脑组织p-Akt蛋白表达均明显降低(<0.05),TrkB和BDNF蛋白表达均明显升高(<0.05)。滋肾活血方可提高VD大鼠学习记忆能力,其机制可能与下调VD大鼠脑组织p-Akt、Akt和上调TrkB、BDNF蛋白的表达有关。
滋肾活血方;血管性痴呆;蛋白激酶;脑源性神经营养因子;大鼠
血管性痴呆(vascular dementia,VD)是一种常见于脑动脉粥样硬化或脑卒中后的综合征,是由各种脑血管病变所致的智力障碍[1]。VD主要表现为记忆和认知功能障碍,伴运动、语言、视觉或人格障碍[2-3]。其发病机制与缺血性脑损伤引起的神经元变性、凋亡或坏死有关[4],迄今尚未发现有效的治疗方法。有研究报道,脑源性神经营养因子(BDNF)缺乏开始于VD早期,最终导致其晚期神经元变性、细胞死亡和胆碱能神经传递丧失[5]。BDNF与学习记忆过程密切相关,分布于中枢神经系统之内,可通过多条信号途径在神经发育过程中促进分化、存活,从而保护神经元改善病理状态。有证据表明,BDNF的表达在VD患者和VD动物模型中受损[6]。外源性添加BDNF可在体外和体内挽救神经元死亡并预防β-淀粉样蛋白诱导的神经变性[7]。BDNF通过结合酪氨酸激酶受体B(TrkB)发挥促生存作用,TrkB诱导的磷脂酰肌醇3激酶(PI3K)活性进一步使Akt活化[8],进而使Bcl-2、Bad等促凋亡靶点磷酸化失活。课题组前期研究发现,滋肾活血方可改善VD大鼠学习记忆能力[9],但其潜在机制尚未明确。本实验在前期研究的基础上观察滋肾活血方对VD大鼠BDNF/TrkB/ PI3K/Akt信号通路的影响,探讨其治疗VD的可能作用机制。
1 材料与方法
1.1 动物
雄性健康SD大鼠40只,体质量(200±20)g,湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2013-0004。饲养于温度20~25 ℃、相对湿度50%~70%环境,光照12 h,自由摄食饮水。
1.2 药物
滋肾活血方(枸杞子30 g,制何首乌15 g,益智仁10 g,桑椹30 g,葛根30 g,丹参30 g,山楂15 g,石菖蒲10 g,郁金10 g,远志10 g,全蝎3 g,五味子5 g),饮片购自湖南省中医药研究院附属医院中药房。临床成人建议用量为198 g/d,临床动物每日等效剂量为17.6 g/kg,本实验高剂量为17.6 g/(kg•d)、低剂量为8.8 g/(kg•d),由本院药剂科制成2.00 g/mL溶液。奥拉西坦片,规格0.4 g/片,石药集团欧意药业有限公司,批号20180516;临床成人建议用量为2.4 g/d,临床动物等效剂量为216 mg/(kg•d),按体表面积换算,将其配成浓度为24.00 mg/mL的悬浮液。
1.3 主要试剂与仪器
一抗稀释液,上海碧云天生物技术有限公司,货号P0205;BCA蛋白定量试剂盒,北京索莱宝科技有限公司,货号PC0020;SDS-PAGE试剂盒,上海碧云天生物技术有限公司,货号P0012AC;ECL化学发光试剂盒,美国Pierce公司,货号20-500;兔抗p-Akt抗体,北京博奥森生物技术有限公司,货号bsm-52130R;兔抗NTRK抗体,北京博奥森生物技术有限公司,货号bs-0176R;兔抗BDNF抗体,北京博奥森生物技术有限公司,货号bs-4989R;兔抗Akt抗体,北京博奥森生物技术有限公司,货号bsm-33278m;兔抗β-actin抗体,北京博奥森生物技术有限公司,货号bs-10966R;HRP标记羊抗兔,北京博奥森生物技术有限公司,货号bs-0295P-HRP;多聚甲醛,国药集团化学试剂北京有限公司,货号80096675;免疫组化检测试剂盒,美国CST公司,货号8109。Mini-protean Tetra System垂直电泳槽转膜仪,美国Bio-Rad公司;Mini trans-blot小型湿转印槽,美国Bio-Rad公司;ChemiDocTMXRS+凝胶成像系统,美国Bio-Rad公司;Max200超级酶标仪,美国Bio-Tek公司;TE2000-U+DXM1200倒置显微镜,日本Nikon公司;Z36HK高速冷冻离心机,德国HermLe公司。
1.4 造模
采用改良的双侧颈总动脉结扎法(2-VO法)制备VD大鼠模型[5]。手术造模前,大鼠禁水4 h并禁食12 h。大鼠腹腔注射水合氯醛麻醉并固定于板上,沿颈部中线切开,钝性解剖暴露左侧颈总动脉,并用手术线双重结扎。7 d后,进行相同手术并结扎右侧颈总动脉。术后3 d青霉素钠50万U/kg腹腔注射。假手术组大鼠仅分离血管而不结扎。
1.5 分组及给药
取SD大鼠40只,采用随机数字表法选出8只作为假手术组,剩余32只大鼠造模。假手术组和VD大鼠造模期间无大鼠死亡,32只大鼠均经水迷宫筛选出VD大鼠。将成模大鼠按随机数字表法分为模型组、奥拉西坦组、滋肾活血低剂量组、滋肾活血高剂量组,每组8只。大鼠按9 mL/(kg•d)剂量给予相应药物灌胃。其中假手术组给予蒸馏水灌胃,滋肾活血低剂量组给予滋肾活血方8.8 g/(kg•d)灌胃,滋肾活血高剂量组给予滋肾活血方17.6 g/(kg•d)灌胃,奥拉西坦组给予奥拉西坦药液216 mg/(kg•d)灌胃。药物剂量参照文献[9]计算。每日1次,连续4周。
1.6 取材
大鼠腹腔注射水合氯醛麻醉,迅速打开胸腔,解剖切口用止血钳固定并牵拉皮肤使心脏充分暴露于视野。将静脉滴注针头自左心室插入心脏,穿入至升主动脉,用止血钳固定针头,同时剪破右心耳。用37 ℃生理盐水150~250 mL经升主动脉快速灌注冲洗,至动脉中液体变清亮,加入4%多聚甲醛0.1 mol/L PBS,直到大鼠四肢完全僵硬,取出全脑,用于HE染色。取新鲜海马,大鼠腹腔注射水合氯醛麻醉,断头后在冰盒上快速剥离脑组织,分离海马,将海马组织用4%多聚甲醛固定,石蜡包埋,冠状切片,用于Western blot、免疫组化检测。
1.7 HE染色
大鼠处死后取脑,分离海马,将海马组织用4%多聚甲醛固定,石蜡包埋,切片,染色5~10 min,冲洗,盐酸乙醇分色;自来水浸泡返蓝5 min,冲洗,干燥,封片,镜检。
1.8 免疫组化检测
按免疫组化试剂盒说明书进行操作,脱蜡、水化组织切片→对切片预处理→孵育10 min(3%H2O2去离子水)→PBS洗涤2 min×3次→滴加一抗,37 ℃孵育1~2 h,PBS冲洗2 min×3次→滴加试剂1,37 ℃孵育20 min,PBS洗涤2 min×3次→滴加试剂2,37 ℃孵育20 min,PBS冲洗2 min×3次→DAB溶液显色→冲洗、复染、脱水、透明、封片→图像分析。免疫组化染色阳性表达成分在图像上呈棕黄色颗粒,以平均光密度值来表示。
1.9 Western blot检测
用干净的高温消毒剪刀将大脑组织剪碎放入试管。加入适量的裂解液后进行充分裂解,在冰上使其充分混匀,根据上述方法将其至少重复3次,使其尽量充分裂解。冰上裂解30 min,将混合的裂解液4 ℃、12 000 r/min离心30 min,取上清液,分装于无菌离心管,置于-80 ℃冰箱保存备用。BCA法测定蛋白浓度。用SDS-PAGE制胶试剂盒,配制8%分离胶、5%浓缩胶,每孔上样蛋白30 μg电泳,将蛋白转至PVDF膜,TBST洗膜5 min×3次。用5%脱脂奶粉封闭2 h,TBST再洗膜8 min×3次。孵育一抗(1∶1000 p-Akt,1∶1000 Akt,1∶1000 TrkB,1∶1000 BDNF,1∶10 000 β-actin),4 ℃孵育过夜。TBST再洗膜10 min×3次,二抗室温孵育2 h,TBST再洗膜20 min×3次。用化学发光法显影曝光,凝胶成像系统扫描分析,以目的蛋白与内参β-actin灰度值之比表示蛋白的相对表达量。
1.10 统计学方法
2 结果
2.1 HE染色结果
假手术组大鼠海马CA1区锥体细胞形态完整,绝大部分细胞呈圆形,可见少量椭圆形,细胞核大,核仁较清晰,细胞排列整齐,结构较为完整;模型组大鼠海马CA1区绝大部分锥体细胞形态消失,排列较为分散,细胞层次减少,视野可见细胞旁有空染区,细胞核破裂,胞质浓缩,胞体变小;奥拉西坦组大鼠海马CA1区锥体细胞形态较模型组完整,细胞排列较为整齐,层次较模型组清晰;滋肾活血低、高剂量组较模型组大鼠海马CA1区锥体细胞形态完整,细胞排列较为整齐,层次较清晰,细胞无空染区,细胞核较完整,细胞数目显著增多。见图1。
2.2 免疫组化染色结果
与假手术组比较,模型组大鼠脑组织p-Akt和Akt平均光密度均明显升高(<0.05),TrkB和BDNF平均光密度均明显降低(<0.05);与模型组比较,滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组大鼠脑组织p-Akt和Akt平均光密度均明显降低(<0.05),TrkB和BDNF平均光密度均明显升高(<0.05)。结果见表1、图2。
2.3 滋肾活血方对大鼠脑组织相关蛋白表达的影响
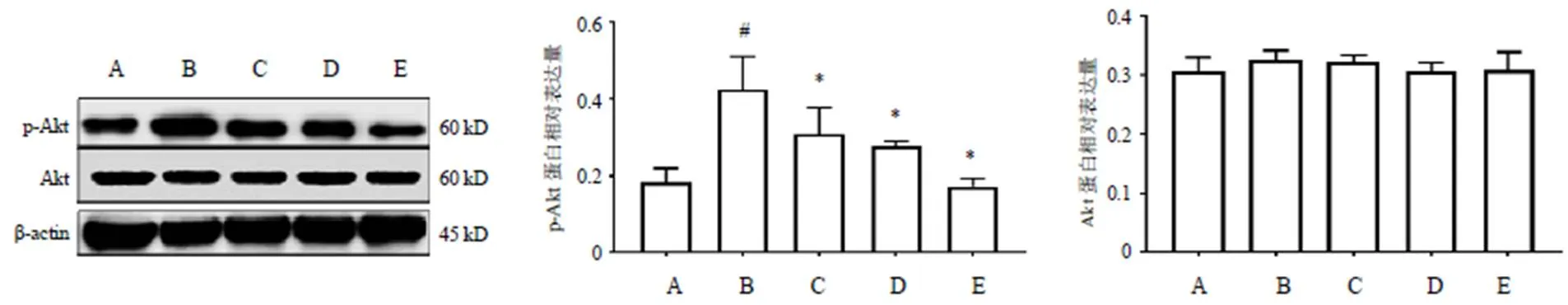
与假手术组比较,模型组大鼠脑组织p-Akt蛋白表达显著升高(<0.05),TrkB和BDNF蛋白表达均明显降低(<0.05);与模型组比较,滋肾活血低剂量组、滋肾活血高剂量组和奥拉西坦组大鼠脑组织p-Akt蛋白表达明显降低(<0.05),TrkB和BDNF蛋白表达均明显升高(<0.05)。结果见图3、图4。
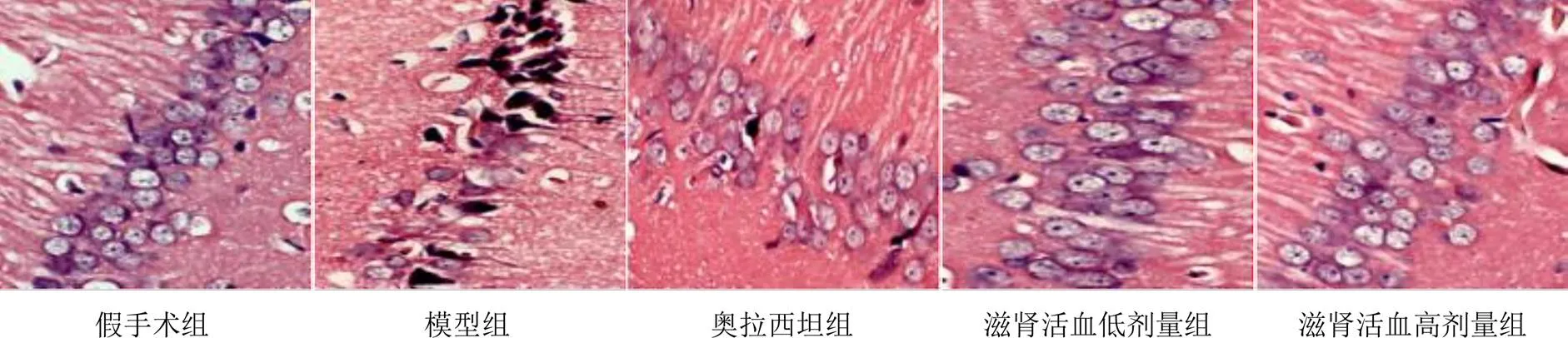
图1 各组大鼠海马组织形态(HE染色,×400)
表1 各组大鼠脑组织p-Akt、Akt、TrkB、BDNF平均光密度比较(±s)
注:与假手术组比较,#<0.05;与模型组比较,*<0.05
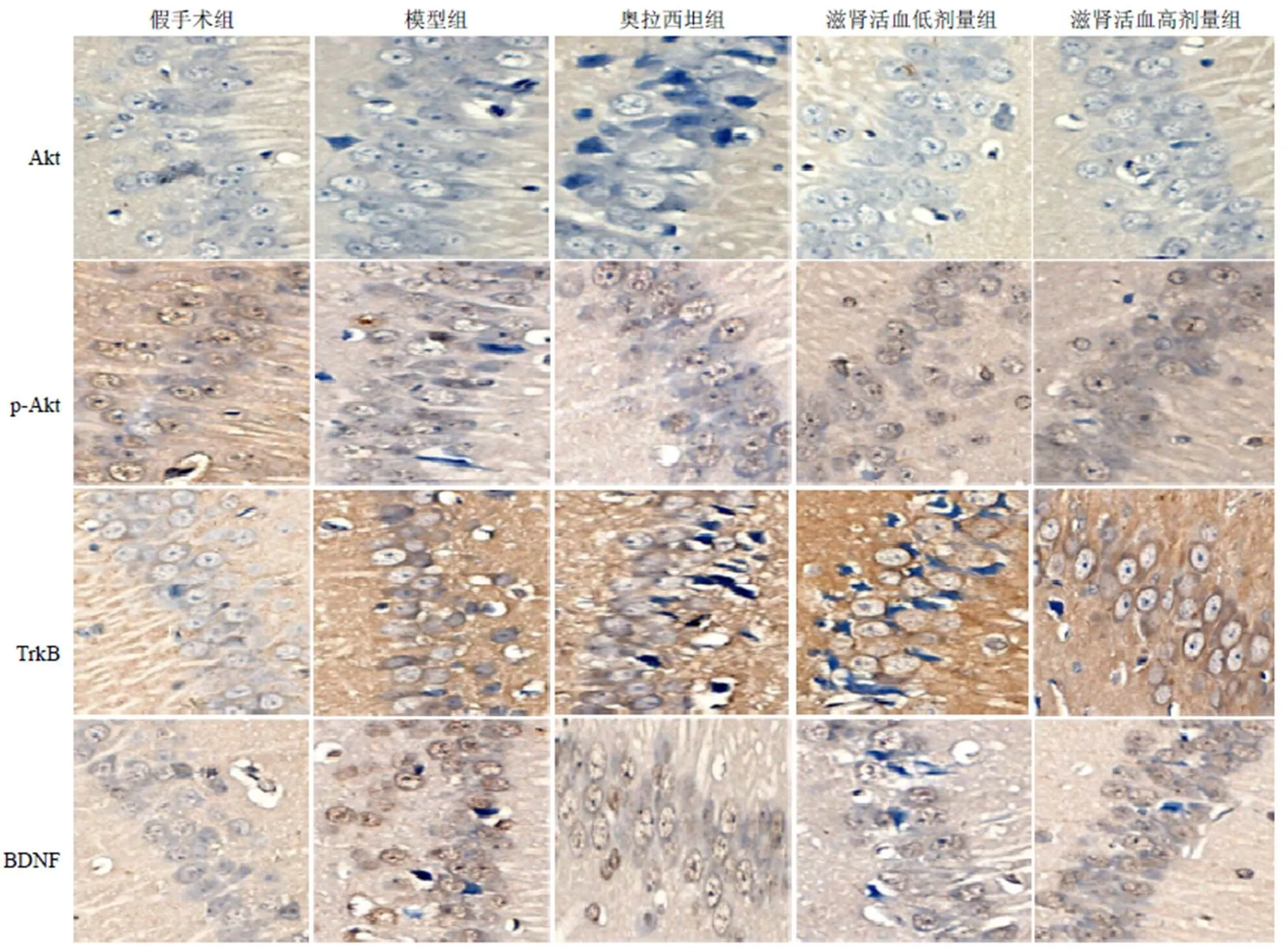
图2 各组大鼠脑组织Akt、p-Akt、TrkB、BDNF阳性表达(免疫组化染色,×400)
注:A.假手术组;B.模型组;C.奥拉西坦组;D滋肾活血低剂量组;E.滋肾活血高剂量组;与A比较,#P<0.05;与B比较,*P<0.05

注:A.假手术组;B.模型组;C.奥拉西坦组;D滋肾活血低剂量组;E.滋肾活血高剂量组;与A比较,#P<0.05;与B比较,*P<0.05
3 讨论
目前,VD是脑血管疾病中与多种危险因素有关的一种疾患,虽然其具有可预防性的特点,但病死率高,发病率也逐年上升,其特征在于记忆障碍、视觉空间障碍、注意力障碍和执行功能障碍。海马是一个大脑记忆的关键区域,海马组织受损会导致记忆力显著下降,严重者亦可导致VD。有研究显示,海马CA1区是学习记忆的主要功能区[10]。本研究结果显示,与假手术组比较,模型组大鼠CA1区受损较为严重,细胞核破裂,胞质浓缩,胞体变小;与模型组比较,滋肾活血方干预后VD大鼠CA1区细胞形态较为完整,排列较为整齐,层次较清晰,细胞数量显著增多,提示滋肾活血方可改善VD大鼠海马CA1区损伤。
BDNF是一种具有生物学功能的神经营养因子,支持中枢和周围神经元生存,内源性BDNF在脑缺血后可缩小脑组织缺血性损伤,外源性BDNF在脑梗死后可有效缩小梗死体积。BDNF对神经存活、学习、记忆、突触活动等有调节作用已被证实[11]。BDNF与学习记忆过程密切相关,参与长期记忆的形成,在维持学习记忆和调节突触的可塑性方面具有重要作用[12]。BDNF主要通过TrkB发挥其生理作用,TrkB是一种具有高度亲和力的BDNF受体。有研究表明,TrkB信号在记忆的形成中起着至关重要的作用,异常的TrkB表达会损害记忆和学习[13]。BDNF通过与TrkB结合后构成二聚体,并在同一时间诱导TrkB使其磷酸化,以便细胞内外信号传递,诱使下游通路的激活,保证级联反应的正常,发挥神经保护作用[14]。BDNF通过与TrkB形成的受体复合物相结合,进而发挥其对神经元可塑性促进作用。本研究结果显示,VD大鼠BDNF和TrkB蛋白表达显著下降,滋肾活血方可升高VD大鼠BDNF、TrkB蛋白表达,从而激活其自身通路影响下游信号通路,促进对VD大鼠神经元及学习记忆能力的修复,达到保护大鼠海马神经元的作用。
PI3K/Akt是BDNF/TrkB下游级联信号中较为关键的途径,被认为可调节NMDA受体介导的突触可塑性。PI3K/Akt信号通路已被证实对脑组织和细胞缺血缺氧有保护作用。PI3K是可被细胞因子和有丝分裂原刺激激活的生长因子,经激活PKB/Akt的方式参与到调控细胞周期、细胞增殖和凋亡中。Akt也被称为PKB,是一种能对体内多种信号作出反应的特异性蛋白激酶,它的活化受到生长因子、细胞应激和胰岛素等多种因素的影响,并且在其参与的信号通路中起营养代谢、细胞生长、增殖,转录调节和细胞存活等功能。Akt各种亚型都在神经系统中高度表达,在神经保护中发挥重要作用。活跃的磷酸化Akt通过升高下游底物的磷酸化,促进神经细胞生存。BDNF、胰岛素样生长因子Ⅰ或神经生长因子等神经营养因子,可引起PI3K/Akt的激活。营养因子与PI3K同源酪氨酸激酶受体结合,产生存活因子,PI3K在该因子的作用下磷酸化并逐渐募集至质膜附近,与此同时,PI3K的磷脂产物与Akt同源结构蛋白相互作用使Akt聚集到质膜内表面,在质膜内表面的PI3K所含的催化亚基产生磷酸肌醇磷酸盐PIP2和PIP3,从而导致Akt磷酸化激活。活化Akt参与多种细胞功能的调控,而PI3K/Akt信号通路在VD发病中发挥着作用[15]。本研究结果显示,模型组大鼠磷酸化的Akt蛋白表达显著升高,由此推测BDNF介导的PI3K/Akt信号通路的活化可能是由脑缺血所诱发的,而活化的BDNF信号通路又和海马神经的受损密切相关,导致海马神经进入损伤状态。滋肾活血方干预后,p-Akt蛋白表达显著降低,高剂量组更为显著,且免疫组化结果显示,滋肾活血方干预后Akt和p-Akt表达显著降低。Western blot检测大鼠总蛋白Akt表达无变化,而免疫组化检测Akt有明显变化;其可能的原因是Western blot检测的是组织总蛋白Akt的表达,而免疫组化属半定量法,检测组织中细胞胞浆、胞膜、细胞核等Akt表达。由此推测滋肾活血方通过调控BDNF介导的PI3K/Akt信号通路,从而对大鼠神经元起到保护作用,对受损VD大鼠记忆功能有所改善。
国医大师刘祖贻认为,VD病位在脑,属本虚标实之证[16]。肾精亏虚、瘀血阻络为其常见病机,临床运用滋肾活血方治疗VD疗效显著[17]。方中制何首乌滋阴补血,有化阳之功而无阴凝之弊,可获阴阳双补之效,枸杞子有滋补肝肾、益精明目之功,两者共为君药;桑椹滋阴养血,益智仁助阳化阴,鼓舞肾气以生精,可使化源得滋,脑髓得充,共为臣药;葛根轻清升阳,丹参活血祛瘀,五味子滋肾涩精,远志宁心安神,石菖蒲开窍宁神,全蝎搜风通络,六药为佐;郁金活血化瘀,山楂消食健胃,共为使药。全方共奏活血通窍、滋阴补肾、益智健脑之效。
综上所述,滋肾活血方可通过提高BDNF、TrkB和降低p-Akt蛋白表达,从而对大鼠神经元起到保护作用,改善VD大鼠海马损伤。
[1] VAN DER FLIER W M, SKOOG I, SCHNEIDER J A, et al. Vascular cognitive impairment[J]. Nat Rev Dis Primers,2018,15:18003.
[2] BARBAY M, TAILLIA H, NEDELEC-CICERI C, et al. Vascular cognitive impairment:Advances and trends[J]. Rev Neurol (Paris),2017, 173(7/8):473-480.
[3] BIESSELS G J, REAGAN L P. Hippocampal insulin resistance and cognitive dysfunction[J]. Nature Reviews Neuroscience,2015, 16(11):660-671.
[4] MARTIN P, EMILIANO A, MA LENN G, et al. Dementia and risk reduction[M]. London:Alzheimer's Dis Inter,2014:6-10.
[5] HUANG X W, LI H, QIN D L, et al. The model of VD rats was established by the method of ligation bilateral common carotid artery at two times[J]. Chin J Gerontol,2010,30(14):2006-2007.
[6] ZHAO X L, FANG X B, LI D P. Establishing vascular dementia model in rats[J]. J Chin Med Univ,2002,31(3):166-167.
[7] LIM K B, KIM J, LEE H J, et al. COWAT performance of persons with Alzheimer's dementia, vascular dementia, and Parkinson's disease dementia according to stage of cognitive impairment[J]. PMR,2019,11(7):737-744.
[8] JEONG S J, SOHN E J, KIM Y J, et al. Hwangryunhaedok-tang exerts neuropreventive effect on memory impairment by reducing cholinergic system dysfunction and inflammatory response in vascular dementia rat model[J]. Advances in Integrative Medicine, 2019,18,24(2):E343.
[9] 任晨斌,伍大华,张发友,等.滋肾活血方对血管性痴呆大鼠学习记忆能力和海马形态学的影响[J].湖南中医药大学学报,2019,37(10):1082-1085.
[10] BRANDEIS R, BRANDYS R, YEHUDA S. The use of the Morris water maze in the study of memory and learning[J]. Neuroscience,1989, 48(1/2):29-69.
[11] 柳振华,张弛,张芳,等.脑力苏对血管性痴呆小鼠海马细胞增殖及凋亡表达的影响[J].现代临床医学,2011,37(2):98-100.
[12] BINDER D K, SCHARFMAN H E. Brain-derived neurotrophic factor[J]. Growth Factors,2004,22(3):123-131.
[13] MIZUNO M, YAMADA K, OLARIU A, et al. Involvement of brain-derived neurotrophic factor in spatial memory formation and maintenance in a radial arm maze test in rats[J]. J Neurosci,2000, 20(18):7116-7121.
[14] JIANG T, WANG X Q, DING C, et al. Genistein attenuates isoflurane-induced neurotoxicity and improves impaired spatial learning and memory by regulating cAMP/CREB and BDNF-TrkB- PI3K/Akt signaling[J]. Korean J Physiol Pharmacol,2017,21(6):579-589.
[15] CHEN D P, HOU S H, CHEN Y G, et al. L-butyl phthalein improves neural function of vascular dementia mice by regulating the PI3K/AKT signaling pathway[J]. Eur Rev Med Pharmacol Sci,2018, 22(16):5377-5384.
[16] 寿雅琨,刘芳,周胜强,等.国医大师刘祖贻运用温阳活血法治疗中风后遗症经验[J].湖南中医药大学学报,2019,39(10):1179-1182.
[17] 伍大华,姚婷,蒋军林,等.滋肾活血法治疗血管性痴呆肾阴虚血瘀证的临床研究[J].湖南中医药大学学报,2015,12(12):1372-1374.
Effects ofPrescription on BDNF/TrkB/PI3K/Akt Signaling Pathways in Vascular Dementia Rats
ZHANG Fayou1,2, WU Dahua1,2, GE Jinwen1, LIU Chunhua1, XIE Yao2, DENG Haobin2, ZHOU Weiqiang2
To explore the effects ofPrescription on BDNF/TrkB/PI3K/Akt signal pathways in vascular dementia (VD) rats; To discuss its possible mechanism.The modified bilateral common carotid artery ligation method (2-VO method) was used to establish rat VD models, and the rats were randomly divided into sham-operation group, model group,low-, high-dosage groups, and Oxiracetam group, with 8 rats in each group. 28 days after administration, HE staining was used to observe the changes in the CA1 region of rat hippocampus. Immunohistochemistry and Western blot were used to detect the protein expressions of p-Akt, Akt, TrkB and BDNF in the rat brain.The HE results showed that compared with the sham-operation group, the hippocampal CA1 region of the model group was more severely damaged, the nucleus was ruptured, the cytoplasm was concentrated, and the cell body became smaller; compared with the model group, the damage of hippocampal CA1 area was significantly reduced inlow-, high-dosage groups, and Oxiracetam group. Immunohistochemical staining results showed that compared with the sham-operation group, the p-Akt and Akt protein expressions in the model group significantly increased (<0.05), and the TrkB and BDNF protein expressions were significantly reduced (<0.05); compared with the model group, the expressions of p-Akt and Akt inlow-, high-dosage groups, and Oxiracetam group were all reduced (<0.05), and TrkB and BDNF protein expression significantly increased (<0.05). Western blot results showed that compared with the sham-operation group, the expression level of p-Akt protein in the model group significantly increased (<0.05) and TrkB and BDNF protein expression significantly decreased (<0.05); compared with the model group, the expressions of p-Akt and Akt inlow-, high-dosage groups, and Oxiracetam group were all reduced (<0.05), and TrkB and BDNF protein expression significantly increased (<0.05).Prescription can improve the learning and memory abilities of VD rats. The mechanism may be related to the down-regulation of p-Akt and Akt protein expressions and the up-regulation of TrkB and BDNF protein expressions.
Prescription; vascular dementia; protein kinase; brain-derived neurotrophic factor; rats

R285.5
A
1005-5304(2020)10-0042-06
10.19879/j.cnki.1005-5304.202005193
国家自然科学基金(81894462)
伍大华,E-mail:893049352@qq.com
(2020-05-03)
(2020-05-28;编辑:华强)

