盐胁迫对槲树(Quercus dentata)幼苗离子平衡及其生理生化特性的影响
郝 汉,曹 磊,陈伟楠,胡增辉,冷平生,*
1 北京农学院园林学院,北京农学院林木分子设计育种高精尖创新中心, 北京 102206 2 北京三元绿化工程有限公司, 北京 100026 3 中国林业科学研究院森林生态环境与保护研究所, 北京 100091
槲树(QuercusdentataThunb.)是北京地区的重要乡土树种之一,具有涵养水源,保持水土的作用。槲树树冠广展,秋叶呈橙红色,叶大且形状奇特,园林造景价值高。北京地区槲树资源丰富,主要分布在北京西部和北部山区弱酸性土壤环境中,而在北京城市园林绿化中却极为少见,这可能与平原地区土壤偏盐碱性相关。北京园林绿化局将槲树列为城市森林建设的骨干乡土树种,因此,了解槲树的耐盐性是十分必要的。
栎类树种的生态适应性较强,在干旱及土壤瘠薄立地条件下均能良好生长。近些年已有学者对栎树的耐盐性展开研究,如:李向应等比较了盐胁迫对北京槲栎(Q.alienaBl. var.pekingensisSchott.)和锐齿槲栎(Q.alienaBl. var.acuteserrataMaxim. ex Wenz.)离子分布及生理特性影响,北京槲栎耐盐性优于锐齿槲栎,更适宜北京地区的园林绿化[1]。从根系发育及离子运输方面分析了麻栎(Q.acutissimaCarruth.)和弗吉尼亚栎(Q.virginianaMill.)2树种的耐盐性,弗吉尼亚栎具有较强耐盐性,麻栎则为盐敏感型植物[2]。李志萍等研究了栓皮栎(Q.variabilisBl.)在NaCl胁迫下的生理响应,指出栓皮栎能够耐受0.6%浓度的盐胁迫[3]。不同栎树的耐盐性存在差异,但对其耐盐机制仍了解不多。来自其他植物材料的大量研究表明,盐胁迫下植物体内离子和生理生化指标的变化与其耐盐能力高度相关。黄连木(PistaciachinensisBunge.)在高浓度NaCl胁迫下产生离子毒害,细胞膜透性增大,引起细胞代谢失调[4]。卫矛(Euonymusalatus(Thunb.) Sieb.)、沙枣(ElaeagnusangustifoliaLinn.)和美国白蜡(FraxinusamericanaLinn.)在盐胁迫下根茎叶中Na+含量升高,K+含量变化却呈现不同规律[5]。NaCl处理下冰叶日中花(MesembryanthemumcrystallinumL.)迅速积累渗透调节物质并提高抗氧化酶活性,以适应盐胁迫[6]。高浓度盐胁迫使红麻(ApocynumvenetumL.)、五叶地锦(Parthenocissusquinquefolia(L.) Planch.)叶片中可溶性糖、脯氨酸显著积累[7-8]。盐胁迫下对青钱柳(Cyclocaryapaliurus(Batal.) Iljinsk.)生长和根系离子变化研究表明,其耐盐阈值在1 g/L-1左右[9]。曹磊等研究了盐胁迫条件下槲树的光合响应及叶绿素荧光变化,表明槲树幼苗对盐碱胁迫具有较强的抗性[10]。而槲树在盐胁迫下的离子平衡情况以及生理生化响应仍不清楚。本研究拟对槲树幼苗进行盐胁迫试验,分析其生理生化特性与离子浓度的变化,为进一步揭示槲树的耐盐性提供数据支撑,以期为槲树应用于北京城市地区甚至华北平原园林绿化提供参考。
1 材料与方法
1.1 试验材料
将采集于北京平谷玻璃台林场的槲树种子,在温室砂藏催芽后,于2016年11月27日播种于规格为盆高20 cm,直径22 cm的塑料花盆中,基质配比为草炭:沙子:鸡粪=5:3:1,实验用盆下置托盘,定期除草、浇水、施肥,保证槲树苗长势良好。
1.2 盐胁迫处理
2017年9月,选择长势一致的槲树幼苗进行盐胁迫实验。分别用100、200、300 mmol/L的NaCl进行浇灌处理,每10天向盆中浇灌用去离子水配制的盐溶液500 mL(对照加等量去离子水),保证溶液完全加入且不溢出托盘,每天对实验苗进行称重补水,补水时先冲洗托盘上的盐粒,将洗液倒入盆中,避免盐分流失,以保持盆内盐浓度一致。实验持续30 d,300 mmol/L浓度NaCl胁迫第20天和200 mmol/L盐胁迫第30天,槲树叶片分别出现皱缩。300 mmol/L盐胁迫第30天,叶片皱缩进一步加重,叶缘焦黄,并出现大量黄褐斑,部分植株致死。盐胁迫第10、20、30天分别采集槲树幼苗大小适中的功能叶进行生理生化指标的测定。将整株槲树幼苗根、茎、叶分别烘干,进行离子含量测定。
1.3 指标测定及方法
根据叶样鲜重和干重测定叶片含水量[11],用电导仪法测定叶片电导率[12],丙二醛含量用硫代巴比妥酸法测定[11],可溶性糖含量用蒽酮法测定[11],游离脯氨酸含量用茚三酮显色法测定[11],过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活性的测定分别采用愈创木酚法、紫外吸收法和氮蓝四唑染色法[13],离子含量用电感耦合等离子体原子发射光谱仪测定(Thermo Fisher公司,ICP-AES6300型)。
1.4 数据处理与分析
用 Excel软件进行数据处理和作图, 用 SPSS软件进行相关分析。
2 结果与分析
2.1 盐胁迫对槲树根茎叶离子含量的影响
总体上,随着NaCl处理浓度增加以及处理时间的延长,槲树根和叶中Na+随之升高,茎中含量则先升后降(图1)。Na+含量的变化幅度与胁迫浓度呈正相关,在高浓度胁迫第30天时,根系中Na+浓度为对照的3.5倍,茎与叶片中均为对照3倍。根茎叶中Na+含量对比可知,Na+在根系中的含量远高于茎和叶,300 mmol/L胁迫第30天根系Na+含量分别达到了茎与叶的3倍和2倍。盐胁迫的加重,导致槲树根茎叶中K+含量不断下降。以根系中K+变化最显著,200 mmol/L胁迫第30天时降幅最大,下降至对照的46%。叶片中K+含量在中低浓度盐胁迫下无明显下降,高浓度下则显著低于对照。随着NaCl处理浓度的增加以及盐胁迫时间的延长,槲树根茎叶中Na+/K+随盐胁迫加重而升高,且 Na+/K+由地下向地上部分逐渐降低。根中Na+/K+最大,300 mmol//L胁迫第30天达到对照的6.25倍。
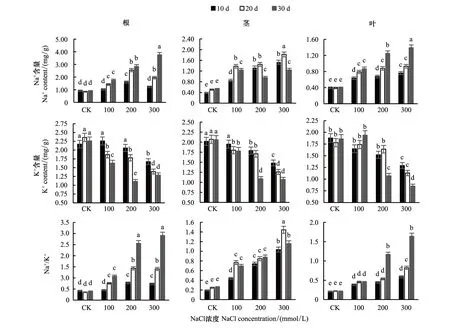
图1 盐胁迫下槲树根茎叶中Na+、K+含量和Na+/K+的变化Fig.1 Changes of Na+, K+ content and Na+/K+ in the roots, stems and leaves of Q. dentata under salt stress小写字母a、b、c、d、e表示在P<0.05水平上差异显著
图2表明,随着盐胁迫浓度和时间的增加,槲树茎叶中Ca2+随之升高。其在叶片中的涨幅高于茎,茎中Ca2+的变化在盐胁迫第30天达到显著水平,其涨幅与盐胁迫浓度呈负相关。根系中Ca2+含量则随盐胁迫加重而不断降低。300 mmol/L盐胁迫第30天时根系中Ca2+含量降低至对照的52%。盐胁迫下,槲树茎叶中Mg2+含量变化大体为不断降低,且降幅与盐浓度呈正相关,尤以茎叶更为显著。100 mmol/L盐胁迫第30天,其在根系中有显著升高,含量为对照的1.22倍。
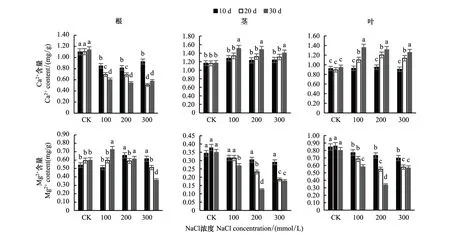
图2 盐胁迫下槲树根茎叶中Ca2+、Mg2+含量变化Fig.2 Changes of Ca2+ and Mg2+ content in the roots, stems and leaves of Q. dentata under salt stress
2.2 盐胁迫对槲树叶片含水量的影响
如图3,槲树叶片含水量随盐胁迫的进行不断降低,降幅与盐浓度呈正相关。低浓度和中等浓度盐胁迫下分别在胁迫第30天和第20天达到显著水平,而高浓度盐胁迫下叶片含水量在不同时间均显著下降。300 mmol/L处理第30天时,含水量最低降至43.2%,为对照的64.1%。
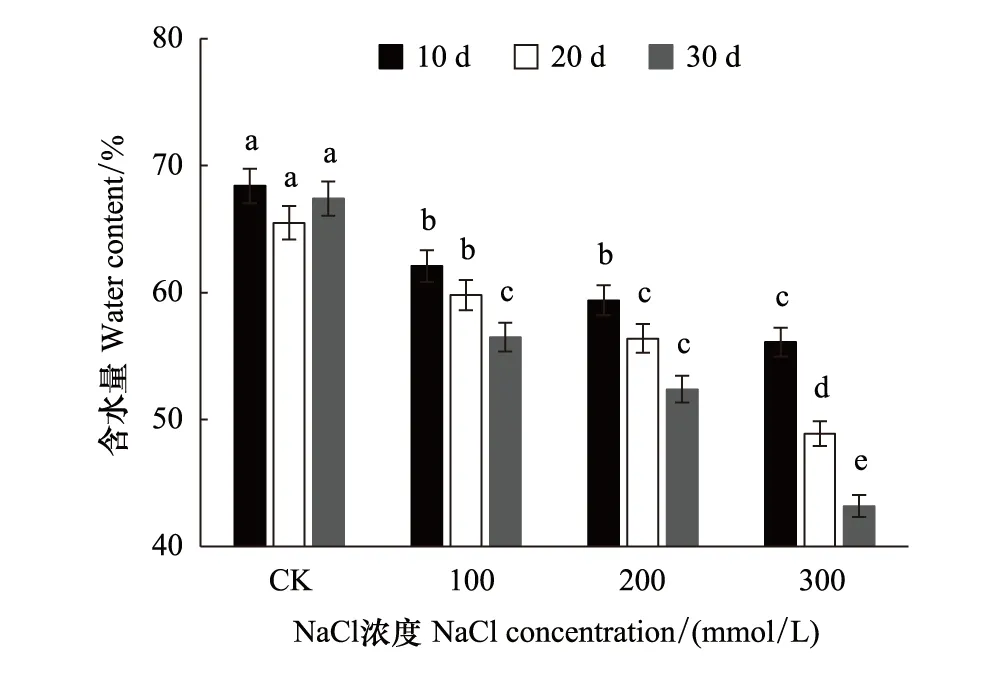
图3 盐胁迫下槲树叶片含水量的变化 Fig.3 Changes of Water content in the leaves of Q.dentata under salt stress
2.3 盐胁迫对槲树叶片膜透性的影响
由图4可以得出,随NaCl处理浓度的增加和盐胁迫时间的延长,槲树相对电导率和丙二醛含量均呈现出不断升高的趋势,其升高均在300 mmol/L盐胁迫下最为显著。中高浓度盐胁迫下,相对电导率在胁迫第20天后显著升高,第30天时电导率分别比20天增加了0.07和0.19。300 mmol/L处理第30天,丙二醛含量最高为68.85 nmol/g,相对电导率也达到0.54。
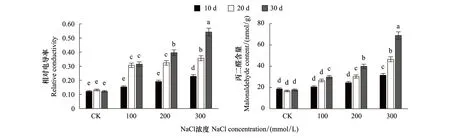
图4 盐胁迫下槲树叶片相对电导率、丙二醛含量的变化Fig.4 Changes of Relative conductivity, Malonaldehyde content in the leaves of Q.dentata under salt stress
2.4 盐胁迫对槲树叶片抗氧化酶活性的影响
图5表明,盐浓度低于300 mmol/L时,槲树叶片POD无明显变化;当盐浓度达到300 mmol/L时,随着处理时间延长,叶片POD活性表现为先升高,后降低至对照以下。随NaCl处理浓度的增加,槲树CAT酶活性增加,当盐浓度达到300 mmol/L时,叶片CAT活性相较于100 mmol/L和200 mmol/L胁迫时有极显著提高。在低浓度处理下,随处理时间延长,CAT活性呈增加趋势,而在高浓度(300 mmol/L)NaCl处理20天,槲树叶片CAT活性达最大值,为0.258 U/g,当胁迫时间延长到30天,其活性显著下降到0.236 U/g。槲树SOD活性变化规律为盐浓度低于300 mmol/L时,SOD活性逐渐提高;盐浓度达到300 mmol/L时,SOD活性极显著降低,且降幅与胁迫时间呈正相关。200 mmol/L浓度NaCl处理第30天时SOD达到了2035.69 U/g;300 mmol/L浓度NaCl处理第30天时SOD低于对照,为1705.32 U/g。
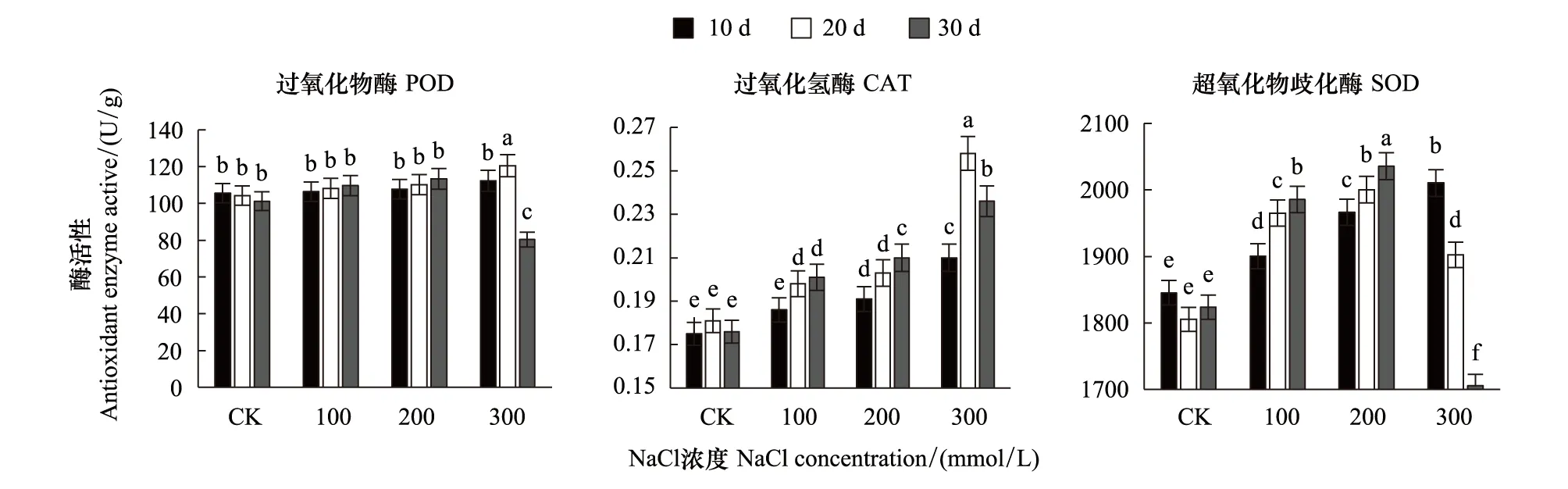
图5 盐胁迫下槲树叶片过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性的变化Fig.5 Changes of POD, CAT, SOD active in the leaves of Q.dentata under salt stress
2.5 盐胁迫对槲树叶片渗透调节物质的影响
可溶性糖和脯氨酸在盐胁迫下总体表现为不断积累(图6)。低于300 mmol/L的盐胁迫下,槲树叶片可溶性糖和脯氨酸的积累随浓度增加并不显著,随胁迫时间的延长变化显著。当盐胁迫浓度达到300 mmol/L,可溶性糖在胁迫第20天极显著积累,含量达到了0.162 ug/g,在胁迫达到第30天时积累量减少至0.157 μg/g,但其积累量仍显著高于对照。300 mmol/L盐胁迫下,处理第20天和30天可溶性糖含量分别为0.215 μg/g和0.175 μg/g。
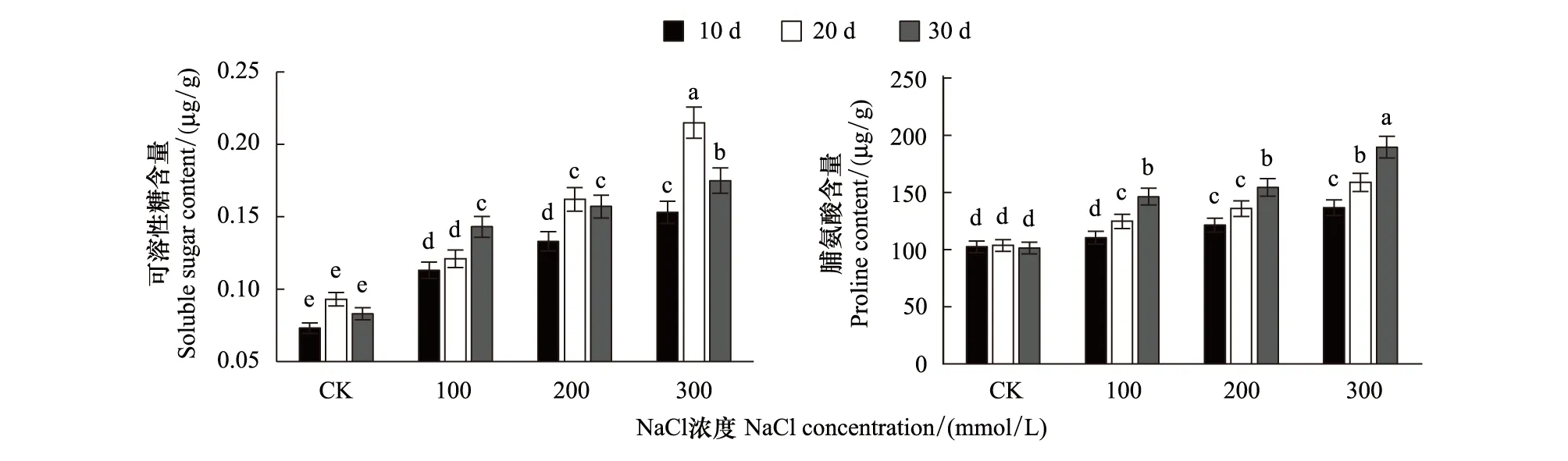
图6 盐胁迫下槲树叶片可溶性糖、脯氨酸含量的变化Fig.6 Changes of Soluble sugar and Proline content in the leaves of Q.dentata under salt stress
3 讨论
曹磊等发现,槲树在低浓度盐胁迫下,生长基本正常,盐害症状不明显,当用300 mmol/L浓度NaCl处理时,随时间延长,盐害逐渐加强,到第30天时,所有叶片均出现焦叶症状[4]。本研究所测定的叶片离子浓度、细胞膜透性、抗氧化酶的活性以及渗透调节物质均呈现相应的变化。随着盐胁迫的加重,槲树光合速率、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ光化学量子产量(Yield)、非光化学猝灭系数(NPQ)呈下降趋势[4]。冷平生等研究发现,盐胁迫使黄连木根茎叶中Na+含量升高,离子毒害随即产生,导致在重度胁迫下存活率仅63%[5]。槲树在盐胁迫下大量吸收Na+,重度胁迫下含量达到最高,盐害症状随之产生,暗示其盐害症状可能与离子毒害相关。NaCl胁迫下槲树不同组织Na+含量也有差异,其主要集中在根系,地上部分在轻中度盐胁迫下Na+积累不多,重度胁迫下Na+在根茎叶均显著积累。在对弗吉尼亚栎的研究中同样发现,弗吉尼亚栎叶片中Na+积累少于根系[14]。王树凤认为这是弗吉尼亚栎主动适应盐胁迫的机制,是盐离子的区隔化[15]。本研究尚不能将此定义为槲树盐离子的区隔化,这可能只是槲树通过根系的补偿作用,将Na+集中在根部,减少地上部分Na+含量,从而适应盐胁迫的机制。在北京槲栎中同样发现了这一机制,只是其根系的代偿能力有限,导致北京槲栎在0.2%盐胁迫下根系与叶片Na+含量就达到了同一水平[1]。总之,槲树与耐盐性强的弗吉尼亚栎有较为相似的盐适应机制,其根系有一定的补偿能力,在轻中度盐胁迫下能有效的减轻地上部分离子毒害,这可能延缓了地上部分盐害的发生。
盐胁迫下,植物过量吸收Na+会导致K+、Ca2+、Mg2+的外排与流失[16]。本研究表明,槲树在吸收Na+的同时,K+、Mg2+随之外排,尤以K+的外排最为显著,导致Na+/K+显著升高。在对大豆(Glycinemax(Linn.)Merr.)[17]、沙枣[18]、青钱柳[10]、槲栎[1]的研究中也得到相似结果。欧洲落叶松(LarixdeciduaMill.)在盐胁迫下大量积累Na+和Cl-,K+却能保持在稳定水平[19]。这与槲树的结果不一致,二者耐盐机制不同,欧洲落叶松可能更依赖于维持体内K+水平,以适应高盐环境。K+参与植物体内多种酶及代谢过程[20],而较高浓度的Mg2+有利盐生植物蛋白合成酶维持高活性[21]。随盐胁迫加重,K+、Mg2+流失增多,会导致槲树K+和Mg2+依赖性酶的活性不断降低,从而影响到其参与的代谢反应,并最终影响槲树的生长。由于根系受到的离子毒害较重,槲树K+的外排在根系最多,叶片相对较少。轻度盐胁迫下,Mg2+含量在槲树根系却有一定的升高。陈少良等指出,与群众杨(Populuspopularis‘35-44’)不同,胡杨P.euphraticaOliv)在盐胁迫下可通过根系吸收土壤中的Mg2+和Ca2+,以维持地上部分营养元素水平[22]。槲树根系Mg2+小幅升高的同时,茎叶中Mg2+的流失也相对较少,暗示槲树可能与胡杨相同,能够通过根系吸收Mg2+,向地上部分运输,以维持地上部分营养供给。但槲树根系吸收Mg2+能力有限,盐胁迫加重后,根系的吸收则不能抵消离子毒害所产生的营养元素流失。槲树根系中Ca2+含量降低,却在茎叶中不断积累,以叶片中积累量最大,这与沙枣[18]和青钱柳[10]的Ca2+流失有所不同。Ca2+在盐胁迫适应中通常被认为是阳离子稳态的关键,在胞质中Ca2+稳态的建立是盐适应的一个必要条件[23]。槲树根系Ca2+可能部分转移至地上,以建立地上部分离子稳态。李广鲁等发现,外源Ca2+促进冰叶日中花根尖Na+外排,抑制K+流失[24]。槲树Ca2+的向上运输可能是其稳定地上部分K+、Na+平衡,适应盐胁迫的重要机制。
槲树在中低浓度盐胁迫下,叶片含水量降幅较小,几乎无盐害症状;高浓度胁迫下含水量显著降低,叶片严重失水皱缩。这是盐离子浓度过高,破坏了离子平衡,导致水分亏缺所致。大量Na+的积累会产生离子毒害,破坏细胞膜结构,相对电导率和丙二醛含量是反映细胞膜受损程度的重要指标,路斌[25]认为,相对电导率达到50%对细胞膜将有致命损伤。随着盐胁迫的加重,槲树叶片相对电导率和丙二醛含量不断增大,槲树细胞膜受损加重,当高浓度NaCl胁迫达到第30天时,膜脂过氧化物丙二醛含量达68.85 nmol/g,相对电导率为0.54,叶片受损严重,叶缘焦黄。在对槲栎[1]的研究中得到相似结果,0.4%—0.6%浓度盐胁迫下槲栎相对电导率变化显著,0.1%—0.3%浓度胁迫下则无明显变化。李志萍等[3]对栓皮栎的研究表明,二年生栓皮栎在0.6%及0.8%浓度盐胁迫后期,丙二醛含量涨幅显著增加。槲树与槲栎、栓皮栎相似,对中低浓度盐胁迫耐受性良好。
盐胁迫下,细胞代谢失调,产生大量自由基和膜脂过氧化物,植物细胞膜受损,保护酶系统随即被激活,SOD、POD、CAT等保护酶活性随之升高,以清除活性氧和过氧化物,在逆境中保护植物免受氧化损伤[26-27]。本研究发现,槲树主要依靠SOD和CAT两种酶协同作用清除活性氧。POD活性变化不显著,仅在重度胁迫下活性降低。这与栓皮栎[3]的研究结果不同,二年生栓皮栎在0.6%和0.8%浓度盐胁迫下,三种保护酶活性均显著升高。产生差异的原因可能与苗龄有关,二年生幼苗相较于一年生可能在POD的抗氧化能力上有所提升;也可能是两种栎树本身POD的抗氧化能力有所差异,尚需进一步研究。SOD和CAT活性升高,能有效的清除活性氧,使膜脂过氧化程度在较低水平,保证槲树正常生长。重度盐胁迫下,三种保护酶先后遭到破坏并逐渐失活,氧代谢紊乱,氧化胁迫最终导致焦叶现象的出现。王瑞刚等对于I-214杨(P.×euramericanacv. I-214.)的研究表明,盐胁迫下,I-214杨SOD和POD活性下降后,丙二醛含量和电解质外渗率大幅上升,其盐害症状随即显现[28],这与本研究结果一致。
可溶性糖和脯氨酸是植物体内重要的渗透调节物质,对保持原生质与环境的渗透平衡起重要作用,其含量与耐盐性呈正相关[29-30]。Han等[31]发现,盐胁迫下AtslZ1过表达株拟南芥(Arabidopsisthaliana(L.)Heynh.)耐盐性优于野生型,是通过促进脯氨酸和可溶性糖的积累实现的。本研究认为,轻中度盐胁迫下,槲树可溶性糖和脯氨酸均有小幅积累,对于调节槲树渗透平衡,以及适应盐胁迫有所帮助。研究表明,栓皮栎在高浓度胁迫下脯氨酸和可溶性糖均显著积累[3],而锐齿槲栎则无明显渗透调节物质的积累[1]。栎类树种渗透物质的积累情况差异较大,槲树可能介于二者之间,具有一定的渗透调节能力。综合离子浓度的研究结果,本研究认为,槲树的渗透调节可能更依赖于离子稳态的建立,脯氨酸和可溶性糖的积累对槲树的调节起辅助作用。
综上,NaCl对槲树的伤害主要为离子毒害作用,可导致细胞膜透性增大及抗氧化酶系统活性降低,焦叶黄斑等盐害症状随之产生。其主要依靠Na+在根系的积累和Ca2+向地上部分的转运,可能通过根系少量吸收土壤中的Mg2+,建立离子稳态,以减轻地上部分离子毒害;通过提高CAT、SOD两种保护酶活性,以缓解氧化胁迫;小幅积累脯氨酸和可溶性糖,辅助调节渗透平衡。可见槲树具有一定的耐盐性,能够适应200 mmol/L以下的盐胁迫。由于华北地区平均土壤含盐量在0.3%左右,最高达到了1.39%[32],低于槲树所能适应的盐胁迫浓度,因此在华北平原轻、中度盐渍化土壤的园林绿化中,可选择槲树试用。

