五台山亚高山土壤真菌海拔分布格局与构建机制
罗正明,刘晋仙,暴家兵,王 雪,吴 强,柴宝峰,*
1 忻州师范学院地理系,忻州 034003 2 山西大学黄土高原研究所,黄土高原生态恢复山西省重点实验室,太原 030006 3 山西省五台山国有林管理局,繁峙 034300
生物和生物群落的海拔分布格局与维持机制是生物地理学研究的重要议题。海拔梯度的特征是在很短的地理距离内有明显的气候和生态变化。因此,海拔梯度为评估地表植被周转率、当地土壤条件和气候状况对生物群落空间格局的影响提供了一个重要的平台[1]。大量的研究表明,哺乳动物、树木、鸟类、昆虫等大型生物类群在气候、空间、历史和生物等潜在力的驱动下,通常呈现单调递减或驼峰状的多样性海拔分布格局[2-4]。随着分子生物学方法在微生物生态学中的应用,近十年来,土壤微生物群落的海拔分布格局受到越来越多的关注[5-6]。尽管微生物驱动着地球上许多重要的生物地球化学循环,但与大型生物群落相比,我们对微生物多样性的海拔分布格局还知之甚少。真菌作为土壤微生物的重要组成部分,驱动着许多关键的生态系统过程,包括凋落物分解、营养循环和植物生长调节[7]。许多研究已经证明真菌的多样性随海拔的升高而降低[8-9],而另一些报告显示,在中海拔地区多样性最大[10],或者没有显著的海拔分布模式[11]。
与动植物等大型生物相比,需要对土壤微生物群落的海拔分布模式进行更多的研究,以便更好的揭示其潜在的机制。虽然之前的研究为微生物生物地理学的解释提供了一个概念框架,但微生物生物地理学的群落构建机制仍不清楚,且存在争议。微生物群落构建的理论基础主要包括生态位理论和中性理论。传统的生态位理论(niche theory)假设环境条件(如pH、温度、盐和湿度)、物种特征(如丰度、代谢和形态)、物种间相互作用(如竞争、捕食、共生和权衡)等决定性因素控制着群落结构,这通常被称为确定性过程[12-13]。相反,中性理论(neutral theory)假设群落结构独立于物种特征,受随机过程(如出生、死亡、物种形成、灭绝、定殖和扩散限制)控制。越来越多的研究表明,生态位理论(确定性过程)和中性理论(随机性过程),在微生物群落构建过程中不是独立存在的,而是共同起作用的[12, 14-16]。然而,如何定性和定量阐明它们在控制群落结构、演替和分布格局等方面的相对重要性,仍然是亟待解决的问题[8]。
五台山(112°48′—113°55′E; 38°27′—39°15′N)位于山西省东北部,黄土高原的东缘,主峰叶斗峰为华北最高峰,高达3058 m,有“华北屋脊”之称,是中国华北境内生物多样性最丰富的地区之一[17]。五台山海拔2000 m以上的地带属于典型的亚高山生态系统,是全球气候变化的敏感区。五台山亚高山地带沿海拔梯度有明显的植被垂直带谱:草甸带(海拔2800 m以上)、灌丛草甸带(海拔2500—2800 m)、针叶林带(海拔2000—2500 m)。在亚高山生态系统中,个体迁移、物种竞争、土壤养分转化和微生物群落对等环境因素变化的响应可能更敏感和快速[18],这为研究生物多样性及构建机制提供了理想的平台。在本研究中,我们选择五台山亚高山生态系统中不同海拔梯度土壤真菌群落为研究对象,运用Illumina Miseq高通量测序技术,旨在探讨:(1)沿海拔梯度,土壤真菌群落结构组成和多样性分布格局;(2)影响土壤真菌多样性和构建机制的主要驱动因子;(3)确定性过程和随机过程在土壤真菌群落构建机制中的相对作用。
1 材料与方法
1.1 样品采集
2017年8月,在五台山北坡2000—3058 m的海拔梯度范围内分别设立15个不同海拔的采样点,分为3个海拔梯度:即高海拔梯度(High elevational gradient, HEG)(2900—3055 m)、中海拔梯度(Medium elevational gradient, MEG)(2500—2800 m)和低海拔梯度(Low elevational gradient, LEG)(2000—2300 m)(表1),每个海拔梯度包含5个不同的采样点。在每个采样点,设置3个1 m×1 m的样方,样方之间间隔约20 m。用土钻采集表层土壤样品(0—10 cm),每个样方内采集5个子样(每个角1个,中心1个),在聚乙烯袋中混合成一个样品。经2 mm网筛,将大部分根、动物和石头去除,然后将样本分成两部分。其中一部分风干后进行理化分析,另一部分保存在-80℃冰箱中,用于DNA的提取。在每个样方中调查植被参数,记录每种植物的名称、高度、盖度及多度等指标。植物的丰富度指数(richness)采用单位面积内的物种数目来测度物种的丰富程度。
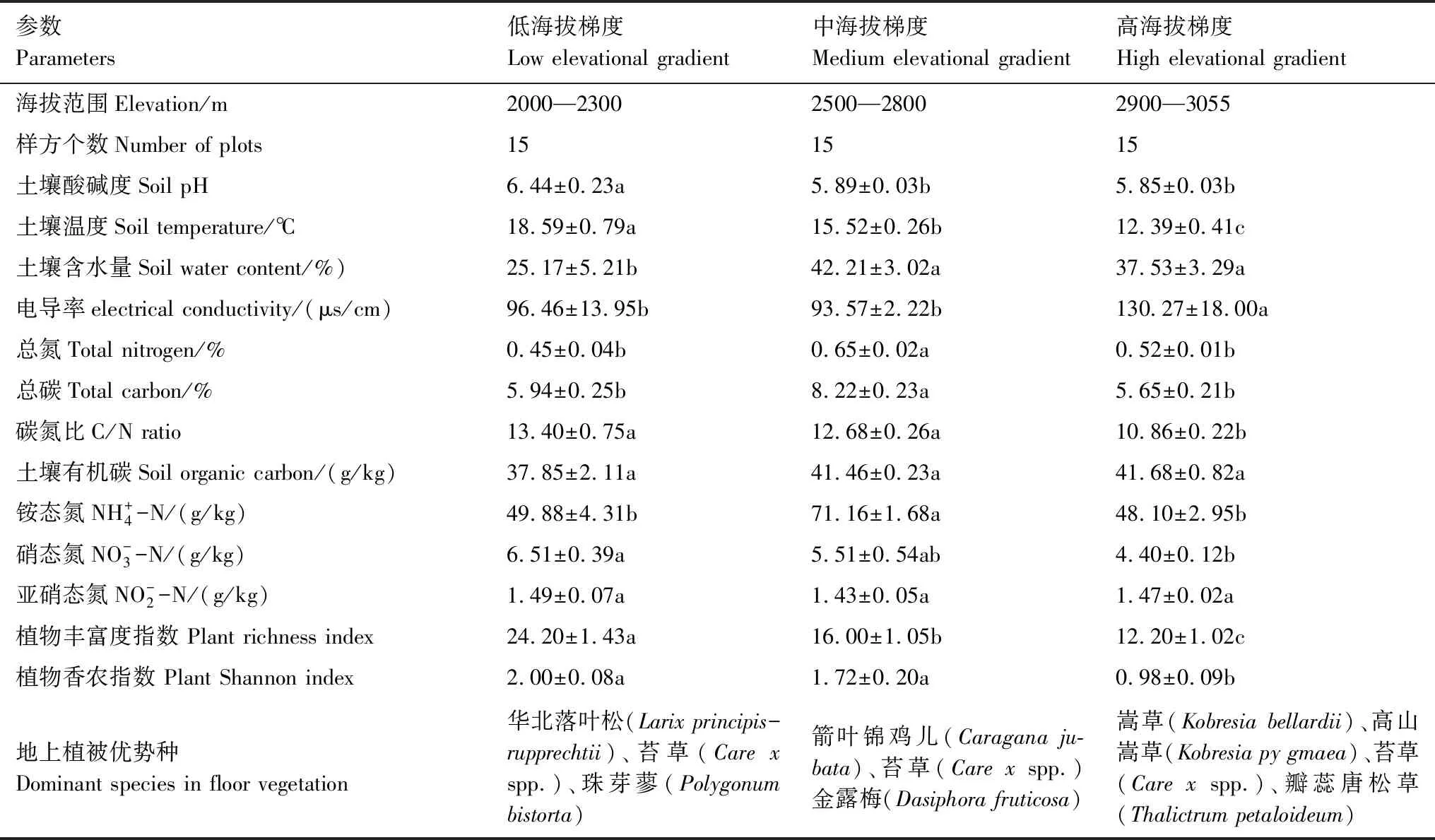
表1 不同海拔梯度下土壤理化性质与植物多样性参数Table 1 Soil physical and chemical properties and plant diversity parameters under different along elevational gradients
1.2 土壤理化性质测定
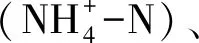
1.3 DNA提取及Miseq高通量测序
称取0.5 g土壤样品,使用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek, USA)按照试剂盒使用说明书步骤提取和纯化土壤微生物DNA。将每个采样点的3个土壤样品等体积混合,一共15个DNA样品,送往上海美吉生物医药科技有限公司进行高通量测序。采用ITS1F(正向引物5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(反向引物5′-GCTGCGTTCTTCATCGATGC-3′)对真菌核糖体的ITS1高可变区进行PCR扩增,并通过Illumina Miseq测序平台对扩增产物进行测序。剔除嵌合序列后,剩下的序列使用UPARSE以97%的相似性作为阈值划分分类操作单元(Operational taxonomic units,OTUs)。
1.4 数据分析
基于R studio(v.3.4.3)vegan包,计算真菌和植物的α多样性(Shannon指数和Richness指数)和β多样性(每对样本之间的Bray-Curtis差异),以及采用非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)和相似性分析(Analysis of similarity,ANOSIM)对不同海拔梯度间真菌群落组成进行了比较。用邻体矩阵主坐标(Principal coordinates of neighbor matrices,PCNM)分析空间变量对土壤真菌群落的影响,用R studio(v.3.4.3)vegan包中的PCNM函数进行前选择,筛选出显著的PCNM空间变量(P<0.05)。基于CANOCO 5.0软件,采用典范对应分析(Canonical correspondence analysis,CCA)评价真菌群落结构与环境变量之间的相关性。在CCA之前,使用逐步回归和蒙特卡罗置换测试对所有环境变量进行前选择,选择具有统计学意义(P<0.05)的环境变量进行下一步分析。采用Mantel和Partial Mantel检验评价了真菌群落与环境变量和空间距离的相关性。采用方差分解分析(Variance partitioning analysis, VPA)测量环境变量和空间变量对真菌群落结构变化的相对贡献。环境变量和空间距离的变量在VPA之前都进行了前选择(CANOCO 5.0)。利用IBM SPSS statistics 20进行皮尔逊相关性分析(Pearson correlation test)以及采用单因素方差分析(One-way analysis of variance)和Duncan多重比较分析进行显著性差异分析,显著性水平设为P<0.05。
2 结果与分析
2.1 土壤理化性质和植被参数
2.2 真菌群落组成和多样性
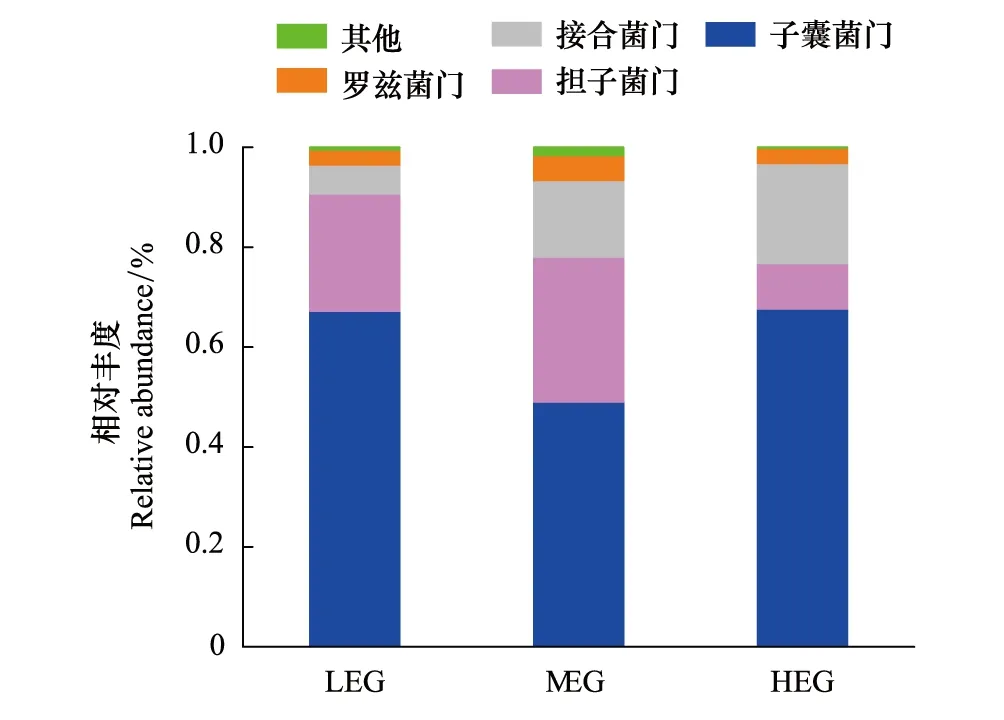
图1 三个海拔梯度土壤优势真菌门(平均相对丰度> 1%)的相对丰度Fig.1 Relative abundance of the dominant fungal phyla (with average relative abundance > 1%) among three elevational gradients LEG:低海拔梯度,Low elevational gradient;MEG:中海拔梯度,Medium elevational gradient;HEG:高海拔梯度,High elevational gradient
通过高通量测序,在15个样本中共检测到994035个真菌序列,样本的序列条数分布在 49957—78813之间(每个样品平均66269个)。按最小样本序列数(49957)抽平,共鉴定出3752个OUT (>97%序列相似性水平)。15个样地中共鉴定出子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridimycota)、球囊菌门(Glomeromycota)、芽枝霉门(Blastocladiomycota)、罗兹菌门(Rozellomycota)7个真菌门,包括32个纲、106个目、225个科、482个属和759个种。其中子囊菌门、担子菌门、接合菌门和罗兹菌门(相对丰度为>1%)被定义为优势门(图1)。图1中可以看出,随海拔升高,子囊菌门、担子菌门和罗兹菌门的相对丰度没有明显的变化趋势,而接合菌门的相对丰度随着海拔升高呈明显上升的趋势。
通过分析土壤真菌群落α多样性与海拔的相关关系,来确定土壤真菌群落α多样性的海拔分布格局。结果表明,土壤真菌群落 Shannon 指数和 richness 指数均与海拔高度呈显著的负相关(r=-0.581,P<0.05),随海拔的升高,α多样性呈下降的趋势(图2)。基于Bray-Curtis距离计算土壤真菌群落的β多样性,并确定了土壤真菌群落β多样性与海拔距离(欧式距离)的相关关系。结果表明,在亚高山生态系统中,土壤真菌群落之间的相异性随着海拔距离的增加而显著升高(r=0.464,P<0.001)(图3)。这说明亚高山带不同海拔梯度上的环境差异是影响真菌群落多样性和生物地理分布格局的重要因素。
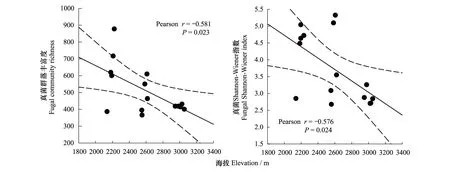
图2 海拔与土壤真菌α多样性的关系 Fig.2 Relationship between elevation and soil fungal diversity
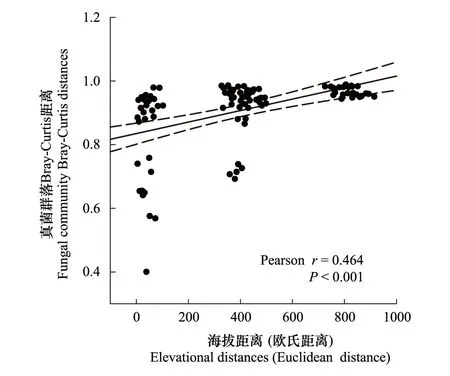
图3 土壤真菌β多样性与海拔距离(欧式距离)的关系 Fig.3 Relationship between soil fungal β-diversity and elevational distance(Euclidean distance)
基于Bray-Curtis距离的非度量多维尺度分析(NMDS)分析了沿海拔梯度土壤真菌群落结构的变化(图4),高、中、低海拔梯度的样本基本分离。利用相似性分析(ANOSIM)进一步对3个海拔梯度土壤微生物群落的群落结构差异性进行了分析。结果显示真菌群落组成在3个海拔梯度上均有显著性差异(P<0.001)(图4)。进一步表明土壤真菌物种多样性和群落组成具有明显的海拔分异。
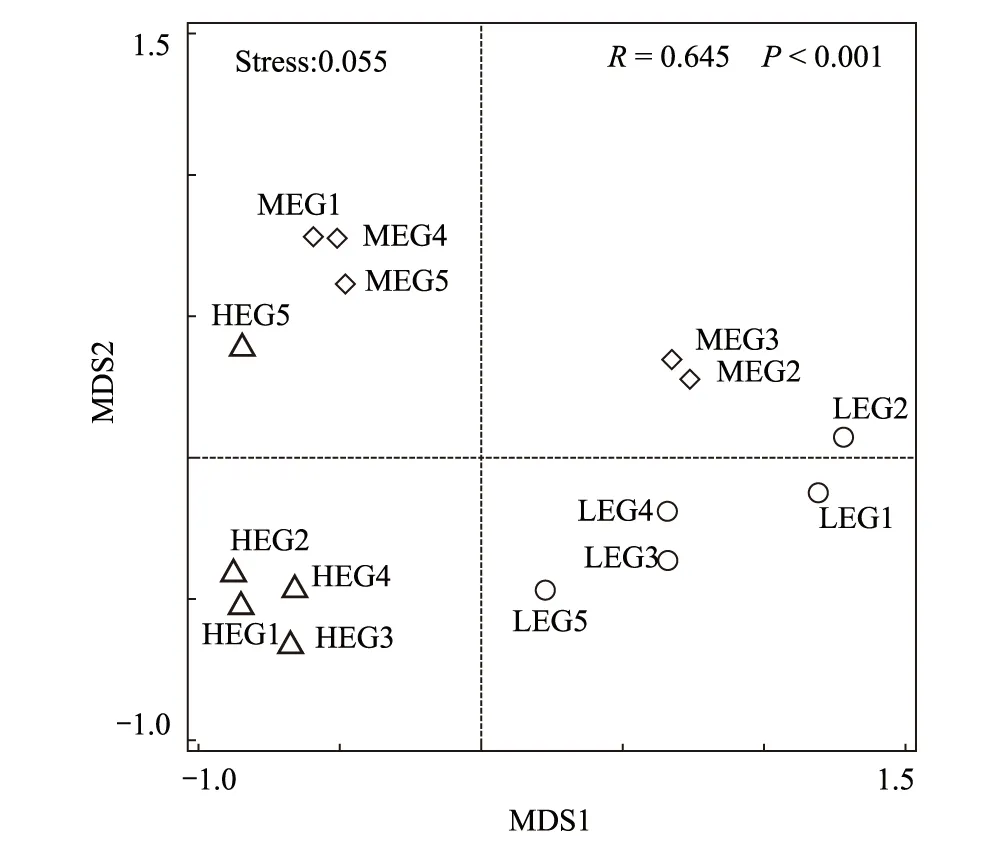
图4 基于Bray-Curtis距离的真菌非度量多维尺度分析(NMDS)Fig.4 Non-metric multidimensional scaling (NMDS) of soil fungal community along the elevational gradient图中r =0.645, P<0.001为不同海拔梯度之间相似性的ANOSIM检验结果; LEG1:低海拔梯度样本1,Low elevational gradient sample 1;LEG2:低海拔梯度样本2,Low elevational gradient sample 2;LEG3:低海拔梯度样本3,Low elevational gradient sample 3;MEG1:中海拔梯度样本1,Medium elevational gradient sample 1;MEG2:中海拔梯度样本2,Medium elevational gradient sample 2;MEG3:中海拔梯度样本3,Medium elevational gradient sample 3;HEG1:高海拔梯度样本1,High elevational gradient sample 1;HEG2:高海拔梯度样本2,High elevational gradient sample 2;HEG3:高海拔梯度样本3,High elevational gradient sample 3
2.3 影响土壤真菌群落变化的环境因子和空间变量
为了探索海拔梯度下土壤真菌群落形成和变化的关键环境驱动因子,采用CCA对环境变量进行了分析。轴1和轴2分别解释变异量24.1%和14.0%,说明环境因子对真菌群落结构具有很大的影响。其中pH、植物丰富度、总碳含量显著影响了土壤真菌群落结构变化(P<0.05),是最重要的环境驱动因子(图5)。

图5 土壤真菌的群落结构与环境因子的CCA分析 Fig.5 Canonical correspondence analysis (CCA) of soil fungal community structure with environmental factorsTC:总碳含量,Total carbon;Plant richness:植物丰富度指数,Plant richness index
为了进一步了解植被参数对土壤真菌群落的影响,分析了土壤真菌群落与植物多样性之间的相关关系(图6)。结果表明,土壤真菌和植物的丰富度指数显著相关(r=0.691,P=0.004),它们之间的β多样性也有显著的相关关系(r=0.418,P<0.001)。这些结果进一步表明植物群落组成对五台山北坡海拔梯度上的土壤真菌群落具有重要影响。
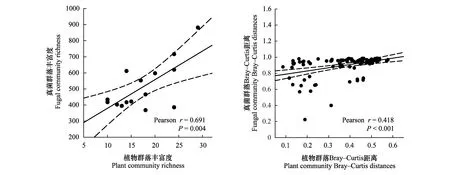
图6 土壤真菌群落与植物多样性之间的相关关系Fig.6 Relationship between soil fungal community and plant diversity
为了探讨确定性过程和随机过程在亚高山土壤真菌群落生物地理学海拔分布格局的相对作用。通过空间变量(PCNM特征向量)和环境因子之间的VPA分析,定量了两者对土壤真菌群落变化的相对重要性。结果表明环境因子和空间变量共解释了真菌群落变异的52.8%,其中环境因子单独解释了24.4%,空间变量单独解释了2.0%,环境因子对群落结构变异的贡献远大于空间变量(图7)。说明土壤真菌群落构建过程中,确定性和随机性过程都起作用,而且确定性过程占绝对的优势。通过Mantel和Partial Mantel分析进一步验证了环境因子和空间变量对真菌群落结构的影响(图7)。结果表明无论环境因子和空间变量单独还是共同作用,对真菌群落结构变化均有显著影响(P<0.05),进一步证实确定性过程和随机性过程在微生物群落构建过程中是共同起作用的。
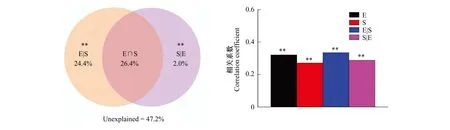
图7 环境因子与空间变量对土壤真菌群落影响的VPA分析和Partial Mantel分析 Fig.7 VPA and Partial Mantel test of the effects of environmental factors and spatial variables on soil fungal communities* P<0.05; ** P<0.01;E:环境变量,Environmental variables;S:空间变量,Spatial variation;E|S:单独的环境变量,Pure environmental variation;S|E:单独的空间变量,Pure spatial variation; E∩S:环境与空间共同解释的变量,Share explained variation
3 讨论
海拔多样性分布格局是生物地理学中最基本的模式之一。本研究中,真菌群落α多样性随海拔高度的增加呈线性减少(图2),这与Bahram等[9]和Shen等[19]报道的一致。目前土壤真菌多样性的海拔分布格局尚存在一些争议,表现出下降、驼峰、U型和无趋势等多种海拔分布格局。例如,Bahram等[9]发现,伊朗北部温带原生林外生菌根真菌物种丰富度随海拔升高而单调下降。Miyamoto 等[20]用日本富士山海拔梯度上外生菌根真菌物种丰富度呈单峰分布的格局。Shen等[11]的研究结果表明长白山土壤真菌的丰富度与海拔高度无关,但与土壤pH值有很强的相关性。Wang等[21]发现,青藏高原色季拉山海拔3106 m至4479 m的土壤真菌的物种丰富度呈U型的趋势。有研究表明同一山地生态系统由于不同海拔区域之间的环境条件显著不同,在不同海拔上的真菌群落在适应环境变化的能力也不同[22]。说明土壤真菌多样性海拔分布格局的不同主要是不同区域的环境差异引起的,特别是影响群落构建的关键环境因子,使其海拔分布格局的内在机制不一样。
本研究结果表明,确定性过程和随机过程对真菌群落海拔分布格局均有显著影响(图7),但是确定性过程的相对作用(24.4%)明显大于随机性过程(2.0%),这表明在五台山亚高山生态系统,土壤真菌群落的海拔分布格局和构建过程中,确定性过程(中性理论)起主导作用。土壤真菌群落之间的相异性(基于Bray-Curtis 距离)随海拔距离的增加而显著增加(图3),说明环境过滤是五台山亚高山土壤真菌群落海拔分布格局的主要驱动力。这与乔沙沙[23]和赵鹏宇[24]的研究结果一致,真菌群落结构主要受到确定性过程(环境选择)的影响,而空间变量对真菌群落构建的相对作用较弱(图7)。因此,确定性过程主导了五台山局域海拔尺度下土壤真菌群落分布模式的很大程度的变异。这主要是因为海拔梯度上的生态环境显著不同[5],对土壤微生物产生了环境过滤的作用,从而导致土壤真菌群落的结构和组成在不同海拔存在明显的差异。随着空间距离的增加,影响选择过程的环境因子也会增加,难以产生很强的扩散性。
土壤pH、植物丰富度和总碳含量是真菌群落组成变化的主要驱动因子。在以往的许多研究中,土壤 pH都被认为是影响微生物包括真菌群落的关键因子[5, 21],对土壤真菌的生长繁殖以及胞外酶的分泌均具有显著影响。我们的结果显示土壤pH是影响土壤真菌群落结构沿海拔梯度变化的最重要环境因子(图5)。目前许多研究都证实了土壤pH值对真菌群落具有较强的影响。Liu等[5]发现pH值是中国西南地区沿海拔梯度土壤真菌多样性的一个重要预测因子,且土壤pH值越高,土壤真菌多样性指数越高。另一个在长白山对微生物和植物的海拔分布模式的研究发现,土壤pH对真菌群落多样性的海拔分布模式和群落结构的海拔分异均有显著的影响[11]。本研究区在中、高海拔梯度的过酸性土壤可能会限制大部分土壤真菌的生长和繁殖,从而使中、高海拔梯度的多样性降低。这一结果得到了pH控制实验的支持,该实验表明,较低的pH值可以维持微生物群落的稳定,但不能促进微生物群落的大量繁殖[25]。
关于植物丰富度和总碳含量对真菌群落的重要影响,我们的结果证实植物物种丰富度是真菌丰富度和群落结构的重要预测因子(图5和图6)。真菌与植物关系非常密切,在陆地生态系统中扮演着植物分解者、病原体和共生体等重要角色[26]。由于根深、根系分泌物、冠层覆盖度和凋落物质量及数量的不同,植物种类及其群落组成也会影响微生物群落结构[27]。目前,关于植物多样性与土壤真菌群落结构之间的相关性还没有一致的定论。Tedersoo等[7]在全球尺度的研究中发现,土壤真菌丰富度与植物多样性之间仅存在微弱的间接关系。在全球范围内,真菌群落受到气候和土壤因子的强烈影响,也受到区域进化和灭绝的历史影响,这可能掩盖了植物多样性与真菌多样性之间的关系。因此,全球或大陆尺度的研究可能不适用于处理土壤真菌多样性与植物多样性之间的微妙联系[26]。此外,生物群体之间的相互作用和共同进化被认为主要发生在局部到区域尺度上[28],因此,植物多样性效应可能更倾向于在这些尺度上表达。本研究CCA和皮尔森相关关系分析结果显示(图5和6),在局域海拔尺度上土壤真菌多样性与植物多样性(α和β多样性)呈显著正相关关系。这表明植物多样性和真菌多样性之间在局域海拔尺度下具有交互关系,这与之前发现两者之间具有互利共生机制相一致[29]。植物多样性对土壤真菌多样性的显著影响具有重要的生态学意义。说明即使是草地植物的小个体,也可能通过提供不同质量的根环境、分泌物、根和叶凋落物而产生互补的地下生态位,从而可以支持各种生物营养真菌和腐生真菌有更大的多样性[29]。此外,真菌与寄主植物的遗传相容性是真菌多样性效应的另一种潜在机制[30]。以往的研究表明,真菌多样性和群落结构的变化可能受土壤养分的调控[31]。土壤碳是真菌的基本能量来源和组成元素,可利用碳的多少可以影响土壤真菌的海拔分布[32]。本文的研究结果也证实了这一观点。
4 结论
我们通过Illumina Miseq高通量测序技术分析了五台山亚高山土壤真菌多样性分布格局以及群落构建机制。不同海拔梯度土壤真菌群落的组成和多样性之间存在显著差异,并且沿着海拔升高而多样性呈现显著下降的趋势。在局域海拔尺度下,土壤真菌多样性与植物多样性(α和β多样性)呈显著正相关关系。确定性过程和随机过程共同驱动了五台山亚高山土壤真菌的海拔多样性分布格局,但确定性过程占主导地位。土壤pH、植物丰富度和总碳含量是影响真菌群落组成变化的主要环境因子。本研究结果不仅有助于了解局域海拔尺度下,真菌群落的构建机制,也为预测微生物群落对环境条件变化的响应、适应和反馈提供理论依据。
致谢:本项目采样过程得到山西省五台山国有林管理局李吉龙和李勇的协助,特此致谢。

