锶暴露对中华大蟾蜍蝌蚪生长发育的影响及其遗传毒性
姚凯,牛晓娟,王徐,李彩云
贵州师范大学生命科学学院,贵阳 550025
锶(Sr)与钙同为碱土金属元素,具有相似的物理化学性质,在一些代谢过程中锶能够替代钙的功能[1-3]。贵州省温泉出水锶含量为0.2~20.9 mg·L-1,呈正态分布,其中,约57%的温泉出水锶含量在1~5 mg·L-1的范围内,主要以氯化物的形式存在。贵州温泉平均锶含量是贵州地表水平均锶含量的7.5倍,是世界淡水平均锶含量的47倍[4]。近年贵州省温泉业的兴起对地方经济做出贡献,但同时也对环境安全造成潜在的威胁。温泉业除带来大量生活污水外,温泉水还把较高浓度的锶元素搬运到地表并积累,对动植物都具有一定的影响。两栖动物是联系水生和陆生环境的特殊物种,其幼体鳃和皮肤薄且渗透性强,对水质变化极为敏感[5],是水体环境质量监测的重要的指示生物[6]。中华大蟾蜍(B.gargarizans)是我国的广布种,在不同海拔生境中均大量出现。研究表明,中华大蟾蜍的胚胎和幼体对水体中的铜、铝、汞和镉等金属污染物比较敏感[7-9],因此,可作为进行生态毒理学研究及水体环境评价的理想物种。对中华大蟾蜍蝌蚪在不同浓度Sr2+处理下,其遗传和生化相关指标及生长发育的变化情况进行了研究,旨在探讨Sr2+对中华大蟾蜍蝌蚪的毒性效应,为评估温泉开发对水生动物影响及水体环境监测提供参考依据。
1 材料与方法(Materials and methods)
1.1 材料
实验用中华大蟾蜍蝌蚪于2019年4月下旬采集于贵阳市渔洞峡,根据Gosner[10]的蝌蚪发育分期标准,采集处于发展第36期的蝌蚪。选择这个阶段是因为36期是蝌蚪后肢外化的开始,而个体脚趾的出现发生在蝌蚪发育的第37期。因此,这个发育阶段是蛙类从水生生物向陆生生物转变的重要阶段。采集的蝌蚪被置于约20 L的水箱中培养,培养水体为曝气自来水与河水的混合体,培养温度为18 ℃,每3天更换一次水。使用鸡蛋黄做为饲料进行喂养。培养2 d后,选择大小相近和活动力强者用于试验。试验设置对照组和3个处理组,即在培养水体中分别添加0、0.2、2和20 mmol·L-1的SrCl2,每组5个平行,每个平行中放置30只蝌蚪。处理30 d后,对蝌蚪的生长发育指标、遗传和生化指标进行测定。
1.2 生长发育指标分析
根据Veronez等[11]的方法并略做修改进行蝌蚪的形态学分析。用游标卡尺测量蝌蚪的体长、尾长和总长度,并称量蝌蚪的体重;记录腿的发生和异常情况。最后,根据Gosner[10]提供的简化表,对试验中的蝌蚪发育阶段进行评估。
1.3 彗星试验
形态试验结束后,用1 ml·L-1的利多卡因麻醉蝌蚪。用肝素化的注射器穿刺尾静脉采集血样,用于彗星试验。血液样本在RPMI 1640培养基中稀释至1∶120(V/V),并立即使用。试验根据Veronez等[11]的方法进行,在100倍光学显微镜下随机分析每个重复中的100个细胞,以观测彗星尾部的长度。根据DNA从细胞核迁移的程度,采用视觉分类法对100个细胞进行分析。将处理后的细胞分为5个伤害等级:0为无损伤,1为低损伤(尾长小于核),2为中等损伤(尾长在1倍到2倍核直径之间),3为严重损伤(尾长大于核直径2倍)和4为细胞凋亡[12]。根据观测结果计算蝌蚪的DNA损伤指数(DI),即用每个损伤类别观察到的细胞核数量乘以其各自损伤类别(0~4)的值之和,结果以每个实验组的平均DNA损伤指数表示。
1.4 谷胱甘肽S转移酶(GST)、过氧化氢酶(CAT)活性和金属硫蛋白(MT)含量测定
采集血液后,将蝌蚪杀死并取出肝脏进行酶活性及蛋白含量分析。肝脏在磷酸盐缓冲溶液(pH 7.0)中冰浴研磨为匀浆后,在18 000 r·min-1下离心30 min,获得的上清液用于酶活性和蛋白浓度分析。GST(EC 2.5.1.18)的活性使用含有1 mmol·L-1的1-氯-2,4-二硝基苯(CDNB)和1 mmol·L-1的谷胱甘肽(GSH)的磷酸盐缓冲溶液(pH 7.0)作为反应混合物测定,在412 nm下测定OD值以计算酶活性。CAT(EC1.11.1.6)活性通过测定H2O2浓度的下降来计算,在反应缓冲液中含有10 mmol·L-1的H2O2、1 mmol·L-1Tris-HCl和5 mmol·L-1EDTA,在405 nm处测定OD值的变化以计算酶活性。MT含量测定采用镉血红蛋白饱和法[13]。按照每分子MT结合6个镉(Cd)原子换算成MT的含量。MT含量计算公式为:MT(μmol·g-1)=Cd(μg·g-1)/112.4/6。
1.5 数据分析
用Excel和SPSS 15.0(IBM, Chicago, USA)软件进行数据处理与分析,数据以平均值±SD的形式表现,组间差异进行显著性t检验,以P<0.05作为显著性依据。文中所有的插图均用Origin 9.0 (OriginLab, Hampton, USA)绘制。
2 结果(Results)
2.1 Sr2+处理对中华大蟾蜍蝌蚪生长发育的影响
由表1可知,经过30 d处理后,对照组有77.6%的蝌蚪发育到42~46阶段。而在0.2 mmol·L-1Sr2+处理组,进入42~46阶段的蝌蚪占总数的88.7%,并且有41.6%的蝌蚪进入到发育的46阶段,后腿完全发育和尾部完全被吸收,即变态发育过程完全结束。2 mmol·L-1和20 mmol·L-1Sr2+处理组的蝌蚪,与对照组相比,表现出发育迟滞的现象,分别只有59.9%和48.5%的蝌蚪进入到42~46阶段。
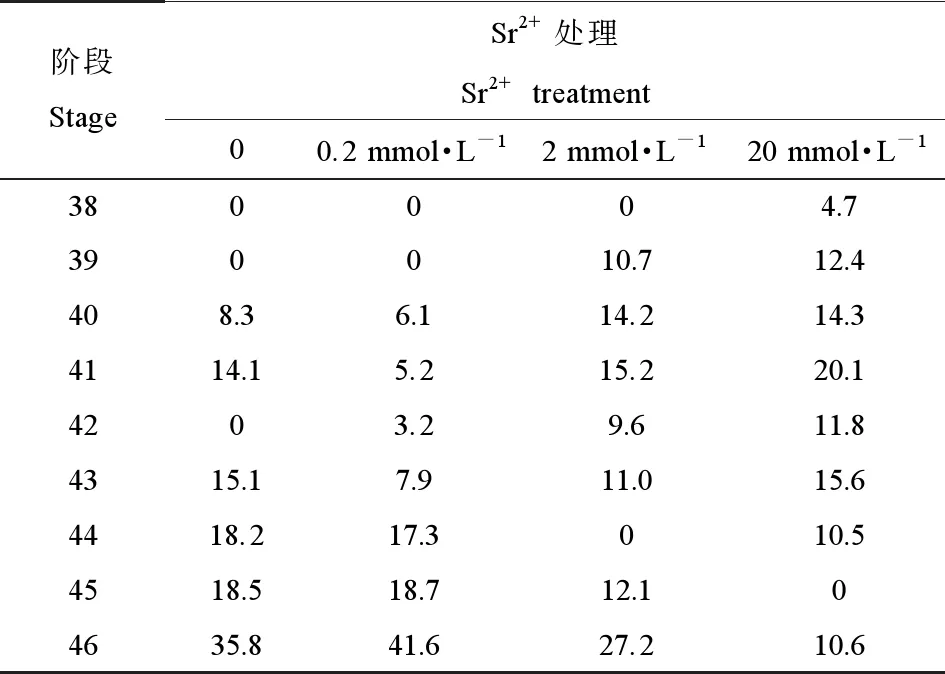
表1 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪的发育状况(%)Table 1 Frequency of developmental stages in B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d (%)
经过30 d处理后,每处理组5个平行各随机选取5只蝌蚪测量生长指标。结果表明(表2),0.2 mmol·L-1Sr2+处理组和对照组蝌蚪长度和体重并没有明显的区别。但是,2 mmol·L-1和20 mmol·L-1Sr2+处理组的蝌蚪的生长受到了显著的抑制,长度和体重都要低于对照组,且处理浓度越高,蝌蚪生长受抑制的现象越明显。

表2 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪的生长指标Table 2 Biometrical data of B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d
2.2 Sr2+处理对中华大蟾蜍蝌蚪红细胞DNA损伤的影响
经过30 d处理后,每处理组5个平行各随机选取7只蝌蚪进行DNA损伤等级检测。由表3可知,随着Sr2+处理浓度的上升,处于高DNA损伤等级的红细胞数目上升,在20 mmol·L-1Sr2+处理组的蝌蚪分别有4.8%的红细胞DNA达到第3伤害等级,有2.1%的红细胞DNA达到第4伤害等级,而在其他3个组几乎没有蝌蚪的红细胞DNA达到第3和第4伤害等级。由图1所示,0.2 mmol·L-1Sr2+处理组和对照组蝌蚪红细胞的DNA损伤指数没有显著差异。但是,2 mmol·L-1和20 mmol·L-1Sr2+处理组的蝌蚪,与对照组相比DI指数显著上升,且处理浓度越高,DI指数越高。

表3 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪的红细胞DNA损伤等级(%)Table 3 Classes of DNA damage in erythrocytes of B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d (%)
2.3 Sr2+处理对中华大蟾蜍蝌蚪GST、CAT活性和MT含量的影响
蝌蚪肝脏内的GST和CAT活性在Sr2+处理下表现出相似的变化规律(图2),即0.2 mmol·L-1Sr2+处理组和对照组没有显著差异,但是在2 mmol·L-1和20 mmol·L-1Sr2+处理组的GST和CAT的活性均显著上升。在0.2 mmol·L-1处理组,GST和CAT的活性分别是对照组的0.98倍和1.01倍;在2 mmol·L-1处理组,GST和CAT的活性分别是对照组的1.49倍和1.13倍;在20 mmol·L-1处理组,GST和CAT的活性分别是对照组的3.90倍和1.74倍。
如图3所示,处理30 d后,对照组蝌蚪的MT含量为4.26 ng·g-1,0.2 mmol·L-1Sr2+处理组的MT含量为对照组的1.03倍,与对照组没有显著差异;2 mmol·L-1Sr2+处理组的MT含量为对照组的1.55倍,较对照组显著上升;20 mmol·L-1Sr2+处理组的MT含量为对照组的0.74倍,较对照组显著下降。
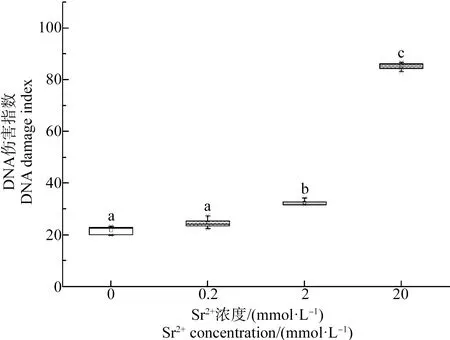
图1 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪的红细胞DNA损伤指数Fig. 1 Index of DNA damage in erythrocytes of B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d
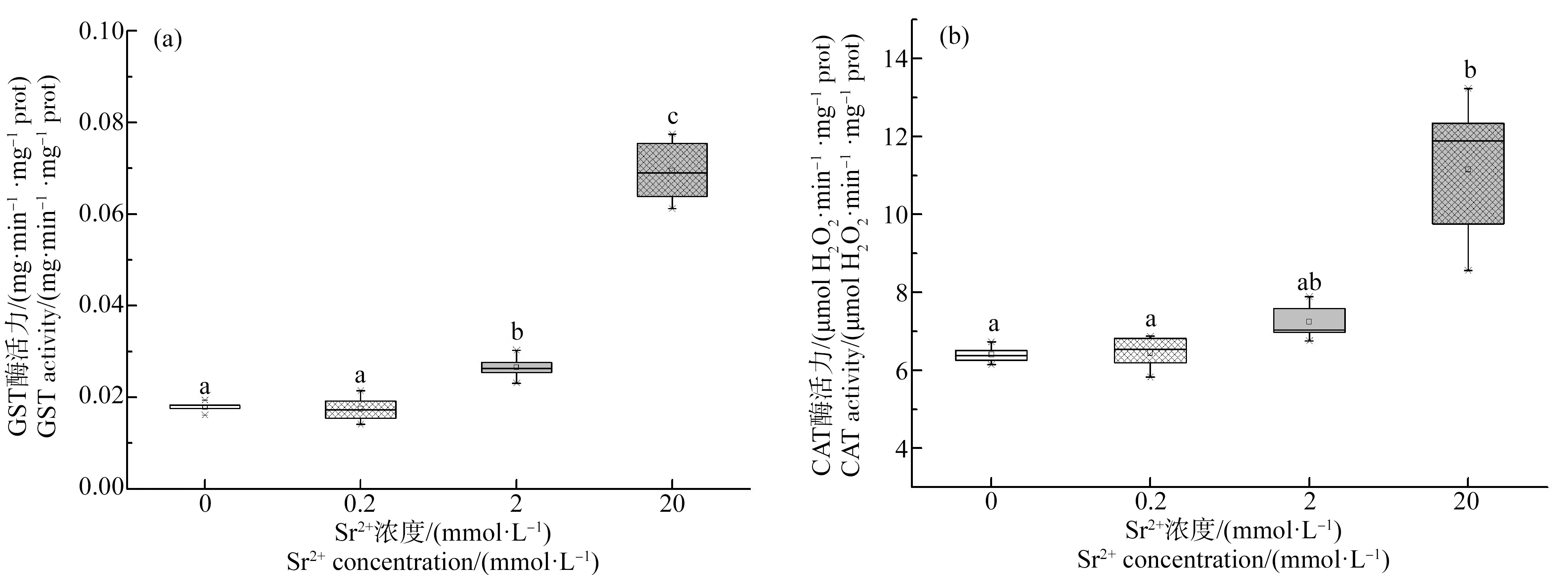
图2 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪肝脏的谷胱甘肽S转移酶(GST)和过氧化氢酶(CAT)活性Fig. 2 The glutathione S-transferase (GST) and catalase (CAT) activity in liver of B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d
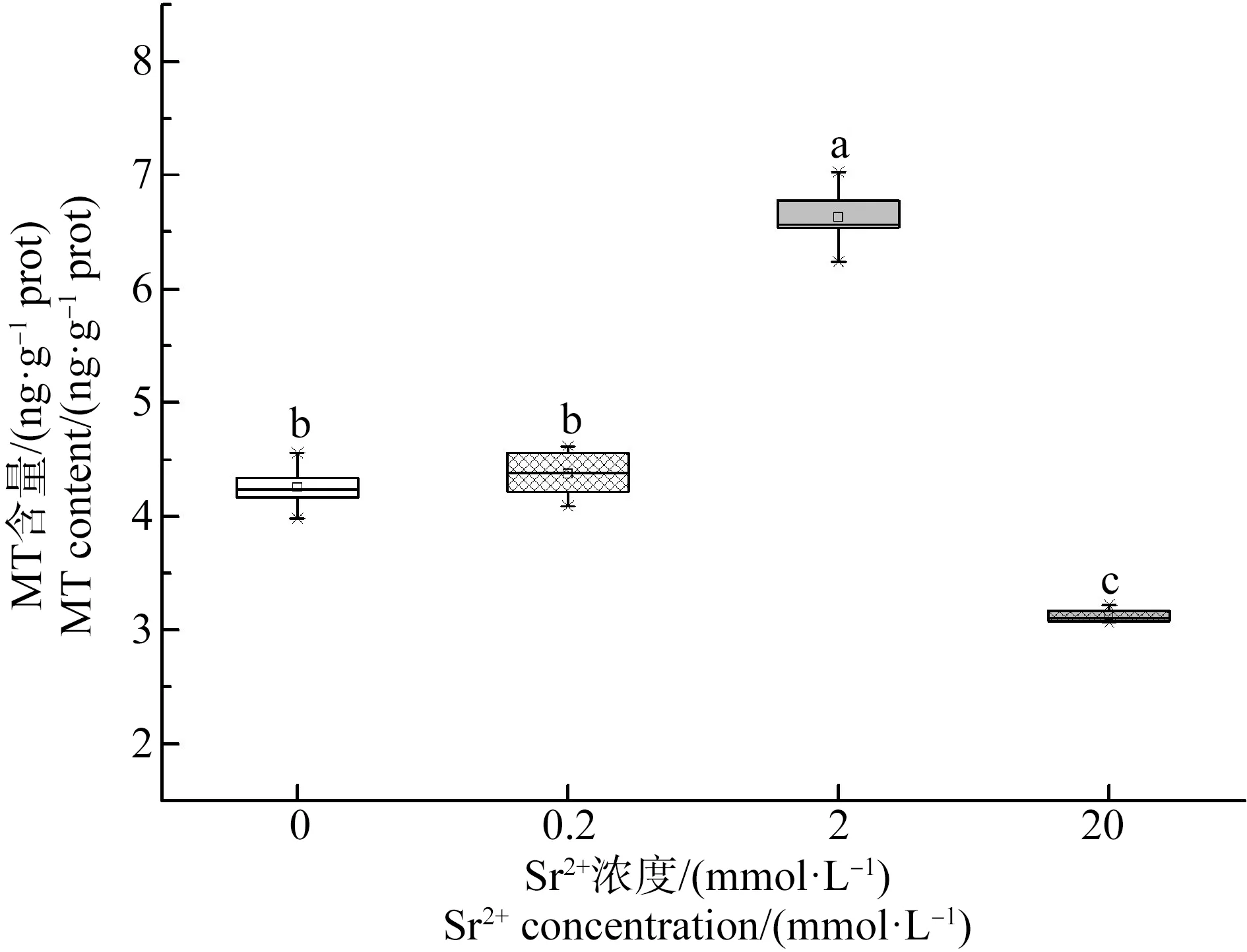
图3 不同浓度Sr2+处理30 d后中华大蟾蜍蝌蚪肝脏的金属硫蛋白(MT)含量Fig. 3 The metallothionein (MT) content in liver of B. gargarizans tadpoles under different concentrations of Sr2+ treatments for 30 d
3 讨论(Discussion)
两栖动物是动物从水生向陆生的过渡类群,在脊椎动物演化过程中占据着特殊的地位。两栖动物的胚胎和幼体发育都在水体中完成,水体中的污染物会对它们的发育和变态产生直接影响[7]。通过试验发现,不同浓度的锶暴露会对中华大蟾蜍蝌蚪的生长发育产生不同的效应。较高浓度的锶暴露会对蝌蚪肝脏产生毒性效应,并抑制其发育和生长。其可能的作用过程如图4所示。
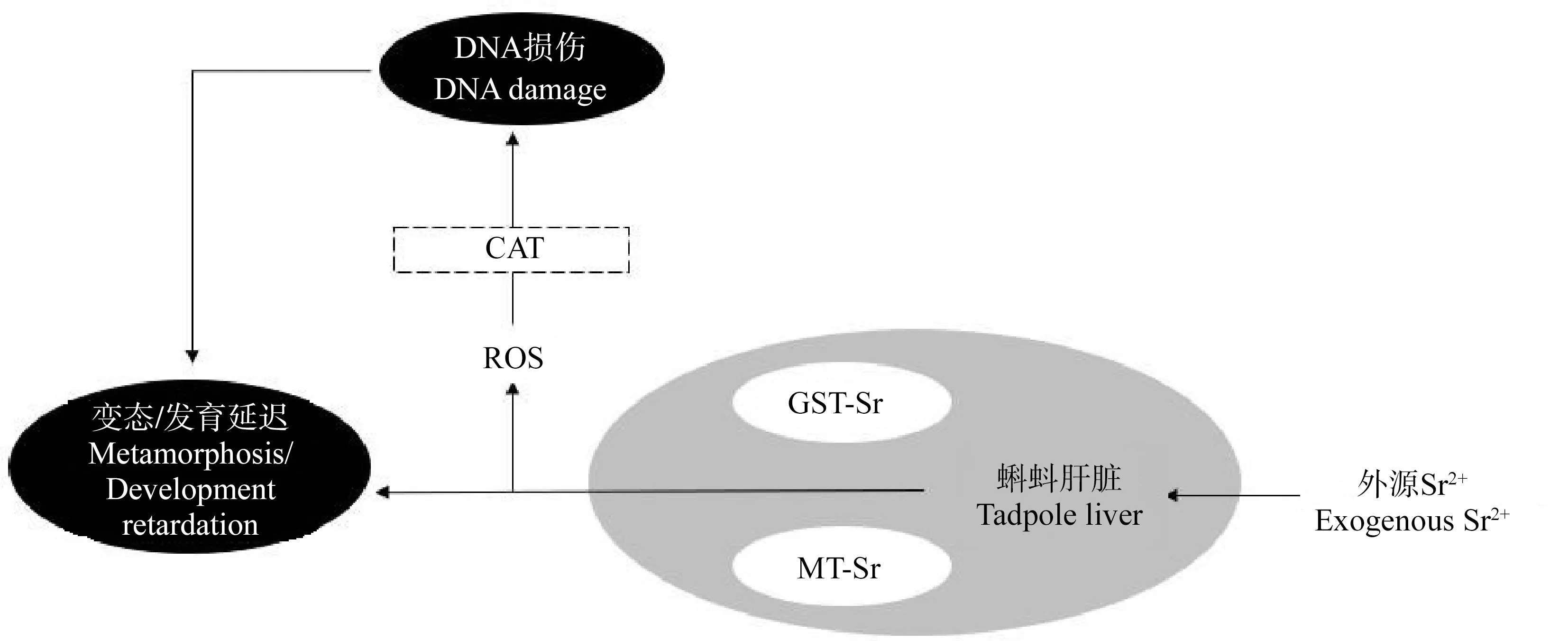
图4 外源Sr2+在蝌蚪体内的作用途径注:ROS表示活性氧。Fig. 4 The action pathway of exogenous Sr2+ in B. gargarizans tadpoleNote: ROS stands for reactive oxygen species.
肝脏是维持动物体内重金属稳态的重要器官,在能量和蛋白代谢方面也有重要作用。而肝脏发生的代谢紊乱会导致两栖动物变态过程的延迟[14]。低浓度的Sr2+暴露条件下,中华大蟾蜍肝脏内的GST活性、MT含量和CAT活性较对照组并没有显著变化,这表明低浓度Sr2+暴露并没有引起蝌蚪机体的毒性反应。在此条件下,蝌蚪红细胞DNA的损伤情况与对照组相比也没有显著差异。另一方面,蝌蚪的发育和生长指标显示,低浓度的Sr2+处理对蝌蚪的发育有一定的促进作用,这可能是因为低浓度的Sr2+可以促进动物细胞的生长和分裂所致。刘存岐等[15]研究发现,低浓度的Sr2+促进了中国对虾(Fenneropenaeuschinensis)糠虾的成活与变态。
中等浓度Sr2+暴露条件下,蝌蚪体内GST活性和MT含量显著上升,这表明2 mmol·L-1Sr2+暴露能够引起蝌蚪机体明显的毒性反应。Van der Oost等[16]对鱼类的研究和Veronez等[11]对牛蛙蝌蚪的研究也有类似的结果。在动物肝脏内,GST能够对各种外源毒害物质起到解毒和中和作用,使其更容易溶于水分并排出体外,是动物体内重要的防御物质[17]。MT在动物受到金属胁迫时在肝脏中合成,并且与金属胁迫存在一定的时间、剂量-效应关系。MT作为机体中毒后诱导产生的解毒蛋白,可以在细胞内与金属结合,降低毒害金属与其他细胞组织的亲和能力,从而起到解毒的作用。动物体的MT含量已被作为水环境监测中重金属胁迫的重要生态毒理学指标[18-19]。此外,蝌蚪体内CAT活性也有较为显著的上升,这表明GST和MT的作用并不能完全消除中等浓度Sr2+暴露产生的毒害作用,中等浓度Sr2+暴露在动物体内引起了氧化应激反应,产生了过量的活性氧(ROS)。已有研究表明,金属毒性与细胞的氧化胁迫密切相关,可导致有机体脂质过氧化水平上升[20-22]。CAT是参与抗氧化防御系统的重要酶,其作用是去除胁迫过程中产生的H2O2,将其代谢为O2和H2O[23]。CAT等活性氧清除酶活性的增加,能保护动植物细胞在逆境中细胞膜和遗传物质不受ROS的破坏。不过彗星分析的结果表明,在中等浓度的Sr2+暴露条件下,蝌蚪红细胞DNA的损伤程度并不严重。但是,蝌蚪的发育和生长还是受到了显著的抑制,这可能与Sr2+能够影响动物体内多种生理过程有关。有研究表明,Sr2+能够在动物体内与Ca2+发生竞争作用,抑制钙的吸收[3]和钙依赖性酶的活性[24-25],从而使蝌蚪的发育迟滞。外界条件对蝌蚪变态发育的影响会对蝌蚪种群的稳定造成严重的后果,变态是无尾两栖动物生活史的一个重要环节,变态率的高低直接影响着陆生成体蛙的数量[26]。环境中高浓度的锶有可能导致两栖动物变态发育过程的延长,使其体型减小且运动能力减弱,更容易受到捕食,从而可能成为导致种群数量下降的重要原因。
高浓度Sr2+暴露条件下,中华大蟾蜍肝脏中的GST活性显著增加。在Sr2+处理下,CAT也表现出与GST相似的反应规律。然而MT含量甚至要低于对照组,这是因为在较高浓度Sr2+长时间处理下,蝌蚪机体整体代谢机能下降,从而使MT合成能力减弱。GST、CAT和MT变化的差异,也表明动物体应对金属毒性时,酶活性调控和保护蛋白合成方面有着不同变化规律。从彗星试验的结果看,高浓度的Sr2+暴露诱导中华大蟾蜍蝌蚪红细胞DNA损伤的加剧。Zocche等[27]在煤矿区对史密斯树蛙(Hypsiboasfaber)蝌蚪红细胞DNA损伤的研究也有相似的结果。这表明,金属对蝌蚪细胞DNA的损伤作用可能是一种普遍的现象。而且,随着Sr2+处理浓度的升高,红细胞DNA的损伤水平也上升,这说明,随着有机体吸收和富集Sr2+的增加,对细胞DNA的危害也越大。这也说明,GST、CAT和MT等对金属毒害的保护作用有一定的限度。在此条件下,中华大蟾蜍蝌蚪的生长和发育也受到了强烈的抑制。
综上所述,低浓度的Sr2+能在一定程度上促进中华大蟾蜍蝌蚪的发育,但是较高浓度的Sr2+暴露对中华大蟾蜍蝌蚪的生长发育产生迟滞作用、对细胞DNA产生损害作用,并对细胞产生氧化胁迫和生理毒害。所以,环境中大量的锶元素有可能对水生动物和两栖动物的生长发育产生危害,并进一步影响其种群数量。研究结果可为评估温泉开发对水生动物影响以及温泉产业发展的生态风险评价提供参考依据。
◆

