微塑料在日本虎斑猛水蚤(Tigriopus japonicus)体内的摄入、排出及对其摄食行为的影响
刘全斌,张明兴,丁光辉,李西山,张典,3,张微微,王莹,#,王菊英,*
1. 大连海事大学环境科学与工程学院,大连 116026 2. 国家海洋环境监测中心,海洋垃圾和微塑料研究中心,大连 116023 3. 自然资源部第三海洋研究所海洋生物与生态实验室,厦门 361000
微塑料(microplastics)通常指尺寸<5 mm的塑料碎片、颗粒或纤维,海洋环境中的微塑料主要来源于大型塑料的破碎和风化[1-2],以及工业原料的泄露和个人护理品的使用[3]。微塑料广泛分布于海洋环境中,在大洋[4]、近岸海域[5]和极地[6]均有微塑料检出。研究发现,北大西洋副热带环流区表层海水中微塑料丰度为13~501 个·m-3[4],对我国海域进行调查发现,黄海表层水体中微塑料丰度为(0.330±0.278) 个·m-3[5]。检出的微塑料主要成分为聚乙烯、聚丙烯、聚苯乙烯、聚氯乙烯和聚酯等[4-7]。
大量研究表明,微塑料能被浮游动物[8-9]、贝类[10-11]和鱼类[12-13]等不同营养级海洋生物摄食并通过食物链传递[14-15]。微塑料被摄入后会造成生物体消化道的物理损伤[16]、摄食行为改变[17]以及诱发炎症反应等[18-19],对海洋生物存在潜在威胁。
浮游动物作为海洋食物网中的关键环节,在物质循环和能量传递过程中起着重要的作用,同时也影响污染物在食物链中的迁移[14,20]。野外调查发现,中国南海及黄海海域采集的浮游生物(桡足类、毛颚类和短尾类等)体内均有微塑料检出,这表明,在自然环境中,浮游动物能够摄入环境中的微塑料[21-22]。实验室研究发现,北大西洋的多种浮游动物能够摄入粒径为1.7~30.6 μm的聚苯乙烯(PS)微粒,并通过“假排泄物”将PS微粒排出体外,暴露在浓度为7×103个·mL-1的PS溶液中的胸刺水蚤(Centropagestypicus),对微藻的摄食显著减少[23]。近期研究发现,卤虫(Artemiaparthenogenetica)幼体也可摄入浓度为1~1×105个·mL-1的10 μm的PS微粒,且PS微粒可在卤虫消化道内停留14 d以上[24]。
微塑料被浮游动物摄入体内后,会对其存活、生长发育及繁殖能力造成不利影响。日本虎斑猛水蚤(Tigriopusjaponicus)摄入粒径为0.05~6 μm的PS微粒后,个体出现死亡和繁殖能力下降[25];卤虫(A.parthenogenetica)摄入粒径为10 μm的PS微粒后,会造成肠道上皮细胞损伤[24];大型溞(Daphniamagna)摄入粒径为100 nm的PS微粒后,生长发育过程受到抑制,繁殖能力下降[26]。目前,大多数研究主要集中在微塑料对海洋生物的毒性效应,但对于微塑料在浮游动物体内的毒动力学过程研究较少;因此,开展浮游生物对微塑料摄入和排出的动力学研究对评估微塑料的生态风险具有重要意义。
本研究使用海洋模式生物日本虎斑猛水蚤(T.japonicus)作为受试生物,探究了日本虎斑猛水蚤对10 μm PS微粒的摄入和排出过程,以及添加PS微粒对其摄食行为的影响,以期为科学评估微塑料的生态风险提供依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
荧光体式显微镜(Leica M205FA,德国);荧光倒置显微镜(Leica DMI4000B,德国)。
荧光聚苯乙烯塑料微粒(10 μm)分散液购自美国Thermo Fisher公司,浓度为1.74×107个·mL-1[24],浓硝酸(HNO3)为分析纯,购自天津市科密欧化学试剂公司,人工海盐购自天津中盐海洋生物科学有限公司。
1.2 微藻培养
实验选用牟氏角毛藻(Chaetocerosmuelleri)和小球藻(Chlorellasp.),藻类培养条件为温度(20±1) ℃,光照强度约2100 lux,光周期12 h(L)∶12 h(D),培养基为f/2培养基。
1.3 受试生物
日本虎斑猛水蚤驯养理化条件:温度(20±1) ℃,光照强度约2 100 lux,光周期12 h(L)∶12 h(D),盐度30.0±0.46,pH 8.2±0.12,溶解氧(DO)浓度(8.45±0.53) mg·L-1。以混合藻类投喂,饵料包括牟氏角毛藻和小球藻,投喂密度比例为1∶1,每3天投喂一次,投喂密度为1×106cells·mL-1。
1.4 实验分组
本研究通过4个实验探究了日本虎斑猛水蚤对PS微粒的摄入和排出的动力学过程及PS微粒的添加对其摄食行为的影响(表1)。实验Ⅰ和实验Ⅱ主要考察日本虎斑猛水蚤体内PS微粒的摄入量和残留量随时间变化情况,实验Ⅲ考察了日本虎斑猛水蚤与PS微粒的相互作用,实验Ⅳ考察了不同浓度PS微粒的添加对微藻生长的影响,以及浓度为1×103个·mL-1的PS微粒对日本虎斑猛水蚤对微藻摄食率的影响。
1.5 摄入(实验Ⅰ)和排出(实验Ⅱ)实验
对日本虎斑猛水蚤的最低微塑料摄入浓度进行了预研究,结果表明,当PS微粒浓度<1×102个·mL-1时,在日本虎斑猛水蚤体内无PS微粒检出,PS微粒浓度为1×103个·mL-1时,适于开展PS微粒在日本虎斑猛水蚤体内的富集和排出动力学研究,此浓度远高于当前水环境中的微塑料检出浓度[4-7]。
实验暴露前,对荧光PS暴露溶液进行超声处理,使用硝酸纤维素滤膜(0.45 μm,Sartorius ACN)进行抽滤,用荧光体式显微镜对PS微粒进行计数,从而确定PS溶液的实际暴露浓度。实验Ⅰ、实验Ⅱ和实验Ⅳ中,在暴露前一天对日本虎斑猛水蚤投喂微藻,投喂密度为1×105cells·mL-1。实验Ⅲ中,暴露前对日本虎斑猛水蚤进行饥饿处理24 h。
实验Ⅰ中,根据暴露时长(0、3、6、9、12、24和48 h)设置7个实验组,每组3个平行,每个平行中暴露溶液体积为20 mL,PS微粒的浓度为1×103个·mL-1,并加入10只龄期一致(蚤龄为(18±1) d)的日本虎斑猛水蚤,置于恒温培养箱中培养,温度(20±1) ℃,光照强度约2 100 lux,光周期12 h(L)∶12 h(D),总暴露时长为48 h,暴露期间不喂食。分别于暴露0、3、6、9、12、24和48 h后,将每个平行中的10只日本虎斑猛水蚤取出,用人工海水冲洗3遍,置于20 mL玻璃闪烁瓶中,加入质量分数为65%的硝酸于40 ℃超声40 min进行消解(荧光PS微粒回收率为100.0%±1.3%[27])。消解后,使用硝酸纤维素滤膜(0.45 μm,Sartorius ACN)抽滤,并在荧光体式显微镜下对PS微粒进行观察和计数,从而计算日本虎斑猛水蚤对PS微粒的摄入量。
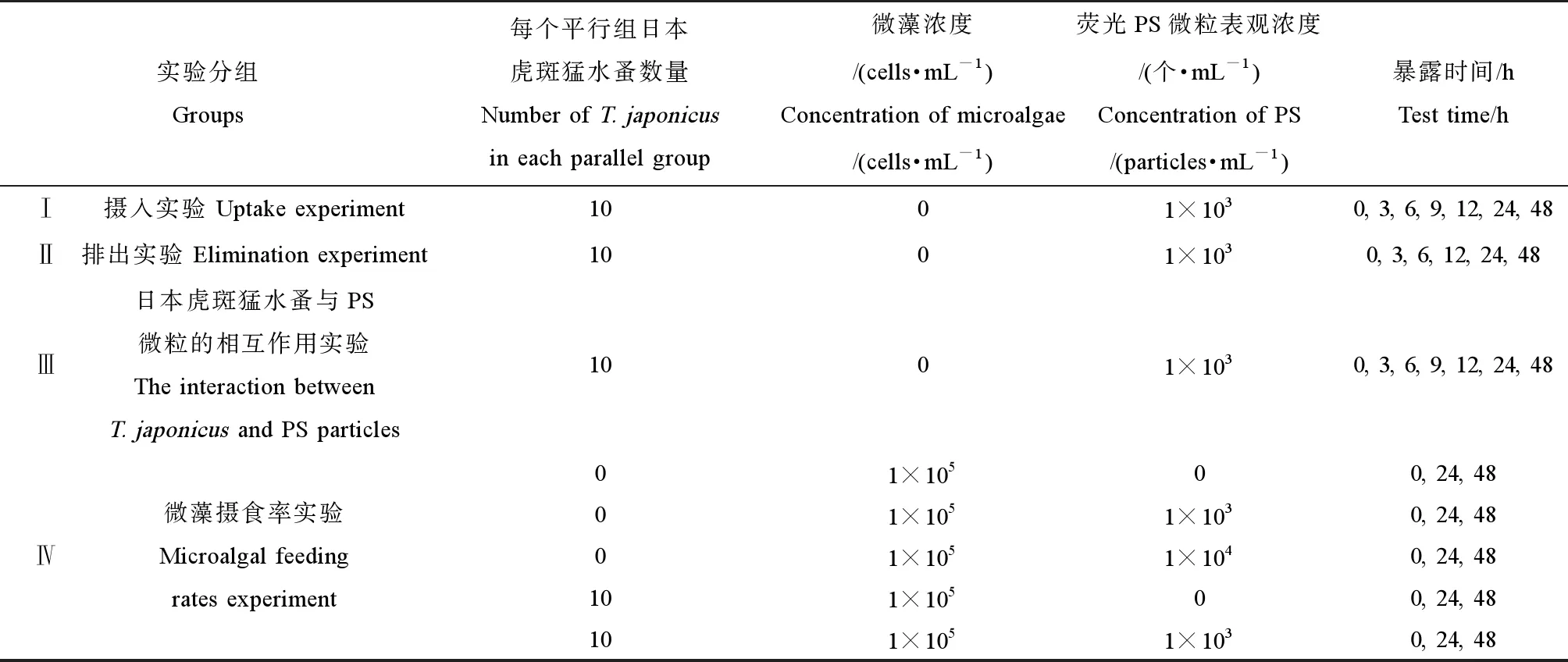
表1 实验分组及聚苯乙烯(PS)微粒暴露浓度Table 1 Groups and concentrations of polystyrene (PS)
实验Ⅱ中,设置6个实验组(0、3、6、12、24和48 h),每组3个平行,每个平行中10只日本虎斑猛水蚤,每个平行中加入清洁的人工海水20 mL。参照实验Ⅰ,预先将龄期一致(蚤龄为(18±1) d)的日本虎斑猛水蚤暴露于浓度为1×103个·mL-1的PS微粒溶液中培养48 h,将日本虎斑猛水蚤用人工海水清洗3遍并转移至实验Ⅱ对应的实验组中,继续培养48 h,期间不喂食。培养条件与实验Ⅰ一致,分别在转移后的0、3、6、12、24和48 h,计算并观察日本虎斑猛水蚤体内PS微粒的残留量,方法与实验Ⅰ一致。
1.6 日本虎斑猛水蚤与PS微粒的相互作用
实验Ⅲ中,将饥饿处理24 h后的日本虎斑猛水蚤暴露于浓度为1×103个·mL-1的PS微粒溶液中,暴露期间不喂食。根据暴露时长(0、3、6、9、12、24和48 h)设置7个实验组,每组3个平行,每个平行10只龄期一致(蚤龄为(18±1) d)的日本虎斑猛水蚤,培养条件与实验Ⅰ一致。分别于暴露0、3、6、9、12、24和48 h后,将日本虎斑猛水蚤取出,使用人工海水冲洗3遍,用质量分数为4%的甲醛溶液固定,荧光倒置显微镜观察PS微粒在日本虎斑猛水蚤体内分布情况和体表粘附情况。
1.7 微塑料对日本虎斑猛水蚤对微藻摄食率的影响(实验Ⅳ)
实验Ⅳ中,为了考察微塑料对微藻生长的影响,将牟氏角毛藻暴露在浓度分别为1×103个·mL-1和1×104个·mL-1的PS微粒溶液中。暴露0、24和48 h后,将暴露溶液转移至闪烁瓶中颠倒摇匀,用移液枪吸取1 mL溶液置于离心管中,立即使用倒置显微镜和血球计数板对溶液中的微藻进行计数,计算溶液中微藻的密度。为了考察PS微粒对日本虎斑猛水蚤对微藻摄食率的影响,将日本虎斑猛水蚤暴露在浓度为1×103个·mL-1的PS微粒溶液中。暴露0、24和48 h后,将日本虎斑猛水蚤挑出,对暴露溶液中的微藻进行计数,并计算日本虎斑猛水蚤对微藻的摄食率,参考Frost[28]计算哲水蚤(Calanuspacificus)对微藻摄食率的方法。
1.8 统计分析
采用SPSS 16.0软件对数据进行处理,实验结果以平均值±标准差(mean±S.D.)表示,采用One-Way ANOVA(单因素方差分析)对实验Ⅰ~Ⅱ中PS微粒的摄入量和残留量间的差异进行显著性检验,采用LSD法进行多重比较,对实验Ⅳ中微藻密度间的差异和日本虎斑猛水蚤对微藻摄食率间的差异进行显著性检验,P<0.05时认为具有显著性差异。
2 结果(Results)
2.1 日本虎斑猛水蚤对PS的摄入及排出
采用荧光体式显微镜对荧光PS微粒的浓度进行定量分析,暴露溶液中荧光PS微粒实测浓度如表2所示。

表2 荧光PS微粒实测浓度(n=4)Table 2 Measured concentrations of fluorescently labelled PS (n=4)
实验(Ⅰ~Ⅳ)中均未出现生物体死亡。摄入实验(实验Ⅰ)研究结果表明,日本虎斑猛水蚤暴露在浓度为1×103个·mL-1的PS微粒溶液中3 h后,可在日本虎斑猛水蚤体内检出PS微粒,浓度为(0.67±0.21) 个·只-1,且PS微粒的摄入量随着暴露时间增加呈现出逐渐增加的趋势,24 h后达到最大值,为(7.00±2.44) 个·只-1,之后日本虎斑猛水蚤体内PS微粒的含量降低,在48 h后降至(3.20±1.93) 个·只-1(图1(a))。
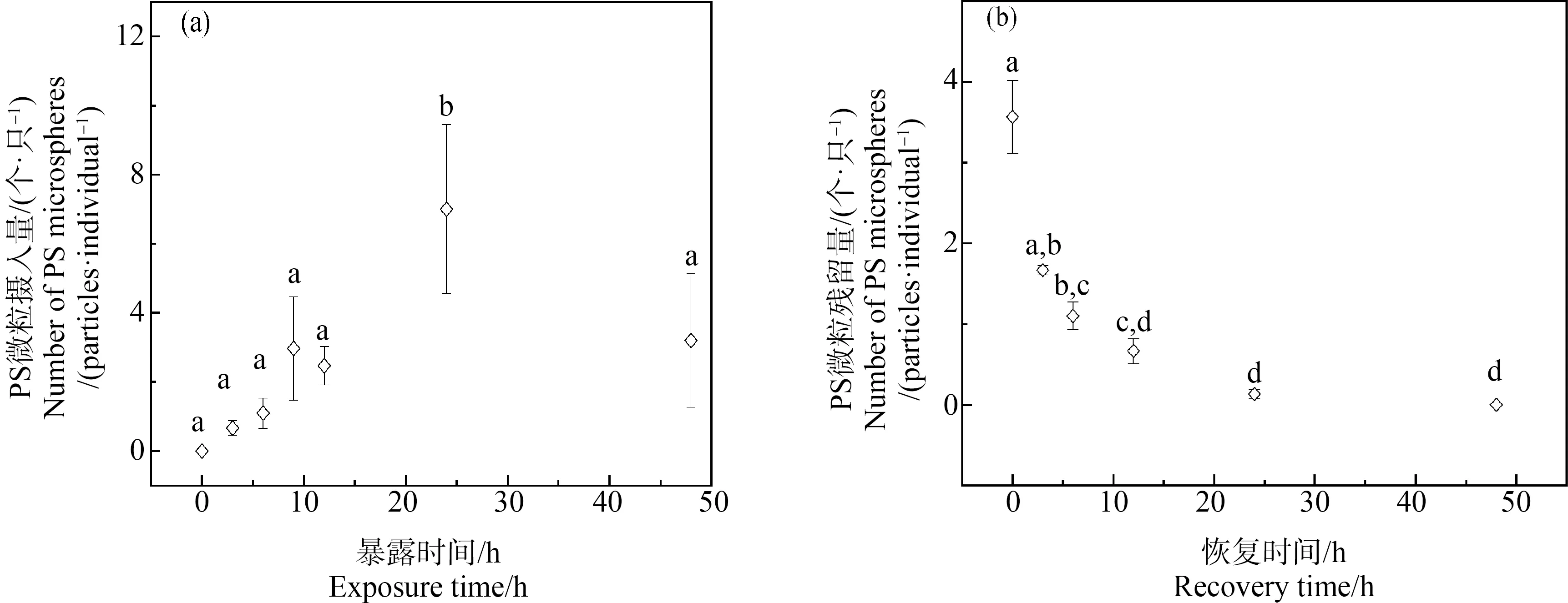
图1 日本虎斑猛水蚤对荧光PS微粒的摄入情况(a)和暴露48 h后转移至清洁海水中PS微粒的排出情况(b) (PS暴露初始浓度为1×103 个·mL-1)注:不同字母表明实验组间存在显著差异(P<0.05)。Fig. 1 The ingestion of fluorescent PS microspheres in T. japonicus (a) and the elimination of fluorescent PS microspheres by T. japonicus in clean seawater after pre-exposure to PS (concentrations 1×103 particles·mL-1) for 48 h (b)Note: Different letters indicate statistically significant differences (P<0.05).
排出实验(实验Ⅱ)研究结果表明,日本虎斑猛水蚤体内PS微粒的残留量随着时间增加呈现出逐渐降低的趋势(图1(b)),培养24 h后,即可排出体内96.33%±1.18%的PS微粒,48 h后,日本虎斑猛水蚤体内无PS微粒检出。ANOVA统计分析结果表明,12、24和48 h的实验组之间无显著性差异(P>0.05)。
实验Ⅲ通过荧光倒置显微镜对用质量分数为4%的甲醛固定的日本虎斑猛水蚤进行观察,发现日本虎斑猛水蚤摄入的PS微粒主要分布在消化道中(图2(a)),在其排泄物中也可观察到PS微粒(图2(c)),此外,PS微粒也会粘附在日本虎斑猛水蚤的外壳和附肢(游泳肢)上(图2(b))。

图2 荧光PS微粒在日本虎斑猛水蚤体内分布、体表粘附及排泄物中分布情况注:PS暴露初始浓度为1×103 个·mL-1,暴露时间为24 h。Fig. 2 Ingestion and conglutination of fluorescent PS microspheres in the gut, surface and feces of T. japonicusNote: The exposure concentration is 1×103 particles·mL-1; the exposure time is 24 h.
2.2 日本虎斑猛水蚤对微藻的摄食率
PS微粒的添加在一定程度上会对牟氏角毛藻的生长产生抑制作用。在PS微粒浓度为1×103个·mL-1的实验组中,暴露24 h和48 h后,牟氏角毛藻的密度与对照组相比无显著性差异(P>0.05);在PS微粒浓度为1×104个·mL-1的实验组中,暴露24 h和48 h后,牟氏角毛藻的密度与对照组相比分别降低了13.63%±8.72%和19.24%±1.26% (P<0.05)(图3)。日本虎斑猛水蚤对微藻的摄食率实验结果表明,在PS微粒浓度为1×103个·mL-1的实验组中,暴露24 h和48 h后,日本虎斑猛水蚤对微藻的摄食率与对照组相比无显著性差异(P>0.05)(图4)。
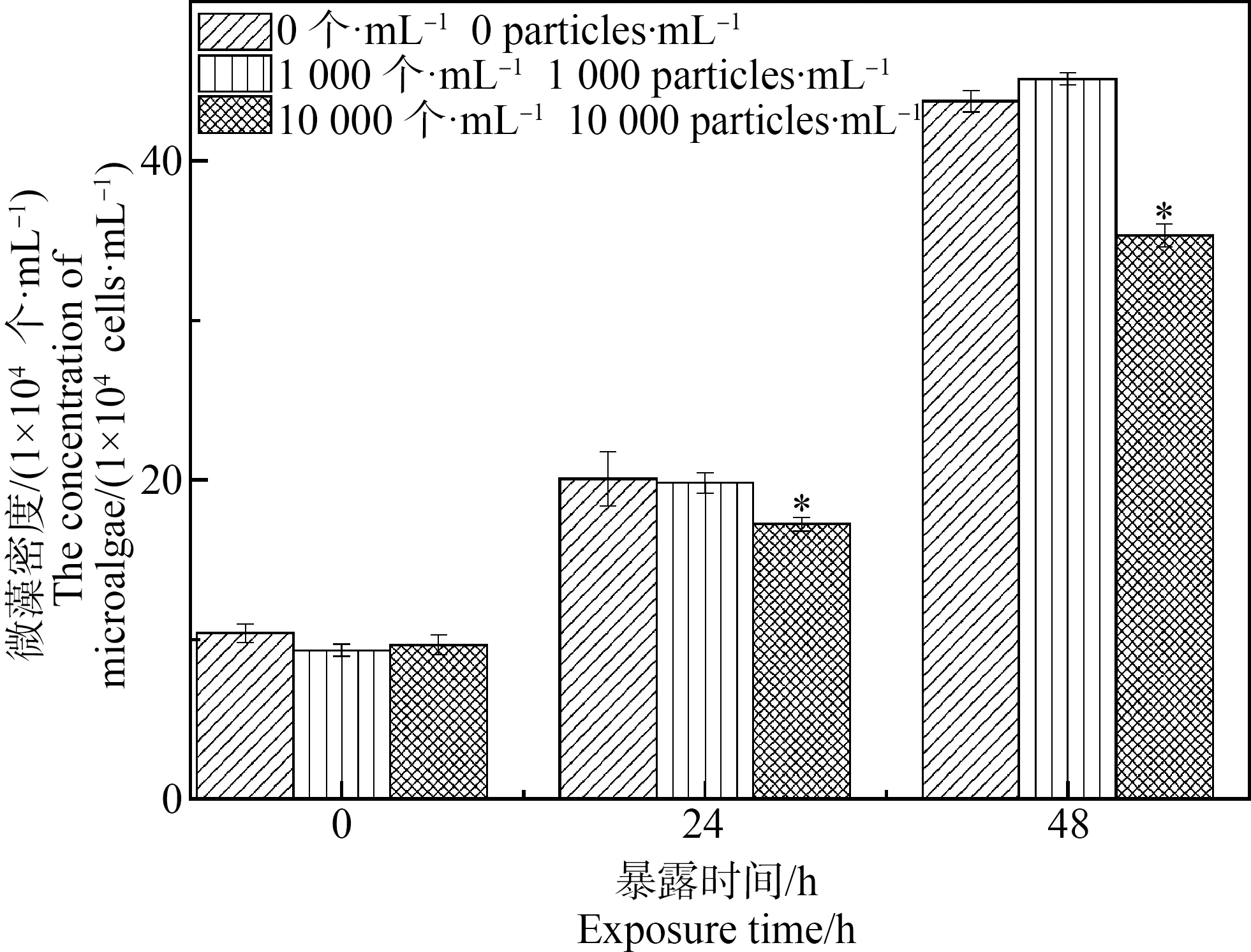
图3 不同浓度PS暴露组中微藻的密度注:*表明实验组间存在显著差异(P<0.05)。Fig. 3 The concentration of microalgae when exposed to PS microspheres at different concentrationsNote: *indicate statistically significant differences (P<0.05).
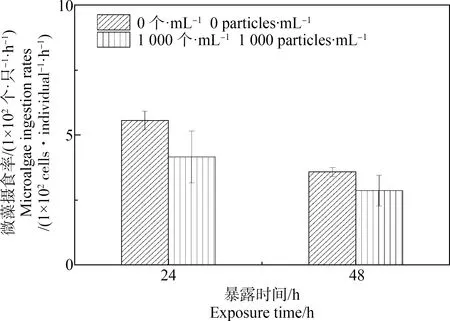
图4 不同浓度PS暴露组中日本虎斑猛水蚤对微藻摄食率Fig. 4 The microalgae ingestion rates by T. japonicus when exposed to PS microspheres at different concentrations
3 讨论(Discussion)
众多研究表明,不同类别的浮游动物能够摄入不同粒径范围的PS微粒。研究发现,卤虫(A.parthenogenetica)能够摄入粒径为1~20 μm的PS微粒[14],海岛哲水蚤(Calanushelgolandicus)能够摄入粒径为20 μm的PS微粒[20],模糊网纹蚤(Ceriodaphniadubia)能摄入粒径为1~5 μm的PS微粒[29]。本研究发现,日本虎斑猛水蚤能较快地摄入10 μm的PS微粒,暴露浓度为1×103个·mL-1时,暴露3 h后,即可在体内检出。浮游动物对微塑料的摄入能力与微塑料的粒径大小、暴露浓度及食物的供给有关。大型溞(D.magna)对PS微粒的摄入量随着PS粒径的增加而减小,摄入量与PS粒径呈指数相关[30];卤虫(A.parthenogenetica)对10 μm的PS微粒的摄入量随着PS浓度和暴露时长的增加而增加[24];提供藻类食物时,大型溞(D.magna)对2 μm的PS微粒的摄入量显著降低,且随着微藻密度增加,PS摄入量减少[31]。
生物体对微塑料的排出能力受物种种类、微塑料粒径和食物的供给等因素的影响。1 μm和10 μm的PS微粒可在热带爪蟾(Xenopustropicalis)幼体的鳃和消化道中残留6 d以上,且1 μm的PS微粒残留量远大于10 μm的PS微粒,食物的供给也会影响蝌蚪对微塑料的排出能力,缺乏食物的条件下,蝌蚪会摄入更多的PS微粒且很难将其排出[32]。本研究中的排出实验Ⅱ的结果表明,日本虎斑猛水蚤能够在3 h内开始排出体内的PS微粒,24 h后,可排出体内96.33%±1.18%的PS微粒,48 h后体内无荧光PS微粒检出。这说明,日本虎斑猛水蚤能够较快速地排出体内的PS微粒,但实验室前期研究发现,10 μm的PS微粒可在卤虫体内停留14 d以上[24],二者差异较大,因此,微塑料在不同生物体内的停留时间仍有待于进一步的研究。
微藻摄食率实验Ⅳ结果表明,PS微粒的添加在一定程度上会对微藻的生长产生抑制作用。研究发现,5 μm PS微粒对蛋白核小球藻(Chlorellapyrenoidosa)的生长产生抑制作用[33]。氨基修饰的2 μm PS微粒会显著降低硅藻(Chaetocerosneogracile)细胞内酶的活性,并对硅藻的生长产生不利影响[34]。PS微粒浓度为1×103个·mL-1时,PS微粒对日本虎斑猛水蚤对微藻的摄食率无显著影响(P>0.05),这表明,在环境浓度下,微塑料对日本虎斑猛水蚤对微藻摄食率无显著影响。当PS微粒浓度为1×104个·mL-1时,PS微粒抑制了微藻的生长,无法确定PS微粒是否对日本虎斑猛水蚤的摄食率产生影响。
微塑料被浮游动物摄入后,不仅会造成物理损伤,如机械损伤、消化道阻塞等,同时也会对浮游生物的生长发育繁殖造成不利的影响,造成生物体的生长发育迟缓,降低生物体的繁殖力,诱发炎症反应等[18,20]。微塑料的毒性效应也与其大小及化学成分有关。研究发现,日本虎斑猛水蚤暴露于粒径为0.05 μm的PS微粒溶液中,死亡率显著高于0.5 μm和6 μm的PS微粒实验组[25]。氨基修饰的PS微粒会改变卤虫体内基因的表达,抑制卤虫的生长发育,甚至导致个体死亡[35],相较于未修饰的PS微粒,基团修饰的PS微粒对生物体毒性更大。
综上所述,本文探究了日本虎斑猛水蚤成体对荧光PS微粒的摄入、排出动力学规律。结果表明,PS微粒能够较快地被日本虎斑猛水蚤摄入和排出,且PS微粒浓度>1×104个·mL-1时,对牟氏角毛藻的生长产生了抑制作用。目前有关于微塑料在生物体内的毒动力学过程及致毒机理仍有待于更加广泛和深入的研究。
◆
——以“不同咖啡因饮料对水蚤心率的影响”为例

