柱前衍生化反相高效液相色谱法测定盐酸二甲双胍缓释片中二甲胺含量
张一平,张 倩,王一然,宫晓菲,任雅丽,夏学军 ,刘玉玲
(1.中国医学科学院北京协和医学院药物研究所·药物传输技术及新型制剂重点实验室,北京100050;2.世贸天阶制药<江苏>有限责任公司,江苏 盐城224100)
盐酸二甲双胍因疗效可靠、安全性好,已成为治疗 2型糖尿病的首选药物。盐酸二甲双胍缓释片可使血药浓度更平稳,胃肠道不良反应降低,服药次数减少[1-2],具有更好的临床使用价值及市场开发前景。自2016年全面开展仿制药一致性评价以来,我国对于仿制药的研究内容更明确和严格。盐酸二甲双胍缓释片属批准较早的仿制药,严格把控其质量十分必要。二甲胺是盐酸二甲双胍合成反应过程中的起始原料[3],近距离接触对眼和呼吸道有强烈的刺激作用,危害人体健康,因此有必要对盐酸二甲双胍中的二甲胺进行质量控制。各国药典收录的盐酸二甲双胍及其制剂中,仅有《欧洲药典(9.0版)》[4]规定了盐酸二甲双胍中二甲胺(标记为杂质F)的检查方法及限度(供试品的0.05%);《美国药典》[5]收录有盐酸二甲双胍缓释片,未规定二甲胺的检查。李慧敏等[6]报道了测定盐酸二甲双胍中二甲胺残留的离子色谱-直接电导法,反应条件苛刻,试验对仪器要求较高。冯超等[7]使用氯甲酸-9-芴甲酯为衍生化试剂,建立了测定盐酸二甲双胍原料中二甲胺含量的柱前衍生化高效液相色谱(HPLC)法,衍生化过程烦琐复杂,操作不便。本研究中参考《欧洲药典(9.0版)》盐酸二甲双胍标准中杂质F检查法,通过优化色谱条件及供试品配制方法,建立了一种灵敏度高、易操作的测定盐酸二甲双胍缓释片中二甲胺含量的柱前衍生化HPLC法,并对原研和自制得到的2种盐酸二甲双胍缓释片稳定性试验样品中二甲胺的含量进行了考察。现报道如下。
1 仪器与试药
1.1 仪器
1200型高效液相色谱仪(美国Agilent公司);XS105DU型电子分析天平(梅特勒-托利多公司,精度为十万分之一);KQ-50B型超声波清洗机(昆明市超声仪器有限公司,功率为50 W,频率为40 kHz);JR-2型集热式磁力加热搅拌器(天津欧诺仪器有限公司)。
1.2 试药
二甲胺标准品(European Directorate for the Quality Medicines&Healthcare,批号为00YIB6);2,4-二硝基氟苯(东京化成工业株式会社,批号为YX25N-PJ);三乙胺(Aladdin Industrial Corporation,批号为H1718084);盐酸二甲双胍(山东科源制药股份有限公司,批号为P510-1809023);盐酸二甲双胍缓释片(商品名Glucophage XR,Bristol-Myers Squibb,编号分别为1,2);自制盐酸二甲双胍缓释片(中国医学科学院药物研究所,编号分别为1,2,3);甲醇、乙腈均为色谱纯,磷酸、氢氧化钠、盐酸、过氧化氢均为分析纯,水为娃哈哈纯净水。
2 方法
2.1 色谱条件
色谱柱:Agilient XDB C18柱(150 mm×4.6 mm,5μm);流动相:0.1%磷酸溶液(A)-乙腈(B),梯度洗脱,洗脱程序见表1;流速:1.2 mL/min;检测波长:380 nm;柱温:30℃;进样量:5μL。

表1 流动相洗脱程序
2.2 溶液制备
衍生试剂:精密量取1 mL2,4-二硝基氟苯,置100 mL容量瓶中,用甲醇稀释至刻度,摇匀,临用现配。
对照品溶液:精密量取二甲胺标准品1 mL,置100 mL容量瓶中,用甲醇稀释至刻度,摇匀,精密量取上述溶液2.5 mL,置100 mL容量瓶中,用甲醇稀释至刻度,摇匀,作为二甲胺对照品贮备溶液。精密量取二甲胺对照品贮备溶液1 mL,置10 mL容量瓶中,加甲醇7 mL,加入100μL三乙胺和1mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,即得。
供试品溶液:取盐酸二甲双胍缓释片粉末适量(约相当于盐酸二甲双胍10 mg),精密称定,置10 mL容量瓶中,加8 mL甲醇,超声20 min后,加入100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,过滤,取续滤液,即得。
原料药溶液:取盐酸二甲双胍原料药10 mg,精密称定,置10 mL容量瓶中,加甲醇8 mL,超声20 min后,加入100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,滤过,取续滤液,即得。
空白辅料溶液:取空白辅料10 mg,精密称定,置10 mL容量瓶中,加甲醇8 mL,超声20 min后,加入100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,滤过,取续滤液,即得。
2.3 测定方法及反应原理
测定方法:分别取5μL供试品溶液及对照品溶液注入高效液相色谱仪,按拟订色谱条件进样测定,记录峰面积,以对照品溶液质量浓度为限度(0.05%),采用外标法计算含量。
反应原理:2,4-二硝基氟苯是一种反应活性高、价廉的衍生剂,其与氨基反应迅速、结合牢固,衍生产物具有紫外吸收特性且相当稳定,是进行柱前衍生反应的理想试剂[8]。化学反应方程式见图1。
2.4 方法学考察
2.4.1 专属性试验
1)二甲胺定位及干扰试验
取空白溶剂、空白辅料溶液和对照品溶液,按拟订色谱条件进样分析,色谱图见图2。在此色谱条件下,二甲胺衍生物峰形良好,保留时间为5.6 min,空白溶剂及辅料对主峰的测定无干扰。
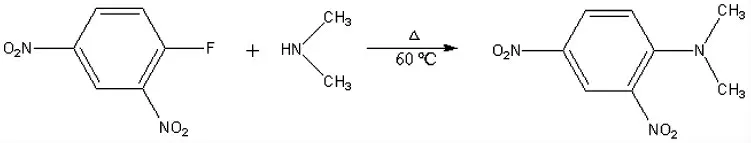
图1 衍生化反应方程式

图2 高效液相色谱图
2)破坏试验
光照破坏:分别取原研制剂和自制盐酸二甲双胍缓释片细粉适量,置适当容器中平铺,于4 500 lx照度下照射24 h,取出,分别取相当于原料药10 mg的缓释片细粉,精密称定,依法制备供试品溶液,按拟订色谱条件进样测定,色谱图见图4 A。结果表明,与初始条件(见图3)相比,光照条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均未明显增加。

图3 初始条件下的高效液相色谱图
中高温破坏:分别取原研制剂和自制盐酸二甲双胍缓释片细粉适量,置适当容器中平铺,于100℃烘箱中放置24 h,取出,分别取相当于原料药10 mg的缓释片细粉,精密称定,依法制备供试品溶液,按拟订色谱条件进样测定,色谱图见图4 B。结果表明,与初始条件(图3)相比,高温条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均明显增加。
高温破坏:分别取原研制剂和自制盐酸二甲双胍缓释片细粉适量,置适当容器中平铺,于220℃马弗炉中放置3 min,取出,分别取相当于原料药10 mg的缓释片细粉,精密称定,依法制备供试品溶液,按拟订色谱条件进样测定,色谱图见图4 C。结果表明,与初始条件(图3)相比,高温条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均明显增加。
氧化破坏试验:取原研制剂和自制盐酸二甲双胍缓释片粉末适量(约相当于盐酸二甲双胍10 mg),精密称定,置10 mL容量瓶中,加甲醇6 mL,超声20 min,再加30% H2O2溶液1 mL,摇匀,放置24 h,加100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,按拟订色谱条件进样测定,色谱图见图4 D。结果表明,与初始条件(图3)相比,氧化条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均未明显增加。
强酸破坏试验:取原研制剂和自制盐酸二甲双胍缓释片粉末适量(相当于盐酸二甲双胍10 mg),精密称定,置10 mL容量瓶中,加甲醇5 mL,超声20 min,再加1 mol/L盐酸溶液1 mL,摇匀,放置24 h,加1 mol/L氢氧化钠溶液1 mL中和盐酸,摇匀,加100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,滤过,取续滤液,按拟订色谱条件进样测定,色谱图见图4 E。结果表明,与初始条件(图3)相比,强酸条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均明显增加。
强碱破坏试验:取原研制剂和自制盐酸二甲双胍缓释片粉末适量(约相当于盐酸二甲双胍10 mg),精密称定,置10 mL容量瓶中,加甲醇5 mL,超声20 min,再加1 mol/L氢氧化钠溶液1 mL,摇匀,放置24 h,加1 mol/L盐酸溶液1 mL中和氢氧化钠,摇匀,加100μL三乙胺和1 mL衍生试剂,用甲醇稀释至刻度,摇匀,于60℃水浴加热30 min,取出,冷却至室温,摇匀,滤过,取续滤液,按拟订色谱条件进样测定,色谱图见图4 F。结果表明,与初始条件(图3)相比,强碱条件下原研制剂与自制盐酸二甲双胍缓释片的二甲胺含量均明显增加。
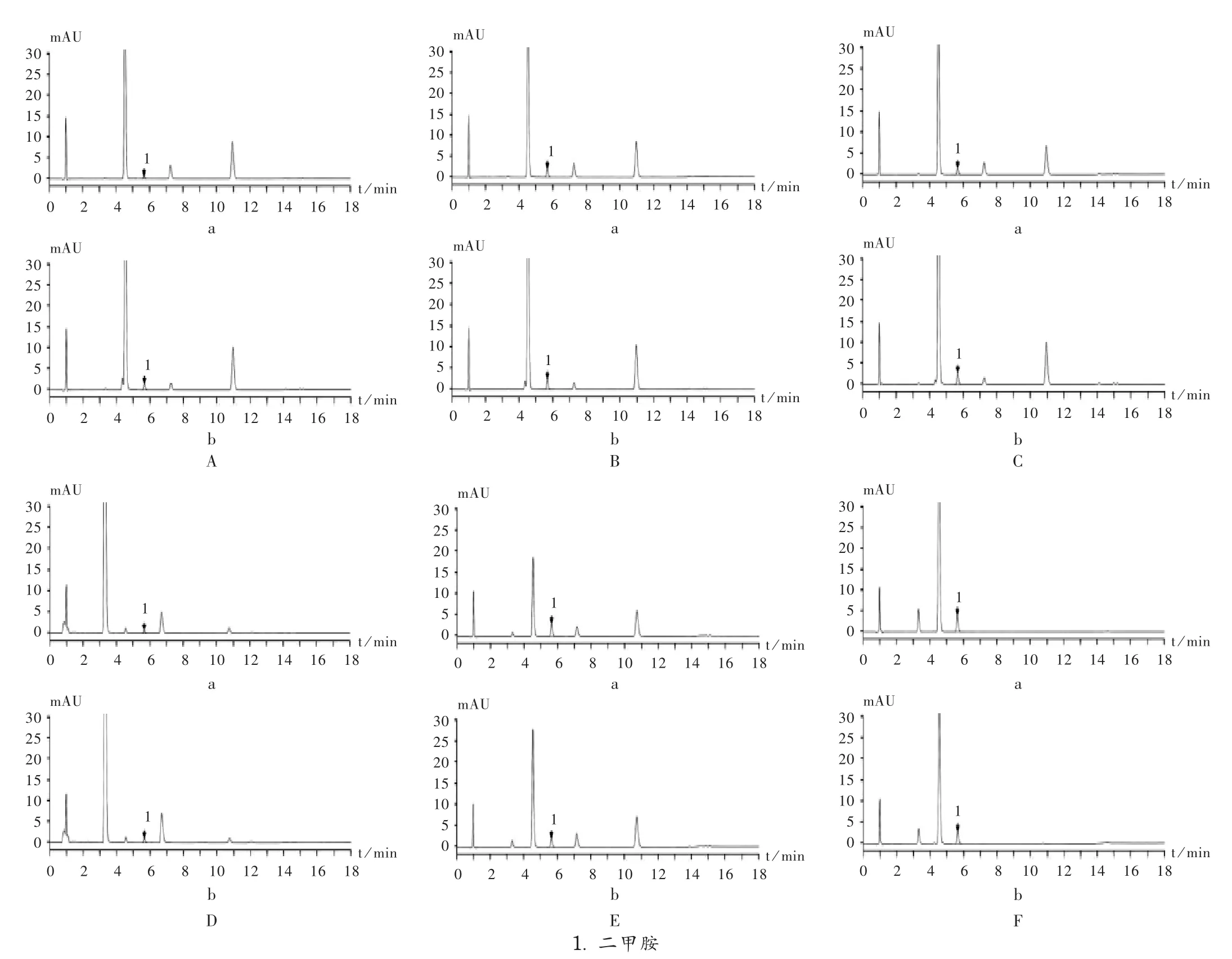
图4 破坏试验下的高效液相色谱图
2.4.2 检测限与定量限确定
精密量取二甲胺对照溶液适量,用甲醇定量稀释制成系列不同质量浓度的溶液,衍生化反应后,按拟订色谱条件进样测定,信噪比(S/N)=3计为检测限,S/N=10计为定量限。结果该法检测限以二甲胺计为4.59 ng/mL,定量限为17.80 ng/mL。
2.4.3 线性关系考察及精密度试验
取二甲胺对照品贮备溶液依次稀释,获得二甲胺质量浓度分别为0.2,0.3,0.4,0.5,0.6μg/mL的系列对照品溶液,依法制备对照品溶液,按拟订色谱条件分别进样测定,记录峰面积。以峰面积(A)为纵坐标、质量浓度(C,μg/mL)为横坐标进行线性回归,得回归方程A=70.29 C-0.93,r=0.999 1(n=5)。结果表明,二甲胺质量浓度在0.2~0.6μg/mL范围内与峰面积线性关系良好。取经衍生化后的对照品溶液(质量浓度为0.5μg/mL),按拟订色谱条件连续进样5次,记录峰面积。结果的RSD为0.22%(n=5),表明仪器精密度良好。
2.4.4 重复性试验
依法平行制备供试品溶液6份,按拟订色谱条件进样测定,记录峰面积。结果,6份供试品溶液中二甲胺的含量均基本一致,表明方法重复性良好。
2.4.5 加样回收试验
取盐酸二甲双胍缓释片粉末适量(约相当于盐酸二甲双胍10 mg),精密称定,共9份,置10 mL容量瓶中,分别加入甲醇8 mL,超声20 min,每个容量瓶中依次加入相当于对照品溶液质量浓度80%,100%,120%的对照品溶液各1 mL,每个质量浓度各3份,分别加100μL三乙胺和1 mL衍生试剂,加甲醇稀释至刻度,摇匀,60℃水浴加热30 min,取出,冷却至室温,摇匀,滤过,取续滤液,按拟订色谱条件进样,计算加样回收率。结果平均回收率为98.00%,RSD为1.37%(n=9),表明方法准确度良好。
2.4.6 稳定性试验
分别取供试品溶液及对照品溶液各5μL,按拟订色谱条件进样测定,分别于0,2,4,6,8,10 h时进样分析。结果在室温放置10 h内,供试品溶液和对照品溶液中二甲胺的峰面积均无明显变化,表明溶液稳定性良好。
2.5 样品含量测定
取2批原研缓释片和3批自制缓释片初始、加速试验6个月[温度(40±2)℃,相对湿度(75±5)%]及长期试验24个月[温度(25±2)℃,相对湿度(60±10)%]条件样品,依法制备供试品溶液,按拟订色谱条件进样测定,记录峰面积,按外标法以标示量计算样品中二甲胺含量。详见表2。结果表明,加速试验6个月和长期试验24个月放置条件下盐酸二甲双胍缓释片的二甲胺含量与初始均无明显变化。
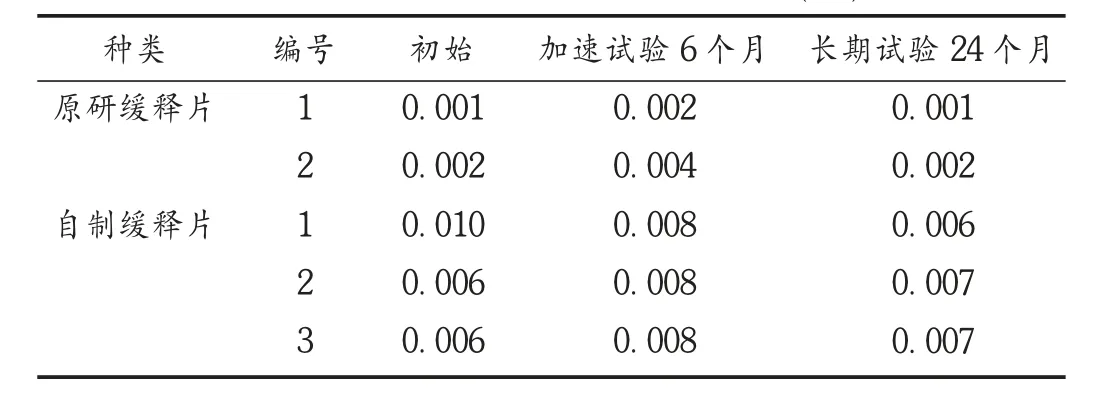
表2 样品中二甲胺含量测定结果(%)
3 讨论
本研究中参考《欧洲药典》(EP9.0)盐酸二甲双胍原料药中杂质F(二甲胺)的柱前衍生化测定法,并采用与以上标准一致的色谱条件,包括检测器、检测波长、柱温、进样量及色谱柱填料等,仅色谱柱规格与《欧洲药典》中有所不同。《欧洲药典》采用的色谱柱规格为(125 mm×3 mm,5μm),本研究中所用色谱柱规格为(150 mm×4.6 mm,5μm),故根据公式(流速=内径之比2×原流速,时间=柱长之比×原时间)进行计算,对色谱条件中流速和梯度洗脱时间进行了调整。供试品溶液配制过程中,取盐酸二甲双胍原料药,按2.2项下原料药溶液制备方法分别采用甲醇和乙腈进行配制,对提取溶剂进行了筛选。结果表明,盐酸二甲双胍在甲醇中能完全溶解,而在乙腈中溶解度不足80%,故选择对盐酸二甲双胍有更好溶解效果的甲醇作为溶剂,以保证盐酸二甲双胍中的二甲胺提取完全。
本研究结果显示,原研和自制盐酸二甲双胍缓释片的二甲胺含量均小于0.05%,在《欧洲药典》规定限度之内,认为全部符合要求。同时,通过对二者的专属性和稳定性进行考察,结果表明,二者专属性规律一致,且在加速试验6个月和长期试验24个月条件下均稳定,故认为自制制剂与参比制剂有较好的一致性;盐酸二甲双胍缓释片在高温、强酸和强碱破坏条件下均降解产生二甲胺,故判定二甲胺为盐酸二甲双胍降解产物之一。因此,在制备及贮存盐酸二甲双胍缓释片时需注意避免高温条件、强酸性及强碱性环境;二甲胺既是盐酸二甲双胍的合成中间体,也是其降解产物,故有必要对盐酸二甲双胍原料中二甲胺含量进行严格控制。稳定性试验结果表明,二甲胺含量与初始试验相等,盐酸二甲双胍缓释片加速试验6个月和长期试验24个月的样品无明显变化,质量稳定。因此,在制剂质量标准中只要保证盐酸二甲双胍原料中二甲胺的含量控制即可,不需将二甲胺限度制订入缓释片的质量标准。
综上所述,该方法能准确地测定盐酸二甲双胍缓释片的二甲胺含量,方法简便,灵敏度高,重复性好,可用于盐酸二甲双胍缓释片的质量控制。

