UBQLN-1在直肠癌组织中的表达、临床意义及与预后的相关性分析
孙光源 武雪亮 薛军 张海燕 马海燕 刘晓宁 韩磊 屈明


[摘要] 目的 探討泛素-1(UBQLN-1)在直肠癌组织中的表达情况、临床意义及与预后的相关性。 方法 选取2015年12月—2016年1月于河北北方学院附属第一医院普通外科住院行直肠癌手术患者90例,留取直肠癌灶组织及癌旁正常组织,应用逆转录聚合酶链反应法(Rt-PCR)检测UBQLN-1 mRNA在两组标本中的表达情况,应用免疫组化检测UBQLN-1蛋白在两组标本中的表达情况,分析其与肿瘤临床病理特征的关系。并对所纳入的患者进行生存期随访,应用Kaplan-Meier绘制生存曲线,应用多因素预后分析UBQLN-1蛋白的表达与直肠癌患者预后的关系。 结果 直肠癌组织中UBQLN-1 mRNA的相对表达量明显高于癌旁正常组织,差异有高度统计学意义(P < 0.01)。直肠癌组织中UBQLN-1的阳性表达明显高于癌旁正常组织,差异有高度统计学意义(P < 0.01)。不同分化程度、T分期、淋巴结转移及肝转移状态患者直肠癌组织UBQLN-1阳性表达情况比较,差异有统计学意义(P < 0.05)。UBQLN-1阳性表达的直肠癌患者5年无病生存率明显低于阴性表达者,差异有统计学意义(P < 0.05)。T分期(HR = 1.246)、淋巴结转移(HR = 2.538)、肝转移(HR = 2.256)及UBQLN-1表达(HR = 5.820)是影响患者预后的独立危险因素(P < 0.05)。 结论 直肠癌组织中UBQLN-1高表达与直肠癌的发生、发展、浸润和转移关系密切,同时是直肠癌患者预后的独立危险因素,因而可作为直肠癌早期诊断、预后评估的潜在分子生物学指标。
[关键词] 泛素-1;直肠癌;表达;临床意义;预后
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-7210(2020)09(a)-0033-05
Analysis of UBQLN-1 expression and clinical significance in rectal cancer tissues and correlation with prognosis
[Abstract] Objective To explore the expression and clinical significance of ubiquitin-1 (UBQLN-1) in rectal cancer, and correlation analysis with prognosis . Methods From December 2015 to January 2016, a total of 90 patients who underwent rectal cancer surgery in the Department of General Surgery of the First Affiliated Hospital Hebei North University were selected. The rectal cancer foci and normal tissues adjacent to the cancer were collected. Reverse transcription polymerase chain reaction (Rt-PCR) was used. The expression of UBQLN-1 mRNA of specimens in the two groups were detected, while immunohistochemistry was used to detect the expression of UBQLN-1 protein of specimens in the two groups, and the relationship with the clinicopathological characteristics of the tumor was analyzed. The survival period of the included patients was followed up, Kaplan-Meier was used to draw survival curves, and the relationship between the expression of UBQLN-1 protein and the prognosis of rectal cancer patients were analyzed by multi-factor prognosis. Results The relative expression of UBQLN-1 mRNA in rectal cancer tissues was significantly higher than that in normal tissues adjacent to cancer, and the difference was highly statistically significant (P < 0.01). The positive expression of UBQLN-1 in rectal cancer tissues was significantly higher than that in normal tissues adjacent to cancer, and the difference was highly statistically significant (P < 0.01). The positive expression of UBQLN-1 in rectal cancer tissues of patients with different levels of differentiation, T stage, lymph node metastasis and liver metastasis were compared, and the differences were statistically significant (P < 0.05). The 5-year disease-free survival rate of rectal cancer patients with positive expression of UBQLN-1 was significantly lower than that of patients with negative expression, and the difference was statistically significant (P < 0.05). T staging (HR = 1.246), lymph node metastasis (HR = 2.538), liver metastasis (HR = 2.256) and UBQLN-1 expression (HR = 5.820) were independent risk factors that affected the prognosis of patients (P < 0.05). Conclusion The high expression of UBQLN-1 in rectal cancer tissue is closely related to the occurrence, development, invasion and metastasis of rectal cancer. It is also an independent risk factor for the prognosis of rectal cancer patients. Therefore, it can be used as a potential molecular biological indicator for early diagnosis and prognosis evaluation of rectal cancer.
[Key words] Ubiquitin-1; Rectal cancer; Expression; Clinical significance; Prognosis
近年来,尽管在直肠癌的诊断和治疗方法上取得了一定的进展,但是因为在早期筛查、早期诊断及规范性治疗方面缺乏特异性强、准确度高的标志物作为科学参考,多数患者失去了最佳治疗的时机。因而,筛选快速、准确、有效的肿瘤因子为结直肠癌的早期诊断,以及规范治疗、预后监测已成为临床工作的重点[1-2]。另一方面,靶向治疗已成为结直肠癌治疗的重要手段,深入探讨直肠癌发生、发展的分子机制能为结直肠癌的靶向治疗提供科学、准确的靶点,即精准医疗[3-5]。泛素-1(UBQLN-1)属于泛素样蛋白一族,在调节蛋白质降解中起着重要作用。在真核生物中,UBQLN-1连接蛋白酶体和泛素化蛋白质,以刺激泛素化蛋白质降解,促进错误折叠的自噬调节[6]。UBQLN-1功能的失活可诱导人类多种神经退行性疾病的病理过程,如阿尔茨海默病和亨廷顿病等[7-9]。此外,UBQLN-1与人类多种肿瘤的发生和进展有关,目前已得到证实的恶性肿瘤有乳腺癌、胃癌、非小细胞癌和卵巢癌等[10],但UBQLN-1在結直肠癌中的表达及相应的作用机制尚未见报道。本研究通过对直肠癌组织行逆转录聚合酶链反应法(Rt-PCR)和免疫组织化学(SP)法分析检测,旨在探讨UBQLN-1在直肠癌中的表达情况及与相关临床病理特征的关系,并通过积极的生存期随访,分析UBQLN-1与预后的相关性,为直肠癌的早期筛查诊断和预后监测提供潜在可靠的分子生物学标志物。
1 资料与方法
1.1 一般资料
于2015年12月—2016年1月,收集河北北方学院附属第一医院(以下简称“我院”)普通外科手术切除的直肠癌组织90例和癌旁正常组织90例。癌组织取自癌灶中心处,另取标本残端切缘(距离癌灶>10 cm)经病理证实为正常肠组织,术后标本均在离体1 h内获得,并存于液氮中。纳入患者均有完整临床资料和随访记录,其中男52例,女38例;年龄36~72岁,中位年龄55岁;T1期6例,T2期18例,T3期50例,T4期6例。本研究经我院医学伦理委员会批准。纳入标准:经病理检查确诊均为原发肿瘤,病例和随访资料完整;排除标准:行术前新辅助放化疗,伴转移瘤、复发肿瘤,伴有心脑血管疾病及其他手术禁忌证。
1.2 方法
1.2.1 主要试剂 反转录试剂盒(货号:K1622)购于美国Fermentas公司,引物购于中国广州鼎国生物科技有限公司,RIPA试剂(货号:PP1901)购于上海基星生物科技有限公司,鼠抗UBQLN-1单克隆抗体(编号:128011)购于美国Abcam公司,免疫组化试剂盒、DAB显色试剂盒(货号:PV9000)购自北京中杉金桥生物技术有限公司。
1.2.2 Rt-PCR法检测两组细胞中UBQLN-1 mRNA的表达 提取测定总RNA,设计UBQLN-1上游引物:5′-AGAGGCCAGGTTACCCACCA-3′,下游引物:5′-TTA-TGCCTCCACCGTAACCTTTG-3′;β-actin上游引物:5′-TCGACAACGGCTCCGGCAT-3′,下游引物:5′-AA-GGTGTGGTGCCAGATTTTC-3′;反应体系:1×PCR Buffer 2.5 μL,cDNA模板2 μL,dNTP 0.5 μL,Taq酶1.25 U,引物各1 μL,RNA酶抑制剂1 μL,加焦碳酸二乙酯(DEPC)处理的水至总体积25 μL。扩增条件:95℃预变性5 min后,94℃ 30 s、64℃ 30 s、72℃ 30 s,进行35个循环,最后于72℃延伸7 min,产物经琼脂电泳后以Labworks 4.5图像系统分析。
1.2.3 免疫组化检测两组中UBQLN-1蛋白中的表达 分别取入组患者的直肠组织标本,用4%甲醛溶液固定(固定液量为组织的10倍),然后石蜡包埋、连续切片(厚度3 μm/张)。采用免疫组织化学染色SP法对直肠癌组织中的UBQLN-1的表达情况进行检测。将包埋好的石蜡依次进行切片、脱蜡和水化,磷酸盐缓冲液(PBS)冲洗3次,3 min/次,抗原修复自然冷却至室温,阻断内源性过氧化物酶,滴加一抗,37℃孵育60 min,PBS液冲洗3次,3 min/次,滴加二抗,室温孵育10 min,PBS液冲洗3次,3 min/次,滴加辣根酶标记链霉卵白素工作液,室温孵育10 min,PBS液冲洗3次,3 min/次,DAB显色,室温孵育10 min,复染,分化、返蓝,脱水、封片,显微镜40×镜检并采图。
1.3 判定标准
UBQLN-1蛋白阳性表达为棕黄色或棕褐色,主要位于细胞质中,少量表达于细胞核,染色评分标准:阳性细胞0%~<10%为0分,10%~<25%为1分,25%~ <50%为2分,50%~<75%为3分,≥75%为4分;根据染色强度评分:无染色0分,弱染色1分,中等染色2分,强染色3分;两项评分的乘积为最终评分,总积分≤3分为阴性,>3分为阳性[11-12]。
1.4 随访
通过电话/门诊复查等形式积极随访,末次随访时间为2020年5月,随访终点为肿瘤相关性死亡。
1.5 统计学方法
采用SPSS 22.0软件对所得数据进行统计分析。计量资料以均数±标准差(x±s)表示,组间比较采用t检验。计数资料以例数或百分比表示,组间比较采用χ2检验。UBQLN-1蛋白表达与临床病理特征的相关性采用χ2检验分析,应用Kaplan-Meier法绘制生存曲线,采用Log-Rank检验分析不同表达患者生存期的差异。以P < 0.05为差异有统计学意义。
2 结果
2.1 RT-PCR法检测UBQLN-1mRNA在不同直肠组织中的表达
UBQLN-1/βaction比值作为RT-PCR定量分析,直肠癌组织中UBQLN-1 mRNA的表达水平明显高于癌旁正常组织,差异有高度统计学意义(t = 6.411,P = 0.000)。见图1。
2.2 免疫组化法检测UBQLN-1蛋白在不同直肠组织中的表达
直肠癌组织中UBQLN-1的阳性表达明显高于癌旁正常组织,差异有高度统计学意义(χ2 = 24.155, P = 0.000)。见图2(封三)。
2.3 UBQLN-1在直肠癌组织中的表达及与病理特征的关系
不同年龄、肿瘤大小患者直肠癌组织中UBQLN-1阳性表达情况比较,差异无统计学意义(P > 0.05)。不同分化程度、T分期、淋巴结转移及肝转移状态患者直肠癌组织UBQLN-1阳性表达情况比较,差异有统计学意义(P < 0.05)。见表1。
2.4 UBQLN-1表达与直肠癌患者预后的相关性
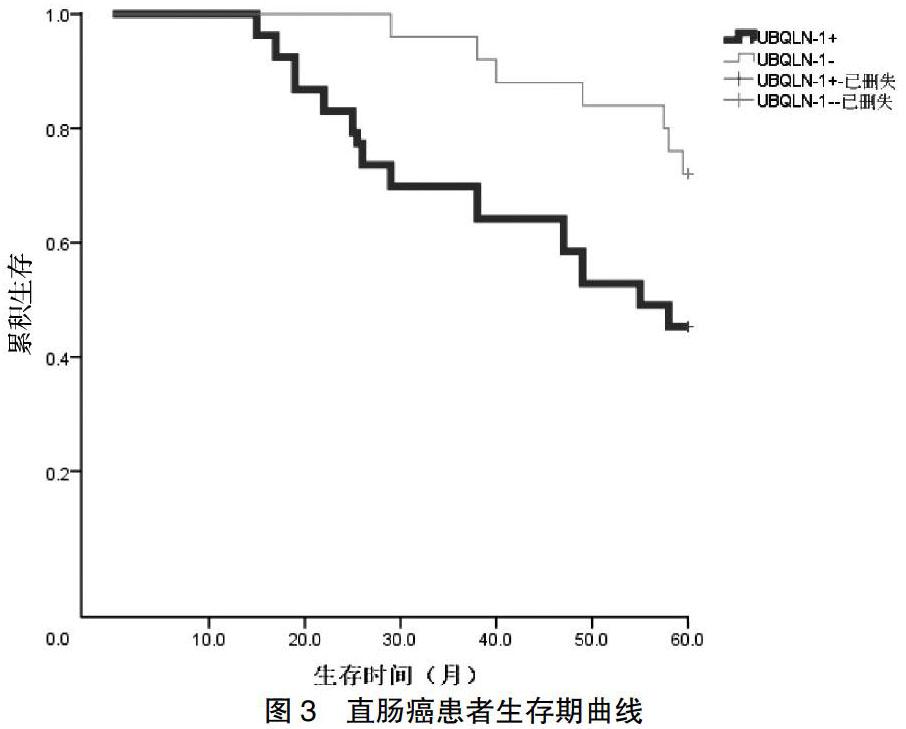
本研究共纳入90例患者,成功随访患者78例,总随访率为86.67%,中位随訪时间为47个月。其中UBQLN-1表达阳性患者53例,表达阴性患者25例;自患者接受治疗开始至随访结束,死亡26例,其中与肿瘤相关性死亡21例,与肿瘤无关性死亡5例。应用Kaplan-Meier方法绘制生存曲线显示,UBQLN-1阳性表达的直肠癌患者5年无病生存率明显低于阴性表达者,差异有统计学意义(χ2 = 4.879,P = 0.027)。见图3。
2.5 直肠癌患者预后危险因素分析
T分期(HR = 1.246)、淋巴结转移(HR = 2.538)、肝转移(HR = 2.256)及UBQLN-1表达(HR = 5.820)是影响患者预后的独立危险因素(P < 0.05)。见表2。
3 讨论
UBQLN-1属于泛素蛋白家族中的核小体表面蛋白,由11个外显子组成,位于人类染色体9q22,具有高度保守性,包含N端的UBL结构域,介导泛素与蛋白酶体19S亚基的S5a组分的泛素相互作用基序的相互作用。这些特征显示,UBQLN-1通过连接泛素化机制和蛋白酶体来调节蛋白酶体的降解。UBQLN-1还含有独特的保守的天冬酰胺和脯氨酸重复序列,可能介导泛素与特定蛋白结构域的相互作用,这些结构域存在于许多参与内吞和囊泡分选的蛋白质中[13-15]。
UBQLN-1在不同的蛋白质降解机制和途径中发挥重要作用,包括泛素-蛋白酶体系统、自噬和内质网相关蛋白降解途径。通过与蛋白酶体的多泛素链结合及与蛋白酶体的亚单位相互作用,介导蛋白酶体靶向错误折叠或积累的蛋白质进行降解[16-17]。此外,与内质网定位蛋白的相互作用,在多泛素化的内质网相关的降解途径(ERAD)底物和蛋白酶体间形成联系。同时,自噬途径降低衔接分子1(TICAM1)的丰度,对TICAM1/TRIF依赖的Toll样受体信号通路进行负性调节,促进泛素化和蛋白酶体降解[18-19]。
随着研究的不断深入,发现UBQLN-1能通过促进错误折叠的自噬调节、诱导细胞凋亡和受体转运等多种调控机制影响肿瘤细胞的迁移和侵袭等生物学行为[20-21]。Bao等[22]应用IHC法检测UBQLN-1在179对胃癌及邻近正常组织中的表达水平,UBQLN-1在胃癌组织中显著上调,其高表达与组织学分级、浸润、淋巴结转移和肿瘤TNM分期均有关。此外,多因素预后分析显示,UBQLN-1高表达是胃癌患者预后的独立不良预后因素。付慧等[23]研究证实UBQLN-1在浸润性乳腺癌组织中呈相对高表达状态,并与肿瘤大小、TNM分期、脉管浸润、淋巴结转移个数、神经侵犯、Ki-67、远处转移等多种临床病理学特征关系密切,且与患者不良预后密切相关,可作为乳腺癌患者的预后监测的生物学指标。王静等[24]亦证实UBQLN-1在卵巢癌组织中的表达水平相对较高,与卵巢癌的临床病理参数及生存预后关系密切,因而可作为卵巢癌筛查、诊断、治疗和预后评估的潜在生物学指标。
目前,暂未有UBQLN-1在直肠癌中表达和作用机制的相关报道。本研究应用RT-PCR和SP法检测UBQLN-1在直肠癌中的表达情况,分析与相关临床病理特征的关系。本研究结果显示,癌组织中UBQLN-1 mRNA和蛋白的表达水平明显高于癌旁正常组织,且与肿瘤T分期、淋巴结转移和肝转移等病理特征密切相关。通过生存期随访和多因素预后分析证实,UBQLN-1的表达与直肠癌患者预后存在明显的相关性,UBQLN-1是直肠癌患者预后的独立危险因素。然而,具体致癌机制暂不明确。胡潺潺等[25]研究证实,抑制乳腺癌细胞中UBQLN-1基因表达可降低乳腺癌细胞增殖活力和侵袭、转移能力,能诱导细胞凋亡,考虑与抑制STAT3信号通路,下调基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶-2(MMP-2)表达有关。
综上,关于UBQLN-1在肿瘤领域中的研究目前相对较少,本研究证实UBQLN-1可作为直肠癌早期诊断、预后评估的潜在分子生物学指标,具体作用机制尚需深入研究,这也是今后的研究方向。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2018,68(6):394-424.
[2] 袁平,马杏凡.中国结直肠癌筛查效果meta分析[J].中国医药导报,2020,17(8):106-111.
[3] 付极,林国乐.分子诊断技术在结直肠癌个体化精准治疗中的应用[J].中华胃肠外科杂志,2016,19(1):22-26.
[4] 段佳文,武雪亮,牛玉春,等.西妥昔單抗和贝伐单抗在晚期结直肠癌一二线治疗中的研究进展[J].中国医药导报,2017,14(24):50-53.
[5] Voegeli M,Wicki A. Neoadjuvant,adjuvant and palliative systemic therapy of colorectal cancer [J]. Ther Umsch,2018,75(10):622-626.
[6] Kurlawala Z,Shah PP,Shah C,et al. The STI and UBA Domains of UBQLN1 Are Critical Determinants of Substrate Interaction and Proteostasis [J]. J Cell Biochem,2017,118(8):2261-2270.
[7] Li X,Zhou J,Chen H,et al. The association between the UBQLN1 polymorphism and Alzheimer′s disease risk:A systematic review [J]. Cell Mol Biol(Noisy-le-grand),2017,63(5):94-96.
[8] Yue Z,Wang S,Yan W,et al. Association of UBQ-8i polymorphism with Alzheimer′s disease in Caucasians:a meta-analysis [J]. Int J Neurosci,2015,125(6):395-401.
[9] Luo L,Liu Y,Tu X,et al. Decreased expression of ubiquilin-1 following neonatal hypoxia-ischemic brain injury in mice [J]. Mol Med Rep,2019,19(6):4597-4602.
[10] Kurlawala Z,Dunaway R,Shah PP,et al. Regulation of insulin-like growth factor receptors by Ubiquilin1 [J]. Biochem J,2017,474(24):4105-4118.
[11] Brahim EB,Ayari I,Jouini R,et al. Expression of epidermal growth factor receptor (EGFR) in colorectal cancer:An immunohistochemical study [J]. Arab J Gastroenterol,2018,19(3):121-124.
[12] Ghaedamini S,Nikbakht M,Soleimani M. Assessment of Immuno-Histochemical Expression of MBD1 in Colorectal Adenocarcinoma and Its Correlations with Prognostic Factors [J]. Middle East J Dig Dis,2020,12(1):39-44.
[13] Adegoke OO,Qiao F,Liu Y,et al. Overexpression of Ubiquilin-1 Alleviates Alzheimer′s Disease-Caused Cognitive and Motor Deficits and Reduces Amyloid-β Accumulation in Mice [J]. J Alzheimers Dis,2017,59(2):575-590.
[14] Fang X,Trexler C,Chen J,et al. Ushering in the cardiac role of Ubiquilin1 [J]. J Clin Invest,2018,128(12):5195-5197.
[15] Chen X,Ebelle DL,Wright BJ,et al. Structure of hRpn10 Bound to UBQLN2 UBL Illustrates Basis for Complementarity between Shuttle Factors and Substrates at the Proteasome [J]. J Mol Biol,2019,431(5):939-955.
[16] Kim H,Goldberg A. UBL domain of Usp14 and other proteins stimulates proteasome activities and protein degradation in cells [J]. Proc Natl Acad Sci USA,2018,115(50):E11642-E11650.
[17] Liu Y,Qiao F,Wang H,et al. Enhanced Proteostasis in Post-ischemic Stroke Mouse Brains by Ubiquilin-1 Promotes Functional Recovery [J]. Cell Mol Neurobiol,2017, 37(7):1325-1329.
[18] Mizukami K,Abrahamson E,Mi Z,et al. Immunohistochemical analysis of ubiquilin-1 in the human hippocampus:association with neurofibrillary tangle pathology [J]. Neuropathology,2014,34(1):11-18.
[19] Natunen T,Takalo M,Kemppainen S,et al. Relationship between ubiquilin-1 and BACE1 in human Alzheimer′s disease and APdE9 transgenic mouse brain and cell-based models [J]. Neurobiol Dis,2015,85(11):187-205.
[20] Liu Y,Lü L,Hettinger CL,et al. Ubiquilin-1 protects cells from oxidative stress and ischemic stroke caused tissue injury in mice [J]. J Neurosci,2014,34(8):2813-2121.
[21] Yadav S,Singh N,Shah PP,et al. MIR155 Regulation of Ubiquilin1 and Ubiquilin2:Implications in Cellular Protection and Tumorigenesis [J]. Neoplasia,2017,19(4):321-332.
[22] Bao J,Jiang X,Zhu X,et al. Clinical significance of ubiquilin-1 in gastric cancer [J]. Medicine(Baltimore),2018, 97(3):e9701.
[23] 付慧,李艷萍,汪云超,等.Ubiquilin1蛋白在乳腺癌组织中的表达与预后意义[J].肿瘤防治研究,2017,44(8):535-539.
[24] 王静,贺英,王萍,等.卵巢癌组织中泛素1的表达变化及其临床意义[J].山东医药,2018,58(35):61-63.
[25] 胡潺潺,李青山,刘兰芳,等.RNA干扰UBQLN-1基因表达对乳腺癌细胞增殖、凋亡、侵袭的影响及机制研究[J].中国免疫学杂志,2019,34(9):1315-1320.
(收稿日期:2020-06-04)

