VA5免疫增强剂对鸡新支流三联疫苗免疫效力及肉鸡生产性能的影响
陆吉虎,唐应华,朱亚露,张雪花,毕志香,刘岳龙,胡祥克,董祥超,王振,李为坤,滕姣,于漾,梅梅*
VA5免疫增强剂对鸡新支流三联疫苗免疫效力及肉鸡生产性能的影响
陆吉虎1,3,4,唐应华1,4,朱亚露1,4,张雪花1,3,4,毕志香1,4,刘岳龙2,胡祥克2,董祥超2,王振2,李为坤2,滕姣2,于漾1,4,梅梅1,3,4*
(1.江苏省农业科学院动物免疫工程研究所,江苏 南京 210014;2.江苏省徐州市立华畜禽有限公司,江苏 徐州 221300;3.扬州大学兽医学院,江苏 扬州 225009;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
将VA5复方免疫增强剂与市售鸡新城疫-传染性支气管炎-禽流感(H9亚型)三联油乳剂灭活疫苗(以下简称“新支流三联疫苗”)合用免疫黄羽肉鸡,检测免疫后肉鸡的抗体效价、细胞因子及生产性能变化,评价VA5对鸡新支流三联疫苗的免疫增强作用及对肉鸡生产性能的影响。结果表明:黄羽肉鸡免疫含VA5的新支流三联疫苗后,在相同免疫剂量和免疫时间,血清和支气管肺泡冲洗液中针对新城疫病毒(NDV)、传染性支气管炎病毒(IBV)和H9亚型禽流感病毒(AIV(H9))的血凝抑制(HI)抗体效价均显著高于无VA5疫苗组的;泪液及小肠黏液中针对NDV、IBV和AIV(H9)的IgA抗体效价均高于无VA5疫苗组的;血清中IFN-γ和IL-4质量浓度均极显著高于无VA5疫苗组的;肉鸡出栏前,免疫含VA5的新支流三联疫苗组针对NDV和AIV(H9)的HI抗体合格率高于无VA5疫苗组的;添加VA5,提高了肉鸡平均成活率和上市率,同时降低了平均料肉比、呼吸道致病发病率和死淘率,增加了鸡只均质量,只均综合经济效益增幅达11.67%。综上所述,VA5免疫增强剂能提高新支流三联疫苗对黄羽肉鸡的免疫效力,同时提高了生产性能。
黄羽肉鸡;VA5复方免疫增强剂;新支流三联疫苗;抗体效价;免疫效力;生产性能
鸡新城疫(ND)、鸡传染性支气管炎(IB)和H9亚型禽流感(AI(H9))分别是由新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)及H9亚型禽流感病毒(AIV(H9))引起的高发病率、接触性传染性疾病,严重威胁养鸡业的健康发展。生产中接种油乳剂单苗或联苗防控该类疾病。疫苗的推广使用,使病原不断发生变异;同时禽类的集约化、规模化养殖使疫病流行日趋复杂,这都使养殖业的疫病防控难度逐步加大。动物的天然免疫系统中多种细胞都可通过TLR(toll-like receptor)来调节机体细胞活性,产生细胞因子[1]。poly(I:C)(TLR3配体)和CpG (TLR21配体)等可诱导机体TLR的表达,并增强宿主机体对高致病性流感病毒的抵抗力[2]。用poly(I:C)与PRRS灭活疫苗共同免疫动物,可诱导产生高效价的血清抗体[3]。LPS(TLR4配体)可以增强ND灭活疫苗免疫后的血清血凝抑制(HI)抗体效价[4],R-848(TLR7配体)与ND灭活疫苗合用能明显提升免疫后血清HI抗体效价,增强脾脏中FN-α、IFN-β、IFN-γ、IL-1β、IL-4等细胞因子的表达,提高疫苗对ND强毒株的攻毒保护率[5]。总之,TLR配体能够增强动物机体免疫,具有作为疫苗佐剂的潜力。
笔者前期的研究[6-8]已筛选获得可与疫苗配伍使用的含有多种TLR配体成分的VA5复方免疫增强剂,并评价了该增强剂对禽流感疫苗、禽用新城疫-禽流感(H9亚型)二联疫苗、新城疫-传染性法氏囊二联疫苗等的免疫增强效果。本研究主要探索VA5复方免疫增强剂与鸡新城疫-传染性支气管炎-禽流感(H9亚型)三联油乳剂灭活疫苗(以下简称“新支流三联疫苗”)在肉鸡上合用的免疫增强效果及对肉鸡相关生产性能的影响,以明确该免疫增强剂的适用范围。
1 材料与方法
1.1 材料
供试黄羽肉鸡购自江苏海安某孵化场,于普通环境中饲养。SPF鸡胚种蛋购自北京勃林格殷格翰维通生物公司,由江苏省农业科学院动物免疫工程研究所实验室孵化。
鸡新城疫-传染性支气管炎-禽流感(H9亚型)三联油乳剂灭活疫苗(La Sota株+M41株+NJ02株)为市售商品化疫苗。AI(H9)毒株为A/Chicken/YC- 16/2014(YC-16,H9N2),分离自某肉鸡养殖场;ND为PD-13毒株,分离自某肉鸡养殖场,经初步鉴定为基因Ⅶd型。
传染性支气管炎(M41株)检测抗原为荷兰GD产品;鸡新城疫、禽流感(H9亚型)血凝抑制检测抗原、新城疫阳性血清、传染性支气管炎(M41株)阳性血清购自哈尔滨维科生物技术公司;羊抗鸡IgA-HRP抗体为Thermo产品;鸡IFN-γ ELISA试剂盒(CAC1233)为Invitrogen产品;鸡IL-4 ELISA试剂盒(CSB-E06756Ch)为武汉华美生物公司产品;RNA提取试剂盒为Axygen产品。扩增NDV特异性片段的引物(NP1、NP2序列分别是5´-ATGGGC YCCAGAYCTTCTAC-3´和5´-CTGCCACTGCTAG TTGTGATAATCC-3´),AIV(H9)特异性片段的引物(H9P1、H9P2序列分别是5´-TCAACAAACTCCA CCGAAACTGT-3´和5´-TCCCGTAAGAACATGT CCATACCA-3´)[9-10]由南京金斯瑞生物公司合成。
1.2 含VA5疫苗的配制及免疫
参照文献[6]的方法,配制油乳剂型的VA5免疫增强剂。将配制的油乳剂型VA5免疫增强剂(0.01 mL/羽份)与市售商品化油乳剂新支流三联疫苗按比例充分混匀即可使用。免疫途径为颈背部皮下注射。
1.3 疫苗免疫剂量优化试验
将10日龄黄羽肉鸡随机分组,添加VA5的新支流三联疫苗分别设0.5、0.3、0.1 mL/羽份3个不同免疫剂量,分别记为N5V、N3V、N1V;不添加VA5的新支流三联疫苗分别设0.5、0.3、0.1 mL/羽份3个不同免疫剂量,分别记为N5、N3、N1。共6组免疫试验组,20只/组。同时设1组生理盐水对照组(CK),10只/组。免疫后第2、3、4周采集翅静脉血,6 500 r/min离心10 min,分离血清存于-20 ℃,待检。免疫后第4周,每组鸡抽取5只放血处死,用注射器抽取10 mL PBS缓冲液缓缓注入气管,随后吸出,再次注入,反复2~3次,最后收集约1 mL支气管肺泡冲洗液(BAL),于4 ℃、10 000离心10 min后待检[8]。用HI试验分别检测免疫后的血清和BAL针对NDV、IBV和AIV(H9)的抗体效价(以log2表示)[7,9]。
1.4 VA5对新支流三联疫苗的免疫效力增强试验
选择2家农户,每家各取2个饲养棚的黄羽肉鸡进行试验。A农户2个饲养棚分别饲养32 000、16 000只;B农户2个饲养棚分别饲养16 000、8 000只。A、B农户均为一个棚免疫含VA5新支流三联疫苗(记为AN3V、BN3V);另一个棚免疫无VA5新支流三联疫苗(记为AN3、BN3)。根据免疫剂量优化试验结果,选用0.3 mL/羽份,于1日龄和10日龄各免疫1次。二免后的第1、2、3、4周,分别从每个饲养棚随机取20只鸡采集翅静脉血,分离血清,保存于-20 ℃冰箱,待检。二免后第1、2、3周,分别从每个饲养棚随机抽取10只鸡,放血处死后抽取BAL;取鸡腺胃后长度为10 cm的小肠,剖开,用PBS冲洗,去掉肠内容物,然后,用玻璃棒轻轻刮下肠内表面黏液。该BAL和小肠黏液分别于4 ℃、10 000离心10 min后待检[7,10]。二免后第2、3、4周,从每个饲养棚随机抽取10只试验鸡采集泪液(第3周采样后每只鸡加脚环标记,以备后续试验),待检[11]。按试剂盒说明书操作检测第1、2周血清中IL-4和IFN-γ的质量浓度[8]。采用ELISA方法[11]检测泪液、小肠黏液中针对NDV、IBV和AIV(H9)的黏膜抗体IgA抗体效价(以450 nm表示),具体为以灭活的NDV、IBV(M41)和AIV(H9)(5 μg/mL)为检测抗原,羊抗鸡IgA-HRP为二抗(1 000倍稀释),酶标仪读取各样品孔的450 nm。
二免后第2、3、4、5周,从每个饲养棚随机抽取10只鸡,采集鸡泄殖腔和喉气管棉拭子,浸入1.2 mL无菌双抗PBS中,将每只鸡的2个拭子浸出液混合,12 000 r/min离心10 min后取上清,经尿囊腔接种10日龄SPF鸡胚(0.1 mL/只),每份样品接种5只鸡胚。37 ℃孵育观察120 h后,去除24 h内死亡鸡胚,所剩鸡胚于4 ℃存放12 h,然后检测各鸡胚尿囊液的血凝(HA)效价(以log2表示)。ND判定标准为5只SPF鸡胚中有1只尿囊液HA效价大于等于4log2,且标准ND阳性血清对其HI效价大于等于4log2,则判为阳性[9]。AI(H9)判定标准为5只鸡胚中有1只HA效价大于等于4log2,则判为阳性[12]。首次病毒分离阴性的样品尿囊液,经SPF鸡胚进行盲传1代后再行判定。
1.5 黏膜抗体与攻毒保护的相关性试验
在1.4中所述加脚环标记的试验鸡中,选取针对NDV和AIV(H9)的抗体450 nm分别为0.6~0.8、>0.8~1.0和>1.0的各10只鸡,共30只鸡,饲养于负压隔离器中进行攻毒试验。NDV PD-13株每只肌肉注射0.1 mL(含1.0×10-5.0EID50),AIV(H9) YC-16株每只滴鼻0.1 mL(含1.0×10-6EID50),观察14 d,记录鸡饮食及发病死亡等情况。攻毒后3、5、7 d分别采集鸡喉气管、泄殖腔棉拭子,并接种SPF鸡胚,检测排毒情况,方法同1.4中所述。
1.6 免疫增强剂对肉鸡生产性能的影响试验
2016年7月至2017年7月,在3个养殖示范区内,免疫含VA5新支流三联疫苗的不同品种黄羽肉鸡510 075羽,免疫无VA5新支流三联疫苗的不同品种黄羽肉鸡506 201羽。各批次肉鸡出栏前分别从每户抽取8~10只鸡,采集翅静脉血并分离血清。共采集1 680份血清样品,其中480份为无VA5新支流三联疫苗免疫对照,检测针对NDV和AIV(H9)的HI抗体。同时采集喉气管、泄殖腔棉拭子,总计100份,用于RT-PCR方法检测隐性带毒情况。统计各养殖户各个批次饲养肉鸡(70日龄前出栏的快速鸡、70~83日龄出栏的中速鸡、83日龄以上出栏的优质鸡)的鸡苗数量、育成期末成活的育成鸡数、出栏鸡数及死亡淘汰鸡数,计算育成鸡成活率、上市率及死淘率下降率。统计呼吸道发病鸡数(除ND和AI(H9)之外的致病原因导致的呼吸道堵塞等),计算呼吸道发病率及呼吸道发病率下降率。统计药品使用数量、育成鸡出栏时体质量及饲料使用量,计算料肉比及只均综合经济效益。
1.7 数据处理
应用Excel 2016计算试验数据的几何平均数和标准差,采用检验比较各组差异。
2 结果与分析
2.1 疫苗免疫剂量优化试验结果
如表1所示,在相同免疫剂量和免疫时间,含VA5免疫组的血清HI效价均显著高于无VA5免疫组的(<0.05),提高1log2以上。含VA5的0.1 mL免疫组在免疫后的第2、3、4周的血清HI效价均高于或相当于同时间点的0.5 mL无VA5免疫组的血清HI效价。免疫后第4周,相同免疫剂量情况下,针对IBV、AIV(H9)的抗体,含VA5免疫组的BAL的HI效价均极显著高于无VA5免疫组的(<0.01),提高1.5log2以上;而针对NDV的抗体,含VA5免疫组的BAL的HI效价均显著高于无VA5免疫组的(<0.05),提高1log2以上。其中,含VA5的0.1 mL免疫组的BAL的HI效价均高于0.5 mL无VA5免疫组的。综合以上免疫后血清和BAL的HI效价及经济因素,以采用免疫剂量0.3 mL/羽份较为适宜。
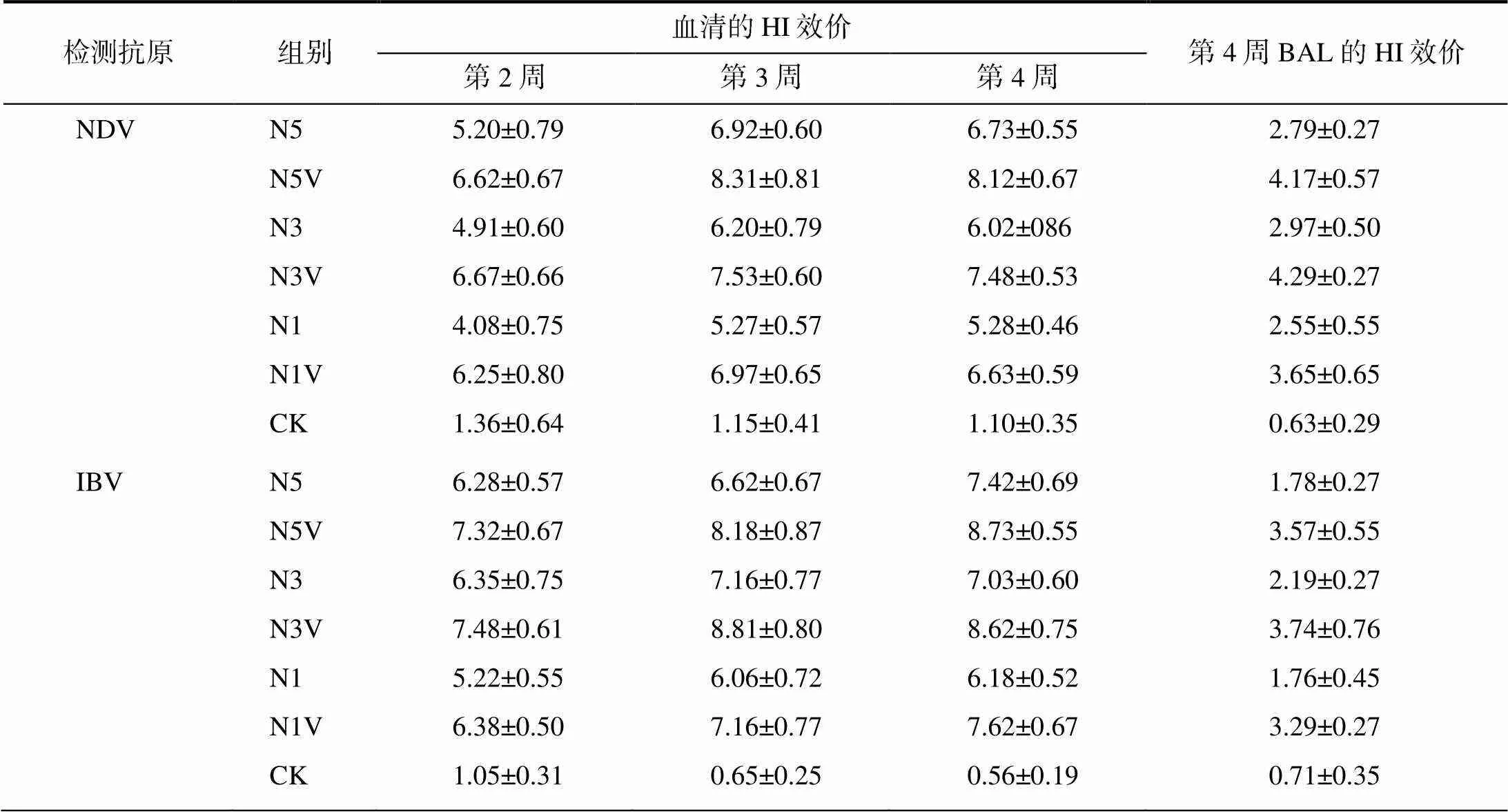
表1 不同剂量含或无VA5新支流三联疫苗免疫肉鸡后的血清和BAL的HI效价(nlog2)
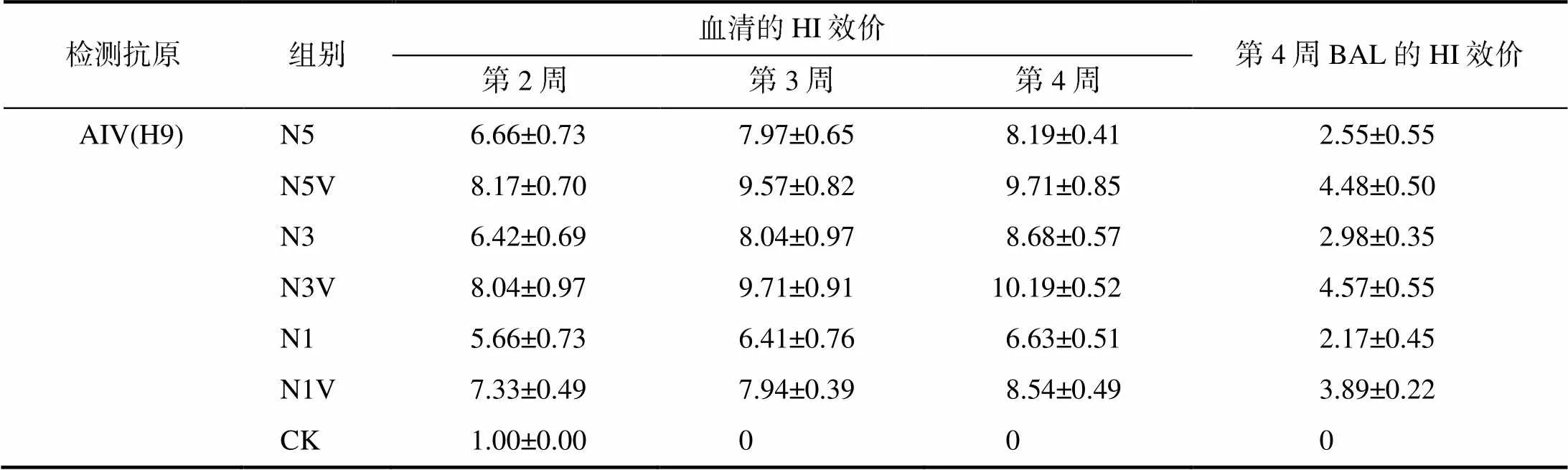
表1(续)
相同免疫剂量和免疫时间,除针对IBV、AIV(H9)的抗体的含VA5免疫组与无VA5免疫组间的BAL的HI效价差异极显著(<0.01)外,含VA5免疫组与无VA5免疫组间的HI效价均差异显著(<0.05)。
2.2 VA5对新支流三联疫苗对黄羽肉鸡的免疫效力的影响
2.2.1供试肉鸡的血清抗体效价
如表2所示,2个养殖户试验鸡群中,含VA5疫苗免疫后1周,针对AIV(H9)的HI效价分别为7.58log2、7.02log2,达到最低有效保护价(6log2)以上,而无VA5免疫组在免疫后2周才达到该水平以上;免疫后第1、2、3、4周,含VA5免疫组的针对AI(H9)的HI效价均显著高于无VA5免疫组的(<0.05),分别平均提高了1.60log2、1.17log2、1.22log2、1.40log2。针对NDV的抗体效价,免疫后第1、2、3周各组抗体持续上升;在相同时间点,含VA5免疫组的HI效价显著高于无VA5免疫组的(<0.05),均提升1log2以上。针对IBV抗体,免疫后第1、2、3周,含VA5免疫组的HI效价显著高于无VA5免疫组的(<0.05),均提高1log2以上。
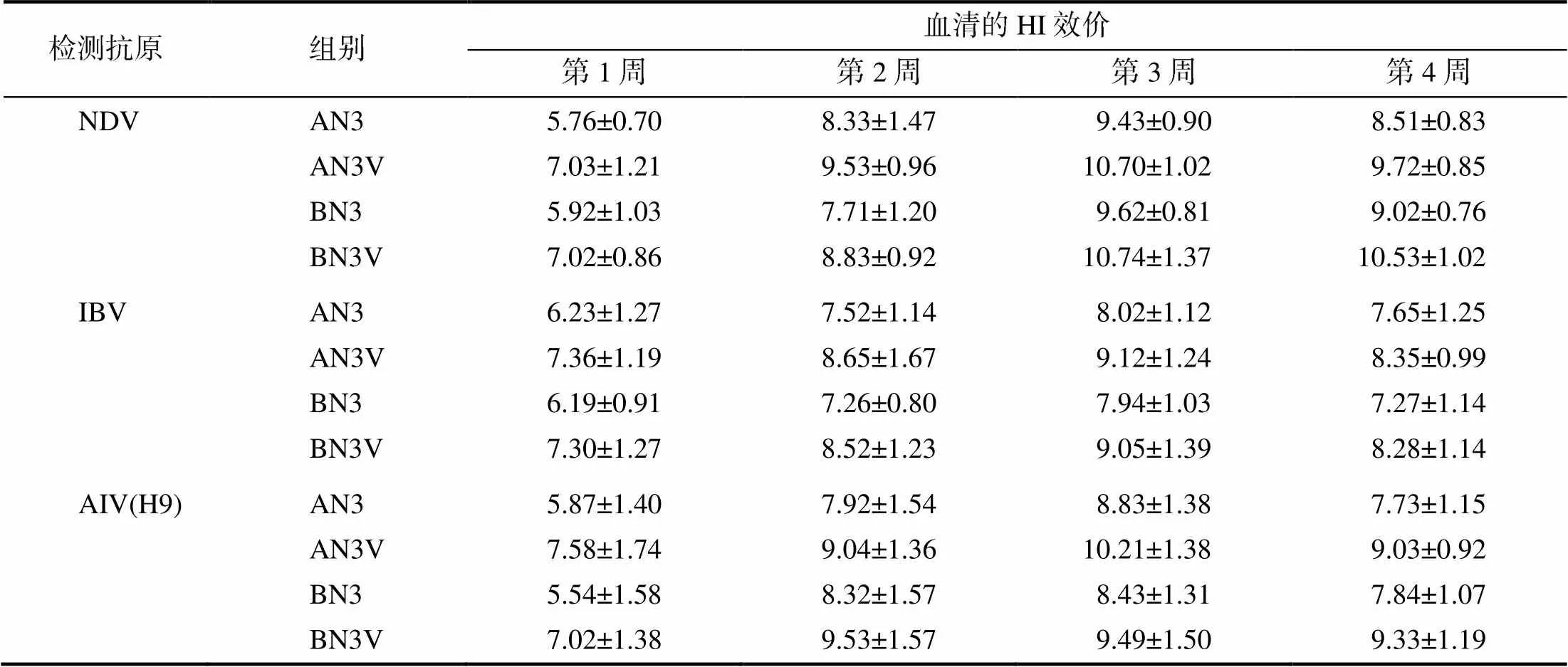
表2 含或无VA5新支流三联疫苗免疫肉鸡后的血清HI效价(nlog2)
相同免疫剂量和免疫时间,除针对IBV的抗体免疫后第4周的HI效价外,含VA5免疫组与无VA5免疫组间的HI效价差异显著(<0.05)。
2.2.2供试肉鸡的BAL抗体效价
如表3所示,针对NDV和IBV抗体,含VA5免疫组的黏膜HI效价显著高于无VA5组的(<0.05),分别平均提高了1.14log2和1.02log2;针对AIV(H9)抗体,含VA5免疫组的黏膜HI效价极显著高于无VA5免疫组的(<0.01),平均提高了1.56log2;各免疫组在免疫后第1、2、3周抗体均持续上升。
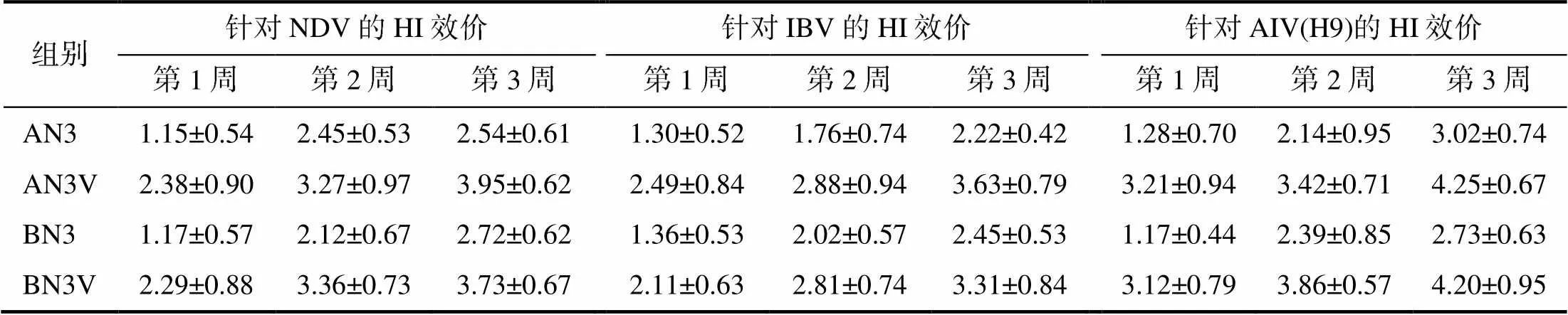
表3 含或无VA5新支流三联疫苗免疫肉鸡后BAL的HI效价(nlog2)
相同免疫剂量和免疫时间,针对NDV、IBV的抗体的含VA5免疫组与无VA5免疫组间的HI效价差异显著(<0.05);针对AIV(H9)的抗体的含VA5免疫组与无VA5免疫组间的HI效价差异极显著(<0.01)。
2.2.3供试肉鸡泪液中的抗体效价
如表4所示,针对NDV和AIV(H9),在免疫后第2周,含VA5免疫组的抗体450 nm已在临界保护值(450 nm=0.8)以上,含VA5免疫组的抗体450 nm均显著高于相应时间点的无VA5免疫组的(<0.05);针对IBV,含VA5免疫组的抗体450 nm高于相应时间点的无VA5免疫组的,其中第3、4周的含VA5免疫组与无VA5免疫组的抗体450 nm间的差异有统计学意义(<0.05);随时间推移,含VA5免疫组的抗体450 nm持续上升,而无VA5免疫组的抗体450 nm维持比较平稳状态。

表4 含或无VA5新支流三联疫苗免疫肉鸡后泪液中IgA抗体效价
相同免疫剂量和免疫时间,除针对IBV的抗体的免疫后第2周的450 nm外,含VA5免疫组与无VA5免疫组间的450 nm差异显著(<0.05)。
2.2.4供试肉鸡小肠黏液中的抗体效价
如表5所示,在免疫后第1、2、3周的鸡小肠黏液中,含VA5免疫组抗体450 nm均显著高于相应时间点的无VA5免疫组的(<0.05);随时间推移,含VA5免疫组抗体450 nm持续上升,而无VA5免疫组的针对NDV和IBV的抗体450 nm变化不大。
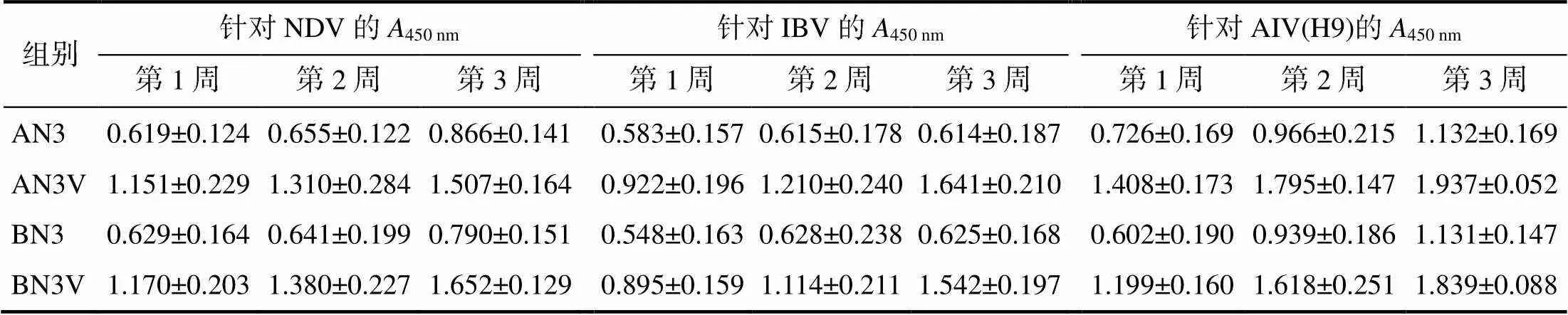
表5 含或无VA5新支流三联疫苗免疫肉鸡后小肠黏液中IgA抗体效价
相同免疫剂量和免疫时间,含VA5免疫组与无VA5免疫组间的450 nm差异显著(<0.05)。
2.2.5供试肉鸡血清中细胞因子的质量浓度
如表6所示,含VA5免疫组血清中IFN-γ和IL-4的质量浓度均极显著高于无VA5免疫组的(<0.01)。
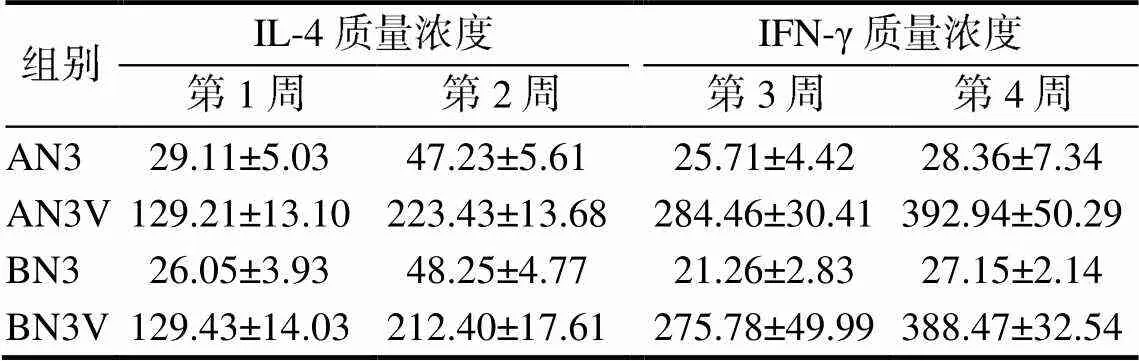
表6 肉鸡免疫含或无VA5新支流三联疫苗后血清中IFN-γ和IL-4的质量浓度
相同免疫剂量和免疫时间,含VA5免疫组与无VA5免疫组间的IFN-γ和IL-4的质量浓度差异极显著(<0.01)。
2.2.6供试肉鸡的病毒分离结果
所有SPF鸡胚的尿囊液均为阴性。鸡胚尿囊液样品经10日龄SPF鸡胚盲传1代后检测也均为阴性。可见,各免疫组均无隐性带毒现象。
2.2.7供试肉鸡的黏膜抗体与攻毒保护的相关性
AIV(H9)和NDV攻毒后,连续观察14 d,各攻毒组试验鸡的饮水、采食等活动正常,无精神不振、羽毛凌乱等临床症状。仅在450 nm为0.6~0.8的攻毒组中出现排毒,其他攻毒组中均未分离到病毒。在450 nm为0.6~0.8的攻毒组中,NDV攻毒后第3天,喉气管和泄殖腔样品中均有1只为阳性(1/5),攻毒后第5天,喉气管样品中有1只为阳性(1/5);AIV(H9)攻毒后第3天,喉气管和泄殖腔样品均有1只为阳性(1/5),攻毒后第5天,喉气管样品有2只为阳性(2/5),泄殖腔样品中有1只为阳性(1/5)。该结果表明,免疫后泪液的450 nm为0.8时,为有效临界保护值。
2.3 VA5对新支流三联疫苗免疫肉鸡的生产性能的影响
2.3.1出栏肉鸡的抗体合格率
如表7所示,针对NDV的抗体,含VA5免疫的肉鸡血清抗体合格率达97%以上(以HI效价不小于4log2为合格),而无VA5免疫的肉鸡血清抗体合格率仅为89.79%;针对AIV(H9)的抗体,含VA5免疫的肉鸡血清抗体合格率达86.00%(以HI效价不小于6log2为合格),而无VA5免疫的血清抗体合格率仅73.75%。可见,VA5提高了出栏肉鸡针对NDV和AIV(H9)的抗体合格率。
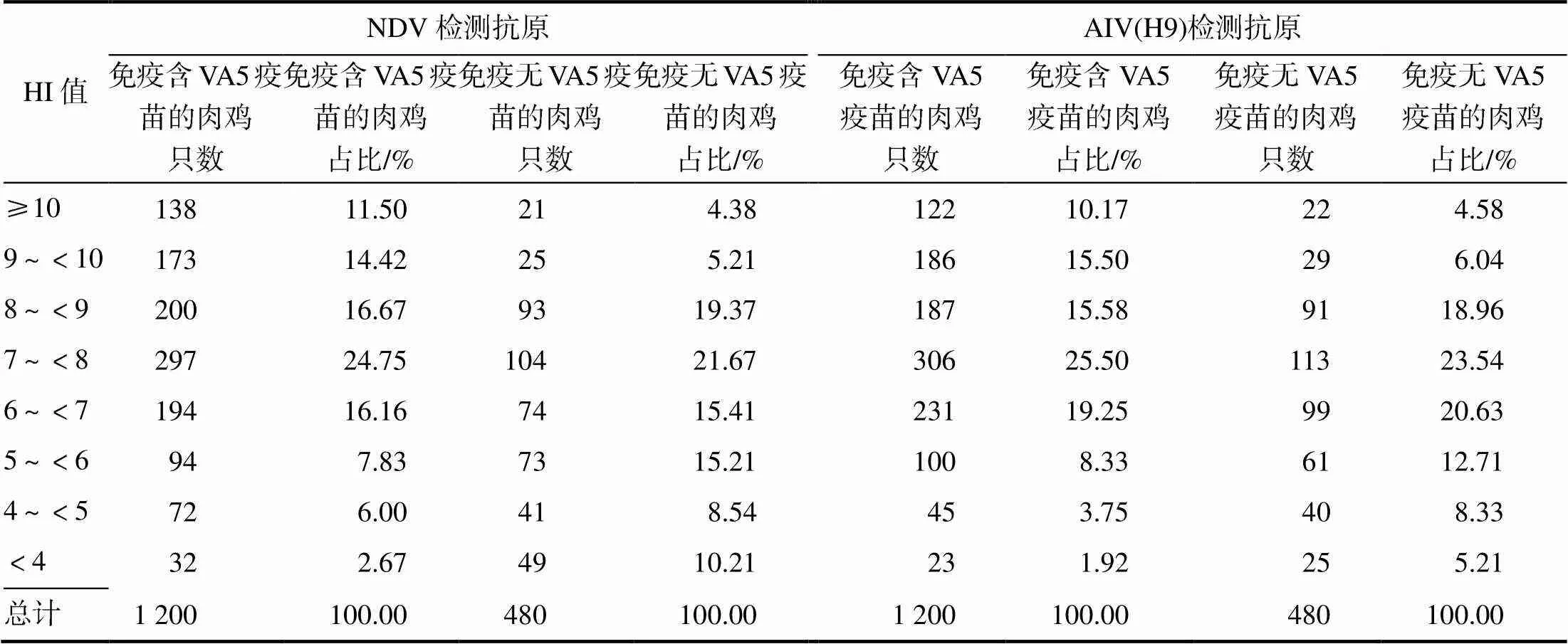
表7 肉鸡免疫含或无VA5新支流三联疫苗出栏时的抗体合格率
2.3.2出栏肉鸡隐性带毒检测结果
对100份棉拭子样品分别抽提RNA,用RT-PCR方法扩增AIV(H9)和NDV的特异性基因片段,1%琼脂糖凝胶电泳结果显示,均未扩增出特异性条带。该结果表明,免疫含或无VA5新支流三联疫苗的出栏肉鸡均无隐性带毒现象。
2.3.3供试肉鸡的生产性能
如表8所示,与免疫无VA5新支流三联疫苗的肉鸡相比,70日龄前出栏的快速鸡中,免疫含VA5新支流三联疫苗肉鸡的平均成活率和上市率均提高了5个百分点,平均料肉比降低了0.01,呼吸道致病发病率下降59.1%,死淘率下降35.7%;70~83日龄出栏的中速鸡中,免疫含VA5新支流三联疫苗肉鸡的平均成活率和上市率分别提高了3个百分点和2个百分点,料肉比降低了0.03,呼吸道发病率下降69.6%,死淘率下降27.3%;83日龄以上出栏的优质鸡中,免疫含VA5新支流三联疫苗肉鸡的平均成活率和上市率分别提高了2个百分点和1个百分点,料肉比降低了0.04,呼吸道发病率下降12.5%,死淘率下降25.0%。
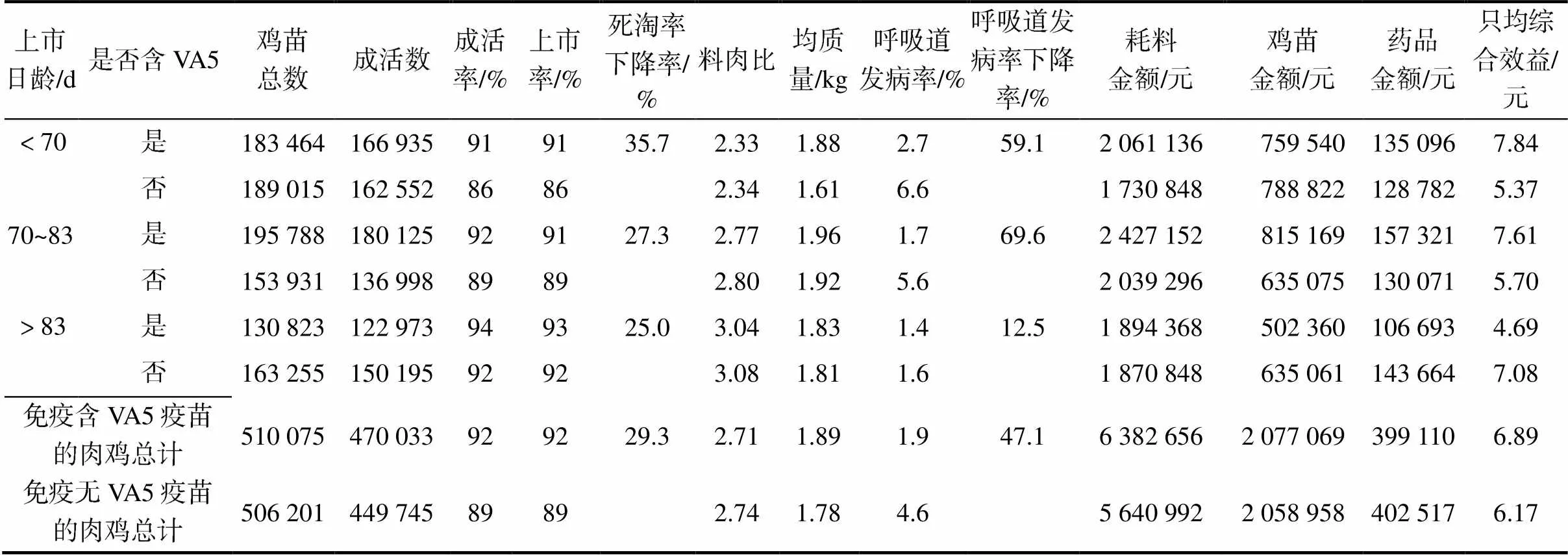
表8 肉鸡免疫含或无VA5新支流三联疫苗后的生产性能
2.3.4供试肉鸡出栏质量及综合效益
如表8所示,免疫无VA5新支流三联疫苗的黄羽肉鸡506 201羽,平均上市率89%,鸡均质量为1.78 kg,按照全年平均销售价格14元/kg计算,只均综合效益为6.17元;免疫含VA5新支流三联疫苗的黄羽肉鸡510 075羽,平均上市率92%,鸡均质量为1.89 kg,可实现销售收入1 241.68万元,只均综合效益为6.89元,经济效益提高了11.67%。
3 结论与讨论
本研究中,与无VA5新支流三联疫苗相比,VA5与新支流三联疫苗共同免疫黄羽肉鸡能显著提升血清及BAL中针对NDV、IBV、AIV(H9)的HI抗体效价;提升泪液和小肠黏液中针对NDV、IBV、AIV(H9)的IgA抗体450 nm,同时也提高了血清中细胞因子IFN-γ和IL-4的质量浓度;含VA5新支流三联疫苗免疫组泪液中针对NDV和AIV(H9)的IgA抗体450 nm均在有效保护临界值(450 nm=0.8)以上,攻毒后喉气管和泄殖腔中均无排毒现象。VA5中的配体成分与机体内免疫细胞表面的TLRs受体结合后激活细胞,诱导更多细胞因子表达[13],增强了机体抗病毒感染的能力。ST PAUL等[14]研究表明,LPS能显著调高IFN-γ、IL-10、IL-13和IL-1β等基因表达;CpG ODN促进了IFN-γ、IL-10和IL-8等的上调[14-15],同时能限制IBV在不同组织中的繁殖[15]。H9N2灭活疫苗与CpG(2 μg/羽)共同免疫SPF鸡,均产生较高的血清HI效价、病毒中和效价(VN)及高滴度的IgY抗体[16]。VA5中不同配体间具有协同效应[13],因此,在疫苗中添加VA5较单一使用某种配体具有更好的免疫增强效果。HE等[17]研究表明,poly(I:C)和CpG-ODN共同作用鸡单核细胞时比单独使用poly(I:C)或CpG-ODN能够明显诱导更多的IL-4、IL-10及IFN-γ等细胞因子的表达。
本研究中,与无VA5新支流三联疫苗相比,VA5与新支流三联疫苗在肉鸡中的配合使用,明显提高了黄羽肉鸡的上市率和出栏时抗体合格率,降低了料肉比和呼吸道发病率,提高了出栏质量和经济效益。
综上可知,与常规新支流三联疫苗相比,含VA5的新支流三联疫苗免疫能使机体提前产生抗体,且抗体效价高,提高血清中细胞因子质量浓度及攻毒保护率,且可增加养殖的经济效益。可见,VA5免疫增强剂在养禽业中具有广阔的应用前景,值得推广使用。
[1] ST PAUL M,MALLICK A I,READ L R,et al. Prophylactic treatment with toll-like receptor ligands enhances host immunity to avian influenza virus in chickens[J].Vaccine,2012,30(30):4524-4531.
[2] WONG J P,CHRISTOPHER M E,VISWANATHAN S,et al.Activation of toll-like receptor signaling pathway for protection against influenza virus infection[J]. Vaccine,2009,27(25/26):3481-3483.
[3] ZHANG L L,BAI J,LIU J,et al.Toll-like receptor ligands enhance the protective effects of vaccination against porcine reproductive and respiratory syndrome virus in swine[J].Veterinary Microbiology,2013,164 (3/4):253-260.
[4] KANNAKI T R,PRIYANKA E,REDDY M R.Co- administration of toll-like receptor(TLR)-3 and 4 ligands augments immune response to Newcastle disease virus(NDV) vaccine in chicken[J].Veterinary Research Communications,2019,43:225-230.
[5] SACHAN S,RAMAKRISHNAN S,ANNAMALAI A,et al.Adjuvant potential of resiquimod with inactivated Newcastle disease vaccine and its mechanism of action in chicken[J].Vaccine,2015,33(36):4526-4532.
[6] 陆吉虎,吴培培,张雪花,等.免疫增强剂提高禽用二联苗免疫效力的研究[J],中国农业科技导报,2016,18(1):58-65. LU J H,WU P P,ZHANG X H,et al.Studies on immunopotentiator improving bivalent vaccine efficacy in poultry[J].Journal of Agricultural Science and Technology,2016,18(1):58-65.
[7] 陆吉虎,吴培培,张雪花,等.免疫增强剂提高H9亚型禽流感灭活疫苗在SPF鸡体细胞因子的免疫应答[J].江苏农业学报,2016,32(2):408-413.LU J H,WU P P,ZHANG X H,et al. Immunopotentiators improving the cytokine immune response to inactivated H9 subtype avian influenza vaccine in SPF chickens[J]. Jiangsu Journal of Agricultural Sciences,2016,32(2):408-413.
[8] LU J H,WU P P,ZHANG X H,et al.Immunopotentiators improve the efficacy of oil-emulsion-inactivated avian influenza vaccine in chickens,ducks and geese[J].PLoS One,2016,11(5):e0156573.
[9] GB/T 16550—2008新城疫诊断技术[S]. GB/T 16550—2008Diagnostic techniques for Newcastle disease[S].
[10] 包红梅,王秀荣,陶启蒙,等.H9亚型禽流感病毒RT-PCR检测方法的建立[J].中国兽医科学,2010,40(4):384-389. BAO H M,WANG X R,TAO Q M,et al.Development of one step RT-PCR assay for detection of avian influenza virus subtype H9[J].Chinese Veterinary Science,2010,40(4):384-389.
[11] WU P P,LU J H,FENG L,et al.Antigen-sparing and enhanced efficacy of multivalent vaccines adjuvanted with immunopotentiators in chickens[J].Frontiers in Microbiology,2017,8:927.
[12] 中国兽药典委员会.中华人民共和国兽药典(三部)[M]. 2015年版.北京:中国农业出版社,2016. Commission of Chinese Veterinary Pharmacopoeia. Pharmacopoeia of the People's Republic of China(Part Three)[M].2015 ed.Beijing:China Agricultural Press,2016.
[13] TANG Y H,LU J H,WU P P,et al.Inactivated vaccine with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens[J].Veterinary Microbiology,2014,172(1/2):120-128.
[14] ST PAUL M,MALLICK A I,HAQ K,et al.In vivo administration of ligands for chicken toll-like receptors 4 and 21 induces the expression of immune system genes in the spleen[J].Veterinary Immunology and Immunopathology, 2011,144(3/4):228-237.
[15] DAR A,POTTER A,TIKOO S,et al.CpG oligodeoxy- nucleotides activate innate immune response that suppresses infectious bronchitis virus replication in chicken embryos[J].Avian Diseases,2009,53(2):261-267.
[16] SINGH S M,ALKIE T N,HODGINS D C,et al. Systemic immune responses to an inactivated,whole H9N2 avian influenza virus vaccine using class B CpG oligonucleotides in chickens[J].Vaccine,2015,33(32):3947-3952.
[17] HE H,GENOVESE K J,SWAGGERTY C L,et al. Co- stimulation with TLR3 and TLR21 ligands synergistically up-regulates Th1-cytokine IFN-γ and regulatory cytokine IL-10 expression in chicken monocytes[J].Developmental & Comparative Immunology,2012,36(4):756-760.
The effect of VA5 immunopotentiator on the efficacy of triplex oil emulsion vaccine and the productivity of broiler chickens
LU Jihu1,3,4, TANG Yinghua1,4, ZHU Yalu1,4, ZHANG Xuehua1,3,4, BI Zhixiang1,4, LIU Yuelong2, HU Xiangke2, DONG Xiangchao2, WANG Zhen2, LI Weikun2, TENG Jiao2,YU Yang1,4, MEI Mei1,3,4*
(1.Institute of Veterinary Immunology & Engineering,Jiangsu Academy of Agricultural Sciences, Nanjing, Jiangsu 210014, China; 2.Xuzhou Lihua Livestock and Poultry Co. Ltd, Xuzhou, Jiangsu 221300, China; 3.College of Veterinary Medicine, Yangzhou University, Yangzhou, Jiangsu 225009, China; 4.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou, Jiangsu 225009, China)
The objective of this study was to investigate VA5 immunopotentiator efficacy on the trivalent oil emulsion vaccine and the productivity of broiler chickens. The antibody titer, production of cytokines and productivity was evaluated after the VA5 mixing with the commercial trivalent vaccine, Newcastle disease(ND)-Infectious Bronchitis(IB)-H9 Subtype Avian Influenza(AI(H9)) vaccinated in Chinese color-feathered broiler chickens. In the vaccination groups of trivalent vaccine with VA5, the hemagglutination inhibition(HI) antibody titers of sera or bronchoalveolar lavage fluids(BAL) against NDV, IBV and H9 AIV were significant higher than those in groups
trivalent vaccine without VA5 post vaccination(pv), respectively. Similar to the HI antibody levels, the IgA antibody levels in tears or small intestine mucus against NDV, IBV and AIV(H9) were higher in groups of trivalent vaccine with VA5 than those of the trivalent vaccine only. The expression of interferon(IFN)-gamma, interleukin(IL)-4 in sera also enhanced by VA5 immunopotentiator. In addition, our data showed enhanced the qualified rate of HI antibody, average survival rate of broilers, weight, synthetic economy benefit and depressed feed conversion ratio, respiratory morbidity, mortality and elimination rate after administration trivalent vaccine with VA5 as compared to those of chickens inoculated with the trivalent vaccine alone. In conclusion, the study demonstrated the compound preparation of VA5 immunopotentiator is helpful on improving the efficacy of trivalent vaccine or the productivity in broiler chickens and shows prosperity in application.
Chinese color-feathered broiler chickens; compound preparation of VA5 immunopotentiator; trivalent vaccine; antibody titer; immune efficacy; productivity
S852.4
A
1007-1032(2020)05-0585-09
陆吉虎,唐应华,朱亚露,张雪花,毕志香,刘岳龙,胡祥克,董祥超,王振,李为坤,滕姣,于漾,梅梅.VA5免疫增强剂对鸡新支流三联疫苗免疫效力及肉鸡生产性能的影响[J].湖南农业大学学报(自然科学版),2020,46(5):585-593.
LU J H, TANG Y H, ZHU Y L, ZHANG X H, BI Z X, LIU Y L, HU X K, DONG X C, WANG Z, LI W K, TENG J, YU Y, MEI M. The effect of VA5 immunopotentiator on the efficacy of triplex oil emulsion vaccine and the productivity of broiler chickens[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(5): 585-593.
http://xb.hunau.edu.cn

2020-01-01
2020-03-22
国家重点研发计划项目(2017YFD0500706-2);教育部禽类预防医学/江苏省动物预防医学重点实验室开放课题(YF201801)
陆吉虎(1972—),男,江苏赣榆人,硕士,副研究员,主要从事动物免疫学及兽用疫苗研究,lujihu@163.com;*通信作者,梅梅,博士,副研究员,主要从事动物免疫学研究,jacqui18@163.com
责任编辑:邹慧玲
英文编辑:柳正

