水稻OsBI-IL-8基因启动子功能分析
陈睿 于法科 李清贤 单贞

摘要:[目的]分析水稻OsBI-IL-8基因启动子的结构与功能,解析OsBI-IL-8基因的表达特性及生物学功能,进一步了解OsBI-IL家族在水稻生命进程中的作用机理。[方法]利用BDGP、Softberry及Promoter2.0预测分析水稻OsBI-1L-8启动子大小,以日本晴基因DNA为模板扩增pOsBI-1L-8,PlantCARE分析序列中顺序调控元件。构建pOsBI-1L-8::GUS载体,导入水稻,组织化学染色法检测pOsBI-1L-8在水稻中的时空表达特征。[结果]通过预测分析并克隆pOsBl-lL-8长度为1258bp,该区域含有光信号、缺氧胁迫应答及激素调节等顺式作用元件。pOsBl-IL-8驱动的GUS报告基因仅表达于水稻抽穗期的茎结合部位、根茎过渡区和雄蕊。[结论]pOsBl-lL-8为组织特异型启动子,推测OsBI-1L-8可能在水稻生长及雄蕊发育中起重要作用。
关键词:水稻;OsBI-1L-8;启动子;表达特征;GUS活性
中图分类号:S511文献标志码:A 文章编号:1008-0384(2020)05-0474-06
0引言
(研究意义)B8X iohibitor-l(BI-1)是一种与BCL2和BCL-X相互作用的凋亡抑制剂,可保护细胞免于凋亡和内质网应激,在人和动物肿瘤的发生转移、植物防御病原及非生物胁迫等方面發挥重要作用。已知单子叶模式植物水稻拥有8个Baxinhibitorl-related(BI-IL)基因(http://www.pantherdb.org/pantllcr/family.do?clsAccessionzPqqqR23291),然而该类基因如何参与水稻对生物及非生物胁迫的反应鲜见报道。水稻是我国主要的粮食作物之一,保障其高产稳产关系到国家的粮食安全,探讨水稻OsBI-1L基因的功能及调控机理具有重要意义。(前人研究进展)BI-1是一个进化高度保守的膜蛋白,包含有6~7个跨膜结构域,在人、动植物及真菌中均有同源序列。Xu和Reed在1998年酵母功能性筛查人cDNA时首次发现BI-1具有抑制Bax引起的凋亡功能。在人及动物中,BI-1基因的异常表达与肿瘤的发生密切相关,BI-1的过度表达保护细胞凋亡,反义表达则促进细胞凋亡;同时其在内质网应激、钙失衡、活性氧积累和代谢失调等过程均起重要作用。植物中BI-1基因研究相对动物滞后。拟南芥、大麦、水稻、棉花、小麦和烟草等植物中BI-1基因普遍参与抵抗病原体及非生物胁迫过程,其过表达能增强植物对外界胁迫的耐受性,显示该类基因是植物抵御外界不良影响的重要调控因子。水稻最早分离的OsBl-1(OsBI-1L-l)基因来源于含有稻瘟病菌细胞壁提取的悬浮培养细胞;接种灰霉病菌的水稻植株中OsBI-1表达量增高,暗示该基因在限制高敏反应或损伤后组织中细胞死亡的扩散方面起着次要的防御作用。毛细管电泳-质谱(CE-MS)的代谢组学分析AzBI-1过表达对水稻代谢组在氧化应激反应的影响,显示细胞死亡活性受抑制导致代谢适应能力的增强。(本研究切入点)目前仅明确OsBI-1(OsBI-1L-1)高表达有利于水稻抵抗病害,其余7个OsBI-1L功能未知。(拟解决的关键问题)本文选取OsBI-1L-8基因,构建pOsBI-IL-8::GUS表达载体,遗传转化获取水稻转基因植株,分析OsBI-1L-8基因启动子表达特性,探讨该基因在水稻整个生命进程中的功能,为进一步解析该基因的表达特性及生物学功能奠定基础。
1材料与方法
1.1材料与试剂
水稻材料为日本晴,表达载体pDMC203(含GUS基因)、pCAMBIAl300及农杆菌菌株LBA4404均由本实验室保存。PrimeSTAR~HS高保真DNA聚合酶、pMDl8-T、限制性内切酶及T4连接酶购自TaKaRa公司;DNA凝胶回收试剂盒、感受态细胞DH5a、GoldenFastPCRKit购自TIANGEN公司;GUS组织化学染色试剂盒购自Biosharp Life sciences公司;引物合成和测序由Sangon Biotech公司完成。
1.2预测与分析
通过NCBI下载OsBI-1L-8(LOC Os03g58150)基因ATG上游序列,利用BDGP数据库(http://www.fmitfly.org/seq tools/promoter.html)、Soffberry数据库(http://www.softberry.com/berry.phtml?topic=index&group=programs&subgroup=promoter)和Promoter 2.0数据库(http://www.cbs.dtu.dk/services/Promoter)分别预测启动子长度;PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子可能含有的顺式调控元件。
1.3克隆启动子
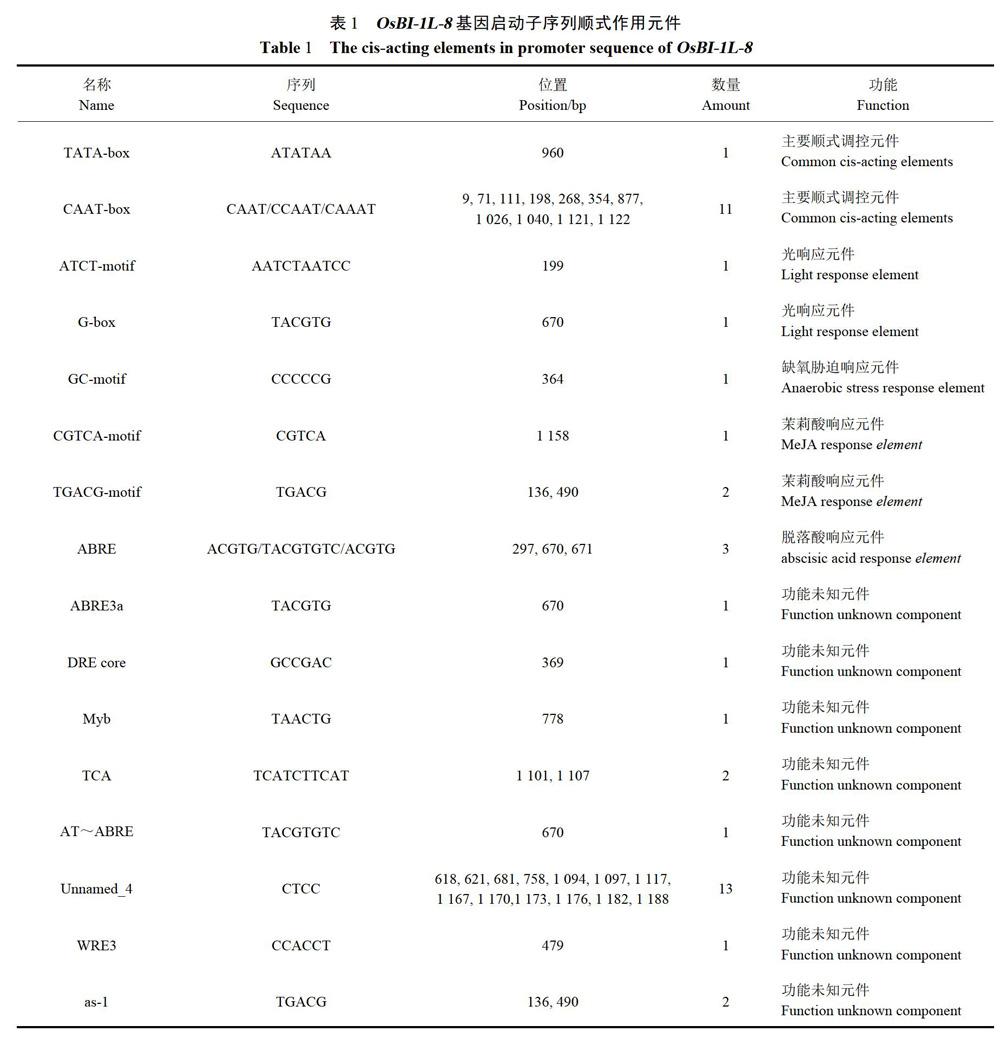
依据预测的启动子片段大小和插入pCAMBIAl300表达载体的酶切位点设计特异引物,pOsBI-1L-8-F:5'-CATGCCATGGGGCTTCCCTCTTCCTCTAGCCTCT-3'(下划线为限制性内切酶NcoI的酶切位点及保护碱基),pOsBI-1L-8-R:5'-CCTCACCTCAATCAAGAACTACCAACT-3',扩增大小l 258bp.CTAB法提取基因组DNA,PrimeSTAR~HS高保真酶扩增OsBI-1L-8启动子(pOsBI-1L-8)。扩增产防切胶回收连至pMDl8-T载体,热击转化,挑选阳性菌落PCR鉴定且测序验证。
1.4载体构建转化
pMDl 8T-pOsBI-1L-8及pDMC203质粒同时Pst UNcoI双酶切,产物电泳分离切胶回收,连接转化DH5a,引物pOsBI-1L-8-F/R鉴定阳性菌落,获得中间载体pDMC203-pOsBI-1L-8.将质粒pDMC203-pOsBI-1L-8及pCAMBLAl300用Pst I/EcoR I双酶切,将正确大小的pOsBI-1L-8-GUS的表达盒连人pCAMBIA1300位点,构建终载体pOsBI-1L-8::GUS(图1)。电击转化农杆菌并遗传转化。
1.5 GUS染色检测
To代转基因植株提取DNA,利用潮霉素磷酸转移酶基因(Apt)引物PCR鉴定阳性植株。APt-F:5'-TACACAGCCATCGGTCCAGA-3',APt-R:5'-TAGGAGGGCGTGGATATGTC-3',产物大小为844bp.T1代轉基因阳性植株在四叶期、抽穗期及灌浆期,取不同组织进行GUS染色过夜,用75%乙醇脱色数次,至完全脱色后显微镜观察拍照。
2 结果与分析
2.1 OsBI-1L-8基因启动子预测分析
由NCBI数据库可知,两基因LOC Os03958150(OsBI-1L-8,chr03:33103037.33105394,-strand)与LOC Os03g58160(chr03:33105843.。33109034,+strand)之间距离为500bp,截取两基因ATG上游1258bp片段作为OsBI-1L-8启动子序列。利用BDGP预测显示Promoter Sequence位于709~759bp处(Score=0.90),717~767bp处(Score=0.98)。So,berry预测FPROM显示Promoter POs.位于749bp,TATA-box(TATAATGG)始于727bp;TSSs显示TATA-boxposition为863bp;TSSP显示Promoter位于1157bp;TSSW显示Promoter位于1213bp.Promoter 2.0Prediction预测显示Position位于200bp处(Score=0.601)。综上所述,不同预测软件分析表明OsBI-1L-8基因启动子大小为l 258bp.
通过PlantCARE分析pOsBI-1L-8的顺序调控元件,显示该序列含有5种不同类型元件(表1)。第一类是启动子核心顺式作用元件:TATA-box 1个,CAAT-box 11个;第二类是光响应作用元件:ATCT-motifl个,G-box 1个;第三类是缺氧胁迫响应元件:GC-motifl个;第四类是植物激素响应元件:茉莉酸响应相关CGTCA-motif 1个,TGACG-motif2个;脱落酸响应相关ABRE3个;第五类是功能未知的顺式作用元件:ABRE3a 1个,DREcore 1个,Myb 1个,TCA2个,AT~ABRE 1个,Unnamed 413个,WRE31个,as-12个;分析结果表明该序列具有启动子的典型特征。OsBI-1L-8基因可能参与水稻对光信号的响应、缺氧的胁迫应答及激素调控。
2.2pOsBI-1L-8::GUS载体构建
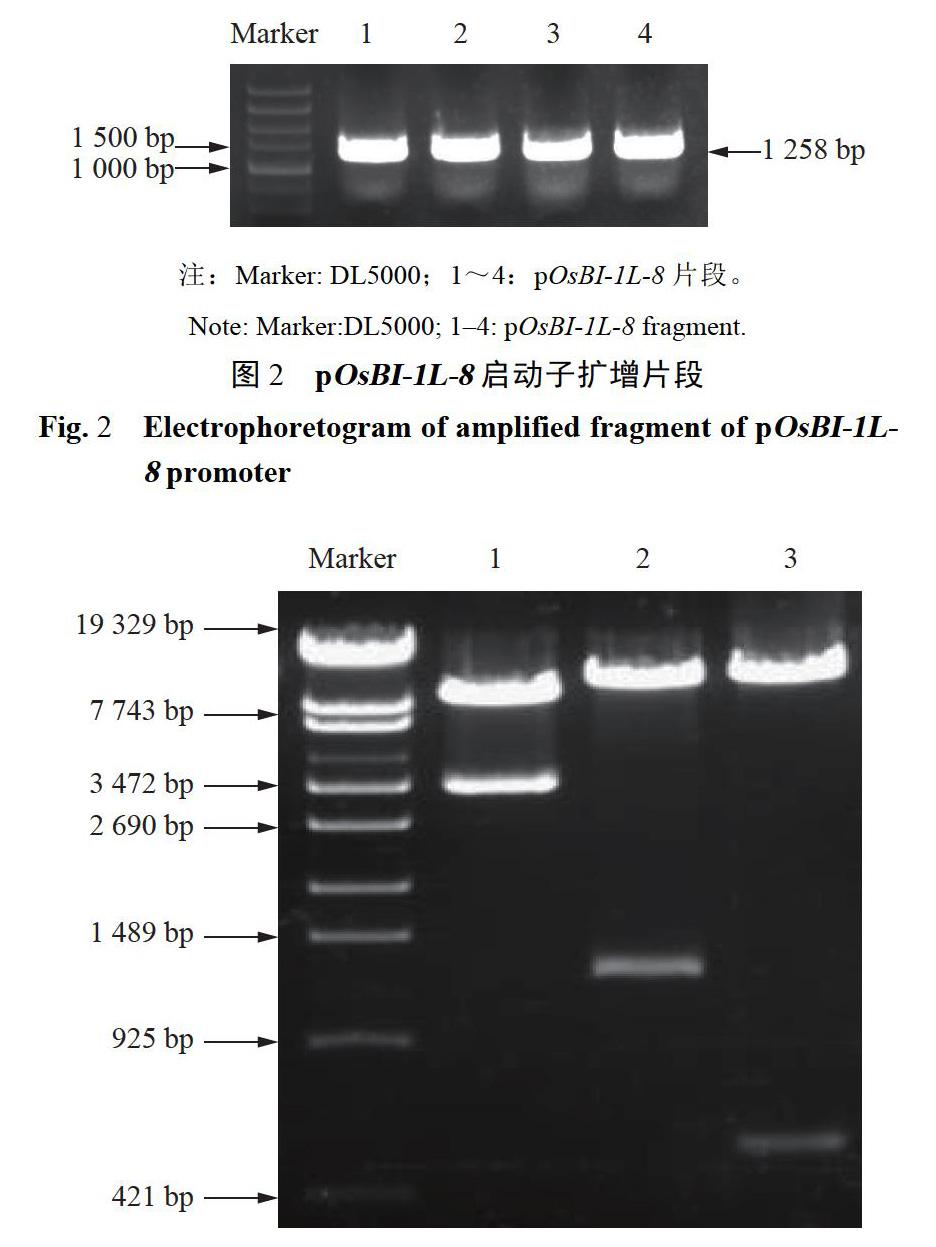
以基因组DNA为模板,用pOsBI-1L-8-F/R扩增pOsBI-1L-8,电泳检测结果显示扩增产物与预期片段大小相符(图2)。扩增产物纯化回收连接至pMDl8-T,挑选经测序比对正确质粒pMDl8T-pOsBI-1L-8.PstI/Nco I双酶切pMDl8T-pOsBI-1L-8及pDMC203质粒,回收连接获得中间载体pDMC203-pOsBI-1L-8.Pst I/EcoR I双酶切中间载体及pCAMBIAl300,产物回收连接转化,PCR筛选阳性质粒,PstUNcoI、PstI/EcoR I双酶切及HindⅢ单酶切鉴定(图3),单双酶切条带大小正确,表明pOsBI-1L-8::GUS表达载体构建成功。
2.3转基因植株筛选
遗传转化获取36个To代转基因水稻植株。CTAB法提取叶片DNA,hpt引物扩增检测,筛获28个阳性植株,均扩增获得与质粒(阳性对照)大小相同片段,阴性对照未扩出片段(图4),表明pOsBI-1L-8::GUS载体成功转入水稻植株。
2.4 启动子表达特征分析
取日本晴(阴性对照)及5个T1代阳性转基因株系苗期的根、茎、叶,抽穗期的根、根茎过渡区、茎、茎结合部位、叶、叶夹角、花穗、小花及灌浆期种子进行GUS组织化学染色分析(图5)。结果显示转基因植株幼苗期根、茎、叶,抽穗期根、茎、叶、叶夹角以及灌浆期种子均未见GUS活性,而在抽穗期的茎结合部位、根茎过渡区以及雄蕊可见明显蓝色,表明OsBI-1L-8启动子具有组织特异型表达模式,推测其下游调控基因OsBI-1L-8可能在水稻生长发育的特定时间特定部位具有重要的作用。
3 讨论
启动子的结构及表达模式分析是开展基因功能研究的有效途径。通过PlantCARE分析OsBI-1L-8启动子结构特征,发现该片段中除含有转录核心元件外,还包含光调控、缺氧胁迫及激素响应等多种类型的顺序调控元件,暗示OsBI-1L-8基因可能参与水稻生长发育、代谢及抗氧胁迫过程。
pOsBI-1L-8驱动GUS基因仅在茎结合部分、根茎过渡区及雄蕊3个部分特异表达,表明该启动子是一个组织特异型启动子。水稻的根茎过渡区及茎结合部分均存在居间分生组织,与水稻的再生能力密切相关;雄蕊的正常发育对于水稻育种和杂交繁殖等至关重要。因此,根据pOsBI-1L-8的组织特异性,可以推测OsBI-1L-8基因可能在水稻的生长发育中起重要作用。Nathalie等通过Northern杂交分析显示甘蓝型油菜及烟草中BI-1基因在衰老的花中增加积累,认为这与细胞程序性死亡(PCD)有关。水稻花药特异启动子Osg6B启动AtBI-1基因在小孢子发育四分体时期表达后导致绒毡层不能正常进入细胞程序性凋亡途径,抑制绒毡层细胞降解,导致花粉完全败育。目前研究发现水稻雄蕊绒毡层细胞的降解是一个细胞程序性死亡的过程,OsBI-1L-8基因是否与其同源基因具有相似功能,参与绒毡层细胞的降解?OsBI-1L-8基因在根茎过渡区和茎结合部分如何参与水稻生长?后续研究将利用CRISPR/CAS9技术敲除及过量表达OsBI-1L-8基因,探讨该基因的生物学功能,以期丰富OsBI-1L家族在水稻生长发育中功能相关研究。

