鸡舍空气中葡萄球菌的分离鉴定及耐药性分析
卢苑青 张腾飞 邵华斌 曾驰

摘要:凝固酶阴性葡萄球菌是广泛存在于自然界中的一种革兰氏阳性条件致病菌,畜禽养殖舍是其病原体传播的一个重要传染源,但其在家禽舍气溶胶中的流行情况和特征并不明确。通过对从家禽养殖舍生物气溶股采集而来的细菌进一步分离鉴定,共获得了 102株凝固酶阴性葡萄球菌(coagulase-negativestaphyolcocci,CoNS),其中松鼠葡萄球菌(41.18%)是最主要的菌种,此外还包括马胃葡萄球菌(21.57%)、腐生葡萄球菌(18.63%)、溶血葡萄球菌(10.78%)、木糖葡萄球菌(5.88%)等。耐药性分析结果显示,分离的葡萄球菌对青霉素、氨苄西林、环丙沙星、氯霉素、红霉素、四环素、克林霉素和苯唑西林均呈现高耐药率。PCR检测结果显示,有36.3%的菌株携带有耐药基因mecA,且均对苯唑西林耐药,而mecA是耐甲氧西林金黄色葡萄球菌(MRSA)的标志耐药基因。
关键词:家禽舍;气溶股;凝固酶阴性葡萄球菌(coagulase-negative staphylccocci,CoNS);耐药性;mecA
中图分类号:S858.31 文献标识码:A
文章编号:0439-8114(2020) 16-0118-04
D0I:10.14088/j.cnki.issn0439-8114.2020.16.026
凝固酶阴性葡萄球菌(coagulase-negative Staph-ylococci,CoNS)是一类条件致病菌,广泛存在于粉尘、土壤、水源和空气中[1]。CoNS可以导致人类和禽类患病,在人群中,它是重要的感染病原体,常可引发心内膜炎或败血症[2,3];在家禽中,CoNS的感染可以引起关节炎、纤维蛋白性睑缘炎及全身性感染。另外,耐甲氧西林的凝固酶阴性葡萄球菌(methicillin-resistant coagulase-negative Staphylococ-ci,MRCoNS)导致鸡肉污染的报道也常有发生,显示出该细菌食源性传播的可能性[4,5]。
有关抗生素的濫用、多重耐药的葡萄球菌报道激增[6],耐药性的增加同样限制了治疗时的药物选择。同时,葡萄球菌广泛存在于如医院、畜牧场等抗生素滥用的地方,从而进一步加剧了细菌对耐药性基因的获取[7,8]。耐甲氧西林的金黄色葡萄球菌(methicillin一resistant Staphylococcus aureus,MRSA)及耐万古霉素的金黄色葡萄球菌(vancomycin-resis-tant S. aureus,VRSA)被大量报道,这些细菌与CoNS携带為相似的基因,如耐甲氧西林的mecA[9]。CoNS因其可在空气中传播的性质,有可能成为这些抗性基因扩散的源头,而这也严重威胁到公共卫生安全。
空气传播是细菌与病毒在家禽养殖舍中传播的重要途径,禽舍空气主要包括细菌、病毒、霉菌以及其组成物如内毒素,这些都是动物和人类感染的潜在致病源。对瑞士12个养殖舍的分析指出,养殖舍中细菌暴露的平均水平在5.3×108个/m3,而其中6.2×107个/m3都是葡萄球菌表明除了动物粪便及污水,鸡舍中空气对动物和人类的健康安全也可造成潜在威胁,是向环境中传播病原体和致病基因的重要途径。在加拿大,肠球菌、大肠杆菌和葡萄球菌是养殖舍中传播最广泛的3个菌群,并在生物气溶胶中发现了很高水平的耐杆菌肽锌、红霉素、四环素的基因[11]。对MRCoNS携带的耐药基因鉴定表明,当人接触了携菌动物时,很有可能被MRCoNS传染从而获得耐药基因存在于葡萄球菌的盒式移动元件SCCmec中,耐甲氧西林的抗性决定簇(即mec决定簇)在葡萄球菌种之间是可自由传播的,广泛分布在金黄色葡萄球菌和CoNS之间[12,13],是导致耐甲氧西林葡萄球菌大量存在的主要原因。本研究探究鸡舍空气中葡萄球菌的流行情况及耐药性情况,为禽舍的养殖提供指导,并以此为基础为下一步验证耐药基因在不同种属葡萄球菌之间的传播性打下基础。
1材料与方法
1.1 菌株
研究所用菌株大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 25923均来自湖北省农业科学研究院畜牧兽医研究所实验室保存。
1.2 试剂与仪器
BioSampler采样器购于美国SKC公司,2×RTaq MasterMix购于北京索莱宝科技有限公司,Muel-ler-Hinton Agar、Mueller-Hinton Broth、Tryptic SoyAgar、Tryptic Soy Broth 购于美国 BD 公司。
1.3方法
1.3.1细菌的培养与鉴定 2017年4月至7月及2018年期间,从华中地区9家鸡舍空气中采集了样品,以监控鸡舍养殖过程中细菌的变化情况。样品的采集时间为换笼期前的最初90 d生长期。根据中国室内空气质量标准(GB/T18883—2002)选取5个均匀分布在鸡舍的采样点采集了生物气溶胶。将气溶胶收集到20 mL PBS溶液中,保存于冰浴中50mL无菌离心管中,然后立即转移到实验室进行分离。使用Tryptic Soy Agar平板对收集到的细菌进行纯化培养,挑选出疑似的葡萄球菌菌落,并使用16 S rRNA序列分析和微生物鉴定系统Phoenix-100进行鉴定。纯化后的菌液与60%甘油1:1混合置于-80℃保存备用。
1.3.2 引物设计与合成 根据Bitrus等[14]的方法设计合成了16SrRNA通用引物及mecA,扩增长度分别为1 500J63 bp。引物由生工生物工程(上海)股份有限公司合成,引物序列分别为:16SF:5'-AGAGTTTGATCCTGGCTCAG-3',16SR:5'GGTTACCTTGTTACGACTT-3';mecAF:5'-ACTGCTATCCACCCTCAAAC-3',mecAR:5'-CTGGTGAAGTTGTAATCTG-3'。
1.3.3 模板制备及PCR扩增 将疑似葡萄球菌划线接种于TSA平板上,37℃过夜培养得到纯化后的单菌落,挑单菌落溶于200 μLddH2O中,煮沸15min后置于冰上15 min,13 000 r/min离心4 min,取上清液作为PCR模板。
PCR反应扩增反应总体系为25 μL,包括:2×Es Taq MasterMix 12.5μL (包括 Es Taq DNA Poly-merase, 2×Es Taq PCR Buffer, 3 mmol/L MgCl2, 400μmol/L dNTP mix),DNA 模板 2 μL,上、下游引物各1 μL,灭菌去离子水8.5 μL。PCR扩增的条件均为94℃预变性 5 min;94 ℃变性 30 s,55 ℃退火 1 min,72℃延伸5min,共35个循环;72℃延伸5min。配置1%琼脂糖凝胶(mecA条带电泳时需配置2%琼脂糖凝胶),取5μLPCR产物加样,140V电压电泳15min,DNA谱带用嗅化乙锭染色,并使用GelDocXR系统(美国Bio-Rad公司)拍照、分析结果。
将16S rRNA PCR产物送至生工生物工程(上海)股份有限公司测序,BLAST验证细菌是否为葡萄球菌;观察163 bp处有无特异性条带出现,若有则可判断该细菌中存在耐药基因mecA。
1.3.4 药物敏感性试验 将分离得到的葡萄球菌使用纸片扩散法或最小抑菌浓度(minimum inhibitoryconcentration,MIC)测定法测试其对不同抗生素的敏感性。根据临床和实验室标准协会(CLSI)的操作要求,将药敏片放置于涂布了葡萄球菌菌液的Mueller-Hinton琼脂(MHA)平板表面,37 ℃下培养24 h。药敏片包括青霉素、氨苄西林、环丙沙星、氯霉素、红霉素、四环素、阿米卡星、利福平和克林霉素。按照CLSI文件测量并分析抑菌圈直径。
对不适合使用药敏片的抗菌药物进行MIC试验,以确定葡萄球菌对苯唑西林(根据CLSI文件,用于确认其对甲氧西林的耐药性)和万古霉素的耐药性,评估浓度为苯唑西林为0.125~128 μg/mL,万古霉素为0.125~6 μg/mL。该试验使用大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 25923菌株作为质控菌株。
2 结果与分析
2.1 细菌种属鉴定分析
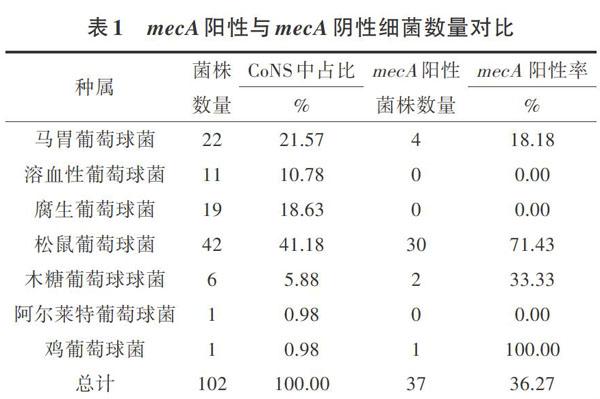
对从鸡舍空气中收集的细菌进行分析,细菌总数随着养殖时间的推移而增加,到后期绝大部分细菌为葡萄球菌。通过16SrRNA分析可知,共有102株凝固酶阴性为葡萄球菌,CoNS是其中的主要属,其结果如表1所示。松鼠葡萄球菌是最主要菌種,占全部CoNS的41.18%,其次是马胃葡萄球菌和腐生葡萄球菌,分别为21.57%及18.63%,除此之外还有溶血葡萄球菌(10.78%)、木糖葡萄球菌(5.88%)、阿尔莱特葡萄球菌(0.98%)、鸡葡萄球菌(0.98%)等。
2.2耐约基因检测结果
通过对102株葡萄球菌耐药基因的扩增鉴定,mecA阳性及阴性结果如表1所示。携带有mecA基因的葡萄球菌共有37株,阳性率为36.27%,其中松鼠葡萄球菌中有71.43%携带有耐药基因,另外在马胃葡萄球菌、木糖葡萄球菌和鸡葡萄球菌中也有mecA的阳性菌株,阳性率分别为18.18%、33.33%、100%。
2.3 葡萄球菌药敏试验结果
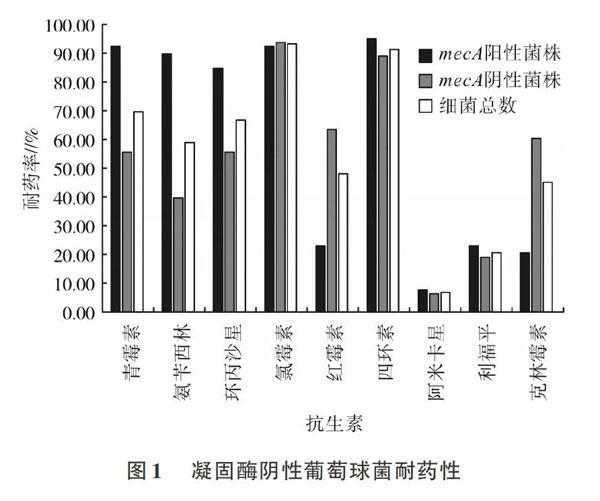
用纸片扩散法检测102株葡萄球菌对9种抗生素的敏感性结果如图1所示。菌株对广泛应用于动物养殖中的抗生素耐药率较高,分别为青霉素(69.61 %)、氨苄西林(58.82%)、环丙沙星(66.67%)、氯霉素(93.14%)、红霉素(48.04%)、四环素(91.18%)和克林霉素(45.10%)。相比之下因在养殖中的应用较少,阿米卡星(6.86%)和利福平(20.59%)的耐药率较低。与mecA阴性菌株相比,mecA阳性菌株对青霉素、氨苄西林和环丙沙星的耐药率较高,对红霉素和克林霉素的耐药率较低。
苯唑西林和万古霉素这两种重要抗生素的敏感性则通过MIC检测(表2),有49.0%菌株苯唑西林的MIC值大于2 μg/mL,40.2%菌株万古霉素的MIC值在4~8 μg/mL,为中等水平;在mecA阳性菌株中,100%的菌株苯唑西林MIC值大于2 μg/mL,而在mecA阴性菌株中只有20%苯唑西林MIC值大于2 μg/mL,与阳性菌株相比有较大差异,阳性菌株对苯唑西林的耐药率较高。
3小结与讨论
从鸡舍空气气溶胶中分离出了102株葡萄球菌,对葡萄球菌进一步鉴定得知,它们都属于凝固酶阴性葡萄球菌。通过对菌株mecA基因的鉴定,36.27%的CoNS携带有抗性基因mecA。由于在养殖过程中抗生素的大量使用,细菌对部分抗生素如氯霉素、四环素、环丙沙星等耐药率较高,而对养殖过程中不常使用的抗生素如阿米卡星和利福平则耐药率较低,针对甲氧西林和万古霉素两种不适用纸片扩散法的药物,MIC试验结果显示,mecA阳性菌株对苯唑西林的MIC值均大于2 μg/mL,明显高于mecA阴性菌株。
近年来,禽类规模化养殖变得越来越普遍,但环境与公共健康问题也随之而来,生物气溶胶是其中重要的一部分。通过跟踪养殖舍不同周期的空气中微生物的含量,发现其浓度随着家禽日龄的增长而增长,其中葡萄球菌这一潜在致病菌显著增加。气溶胶中存在着大量不同种类的细菌,如芽孢杆菌、假单胞菌、大肠杆菌、葡萄球菌及链球菌等,就本研究中葡萄球菌来说,本是一种条件致病菌,但由于近年来抗生素的大量使用,使一部分葡萄球菌获得了耐药性,给禽类养殖及临床用药都带来了一定的影响,随着气溶胶扩散传播,也给在养殖舍工人带了健康威胁。
通过对收集的102株葡萄球菌进一步探究,了解它们的种属,在对其进行药物敏感性试验时,部分菌株表现出了耐药现象,甚至有些菌株为多重耐药菌株,警示对抗生素的使用应更加谨慎。另外,通过PCR技术对有无mecA基因进行的验证显示,有36.3%的葡萄球菌都携带该基因,对苯唑西林亦有耐药性(MIC≥2 μg/mL)。相关文献[15]报道携带有耐药基因的CoNS成为耐药基因的储存库和传播源,以上结果显示,养殖舍气溶胶中的CoNS不仅对养殖业有不利影响,也会威胁公共健康安全,本研究揭示了葡萄球菌在家禽养殖过程中产生的不利影响,由于其传播性,其危害不仅针对禽类,也对鸡舍工人的健康造成威胁。本研究给深入研究家禽养殖过程中CoNS的流行性及耐药性提供依据和基础的同时,也揭示研究其所携带耐药基因传播性的必要性与紧迫性。
參考文献:
[1]WIDERSTROM M, WISTROM J, SJOSTEDT A, et al. Coagulase-negalive staphylococci: Update on the molecular epidemiology andclinical presentation, with a focus on Staphylococcus epidermidisand Staphylococcus saprophyticus [J]. European journal of clinicalmicrobiology & infeclious diseases : Official publication of the Euro-pean society of clinical microbiology, 2012,31 (1) : 7-20.
[2] MENDES R E,SADER H S, CASTANHEIRA M,et al. Distributionof main gram-positive pathogens causing bloodstream infections inUnited Stales and European hospitals during the SENTRY antimi-crobial surveillance program (2010-2016) : Concomitant analysisof orilavancin in vitro acdvity [J]. Journal of chemotherapy,2018,30(5):280-289.
[3] RANJIT E, RAGI-IUBANSHI B R, MASKEY S, et al. Prevalenceof bacterial vaginosis and its association with risk factors among non-pregnant women: A hospital based study [J].International jurnal ofmicrobiology ,2018,2018: PMC 5859802.
[4] BHARGAVA K,ZHANG Y. Characlerization of methicillin-resis-tant coagulase-negative Staphylococci(MRCoNS) in retail meal.[J].Food microbiology ,2014,42: 56-60.
[5] AWAN M A, MATSUMOTO M. Heterogeneity of Staphylococci andother bacteria isolated from six—week-old broiler chickens. [J].Poul-try science, 1998,77(7):944-949.
[6] POURAKBARI B, MAHMOUDI S, MORADZADEH M, et al. An-timicrobial resistance patterns of the gram-posilive bacteria isolatedfrom children with bloodstream infection in an Iranian referral hos-pital: A 6-year study [J]. Infectious disorders drug targets, 2018,18(2):136-144.
[7] ZLATIAN 0, BALASOIU A T, BALASOIU M, et al. Antimicrobialresistance in bacterial pathogens among hospitalised patients withSevere Invasive Infections [J]. Experimental and therapeutic medi-cine 2018, 16(6):4499-4510.
[8] PIESSENS V, VAN COILLIE E, VERBIST B, et al. Distribution ofcoagulase-negalive Staphylococcus species from milk and environ-ment of dairy cows differs between herds [J]. Journal of dairy sci-ence,2011,94(6):2933-2944.
[9] LAKHUNDI S,ZHANG K. Methicillin-resistant Staphylococcus au-reus: Molecular characterization, evolution,and epidemiology [J].Clinical microbiology reviews, DOI :10.1128/CMR.00020-18.
[10]OPPLIGER A,CHARRIERE N,DR0Z P0,et al. Exposure to bio-aerosols in poultry houses at different stages of fattening; Use ofReal—Time PCR for airborne bacterial quantification [J]. The an-nals of occupalional hygiene ,2008 , 52( 5) :405 -412.
[11]JUST N A, LETOURNEAU V, KIRYCHUK SP, et al. Potentiallypalhogenic bacteria and antimicrobial resistance in bioaerosolsfrom cage—housed and floor-housecl poultry operations[J].The an-nals of occupational hygiene , 2012 , 56( 4): 440-449.
[12]HURLIMANN-DALEI R L, RYFFEL C,KAYSER F H,et al. Sur-vey of the methicillin resistance-associated genes mecA,mecRI-mecl,and femA-femB in clinical isolales of methicillin-resistantStaphylococcus aureus antimicroh [J] .Agents chemother, 1992,36:2617-2621.
[13]SUZUKI E, HIRAMATSU K, YOKOTA T. Survey of methicillin-resistant clinical strains of coagulase-negative Staphylococci formecA gene distribution [J]. Anlimicrob agents chemother, 1992,36:429-434.
[14]BITRUS A A, ZUNITA Z, BEJO S K, et al. In vitro transfer ofmethicillin resistance determinants mecA from methicillin resistantStaphylococcus aureus (MRS A) lo methicillin susceptible Staphylo-coccus aureus (MSSA) [J].BMC Microbiology,2017,17(1) :83.
[15]LIU P L, WU Z W, XUE H P, et al. Antibiotics trigger initiationof SCCmec transfer by inducing SOS responses [J]. Nucleic acidsresearch ,2017,45(7): 3944-3952.
收稿日期:2020-01-14
基金項目:现代农业产业技术体系资助项目(nycytx-41-G13)
作者简介:卢苑青(1994-),女,山东东营人,在读硕士研究生,研究方向为禽细菌病的流行病学,(电话)17671647921 (电子信箱)wanylu@out-look.com;通信作者,张腾飞,副研究员,(电子信箱)tfzhang23@ 163.com。

