神经电生理监测下神经显微减压术治疗糖尿病性下肢周围神经病
郭永坤 谢井伟 单峤 武跃辉 袁小威 王振 鲁小丽 孙楹 王新军
一、背景知识
糖尿病性周围神经病(diabetic peripheral neuropathy,DPN)是最为常见的糖尿病性神经病变,发生率高达60%,其中下肢病变最为常见[1]。下肢周围神经病主要表现为双侧肢体末端的疼痛、麻木和感觉缺失等感觉功能障碍以及运动功能障碍,严重者可导致肢体的溃疡、截肢等严重并发症。随着人们生活水平的不断提高,糖尿病的发病率不断增高,糖尿病性下肢周围神经病也逐渐增多,其并发症对患者身体和心理造成较大伤害,加重社会负担。
目前DPN 的发病机制尚不明确,传统观点认为,DPN 以高血糖为始动因素,引起神经微循环障碍,造成神经缺血缺氧,导致神经病变、功能障碍[2]。DPN 以往被认为是进展性、不可逆性的周围神经疾病。美国霍普金斯大学神经外科Dellon 教授研究发现,当病变肿胀的神经通过肢体的解剖狭窄部位时,周围组织对其产生机械性卡压,导致神经卡压从而产生临床症状。基于此提出卡压学说,且已得到国内外同行的广泛认可[3]。
DPN 的临床诊断并不困难,主要依据病史和典型周围神经病变表现。神经电生理检查是诊断周围神经卡压的一种重要技术,神经传导速度、潜伏期、波幅是电生理检查的常用指标,能够反应周围神经电信号的传递功能,具有客观、量化、可靠等优点,也是术中监测和鉴别神经、术后随访和疗效评估的重要手段[4]。
糖尿病性代谢异常而导致下肢周围神经受到腓总神经管、内踝跗管等处生理狭窄卡压,是DPN 的重要致病因素,因此解除机械性卡压是治疗DPN 的重要手段。临床内科治疗常以控制血糖、对症治疗、营养神经等方法为主,缺乏特异性有效治疗,而糖尿病周围神经显微减压术有着很好的疗效,能有效防止肢体感染、坏疽,降低截肢率[5-8]。
二、适应证及禁忌证
适应证[2]:(1)所有神经症状必须因糖尿病引起,排除颈椎、腰椎等疾病史,排除其他全身性疾病所引起的神经病变,排除下肢血管疾病;(2)具有典型周围神经病变症状:如疼痛、麻木、感觉迟钝、温度觉和振动觉异常等;(3)内踝部胫后神经走行处Tinel 征阳性;(4)术前2 周空腹血糖控制于8 mmol/L 以下;(5)患者积极要求手术治疗;(6)患者一般情况良好,可耐受手术。
禁忌证:(1)不能耐受手术;(2)患者或家属对手术方式、疗效及可能的并发症不理解。
三、典型病例
男性,59 岁,糖尿病病史8 年,平时血糖控制不佳,以“双足疼痛麻木6 个月”入神经外科。6 个月前无明显诱因出现双足麻木伴肿胀,针扎样疼痛,多于休息时出现,无足底踩棉花感,无间歇性跛行,曾行营养神经、改善循环等治疗,效果欠佳,后上述症状逐渐加重,并逐渐影响夜间睡眠。神经系统体检:神志清,双侧瞳孔等大等圆,直径2.5 mm,光反射灵敏。四肢肌力及肌张力正常,双足温痛觉减退,深感觉正常。双下肢肌电图检查:双侧腓总神经运动神经传导速度减慢,波幅降低,双侧胫神经运动传导速度减慢,波幅降低。双侧显微镜下腓总、腓深和胫后神经显微减压术后患者双足麻木疼痛感逐渐消失,睡眠明显改善,术后6 个月双足麻木疼痛感消失,睡眠良好。
四、手术步骤
1.采用仰卧位,依次行双侧下肢腓总神经、腓深神经、胫后神经显微神经减压术。
2.腓总神经显微减压[9]:患者术侧屈膝90°,于腓骨小头下方2 cm 处行长约4 cm 弧形切口,逐层切开皮肤、皮下组织、浅筋膜,游离出腓总神经,然后向前方分离出腓骨长肌肌腱,于肌腱卡压处切断部分腓骨长肌肌腱,双极电凝器严格止血,缝合关闭切口。
3.腓深神经显微减压[9]:患者于足背第l、2 趾间行纵切口,逐层切开皮肤、皮下组织,分离浅筋膜和拇短伸肌,在远端切断该肌腱(图1A),减压腓深神经,松解其周围组织,双极电凝器严格止血,缝合关闭切口。
4.胫后神经显微减压[9]:患者一侧大腿外展,屈膝45°,沿内踝跗管胫后神经走行弧形切口,逐层切开皮肤、皮下组织,切断屈肌支持带,分离拇展肌浅筋膜,显露胫后神经主干及其三个分支(足跟神经、足底外侧神经及足底内侧神经),分别松解减压主干及分支各自的神经管,双极电凝器严格止血,缝合关闭切口。
5.术中电生理监测:当手术接近神经或不能鉴别是否是神经组织时,给予5 mA 电流刺激(图1B),观察神经支配的肌肉的电反应,如监测的肌肉有反应,这时提醒术者小心操作,避免神经损伤。术中电生理监测,对术中减少神经损伤、提高初学者开展减压手术安全等方面有独特的优势。
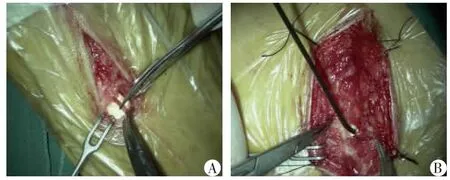
图1 术中神经减压与神经电生理监测
五、术后常规处理
术后控制好血糖,促进伤口愈合,及时切口换药,预防感染。术后常规2 周以后复查神经电生理,评估手术减压后神经恢复效果。
利益冲突所有作者均声明不存在利益冲突

