钻井液特征污染物的毒性评估和海洋测试生物的适用性比较
刘卫丽, 余露军, 李建军, 陈小曲, 张 磊
钻井液特征污染物的毒性评估和海洋测试生物的适用性比较
刘卫丽1, 余露军2, 李建军2, 陈小曲2, 张 磊3
(1. 中海油田服务股份有限公司, 天津 300450; 2. 广东省实验动物监测所 广东省实验动物重点实验室, 广东 广州 510663; 3. 北京天泰志远科技股份有限公司, 北京 100020)
随着海上钻井数量的逐年增加、钻井液的使用量迅速增加, 与之相关的环境危害引起了广泛关注, 因此有必要筛选合适的毒性测试生物和开发环境友好的钻井液。本研究中, 按照ISO11348-1(2007)、GB/T21805-2008和GB/T18420.2-2009的毒性测试方法, 采用标准的海洋测试生物: 发光细菌()、牟氏角毛藻()、诸氏鲻虾虎鱼()、凡纳滨对虾()、卤虫(Artemia)、蒙古裸腹溞(), 研究了钻井废液特征污染物(苯酚、七水硫酸锌、氯化汞)以及参比毒物十二烷基硫酸钠(Sodium dodecyl sulfate, SDS)的急性毒性效应。结果表明, 钻井液特征污染物对6种海洋生物的急性毒性效应有所不同: Hg2+对海洋生物表现为极高毒性, Zn2+、SDS表现为中、高毒性, 苯酚表现为中、低毒性; 6种海洋生物对4种特征污染物的敏感性顺序为: 蒙古裸腹溞>诸氏鲻虾虎鱼>卤虫>凡纳滨对虾>发光细菌>牟氏角毛藻; 诸氏鲻虾虎鱼与卤虫、凡纳滨对虾种间毒性相关性显著, 蒙古裸腹溞与发光细菌、凡纳滨对虾种间毒性相关性显著。上述研究结果为环保型海洋钻井液开发和钻井废液生物毒性评价中受试生物的选择提供了基础数据。
钻井废液; 急性毒性; 测试生物
海洋经济已成为中国经济发展的重要组成部分, 随着中国海上石油开采量的逐年增加, 每年大量钻井废液排入海洋, 废弃钻井液、生产水等造成的环境污染问题已引起广泛重视[1]。钻井废液中重金属等多种有毒有害物质在海洋生物体内蓄积[2], 并沿食物链转移, 从而扰乱物种的繁殖、改变生物种群结构, 对海洋生态系统造成难以逆转的危害[3, 4]。Hg是全球最受关注的环境污染物之一, 在油田废弃钻井液中存在不同程度的Hg污染问题[5, 6], 中国海洋石油勘探开发污染物排放浓度限值标准中也对水基钻井液和钻屑中重晶石中的Hg含量给予明确规定[7]。Zn、苯酚分别是钻井废液中浓度较高的重金属和酚类化合物主要组分[8, 9], 也是平台附近海域沉积物中重要的污染物之一[2]。十二烷基硫酸钠(Sodium dodecyl sulfate, SDS)是常用的阴离子表面活性剂, 作为一种新型污染物广泛存在于海洋环境中, 同时也为美国试验材料协会(ASTM)推荐的生物毒性试验常用标准毒物之一[10]。研究上述污染物的生物毒性, 对于完善海洋钻井废液排放标准、海洋生态环境的风险评估具有重要意义。
为了保护水生生态系统, 美国环保局要求水环境污染物生物毒性至少使用2种以上不同营养级的实验生物进行测试评价[11]。发光细菌()是ISO11348-1(2007)推荐的受试生物, 因其操作便利、反应迅速等优点广泛应用于工农业废水等污染物毒性测试[12]; 蒙古裸腹溞()、卤虫(Artemia)、凡纳滨对虾()、诸氏鲻虾虎鱼()是GB/T 18420.2-2009推荐的受试生物, 适用于海洋石油开发污染物毒性评价[13]; 牟氏角毛藻()是一种易培养、无贴壁的海洋硅藻, 适用于化学品的毒性评价[14]。上述标准推荐的实验生物是中国海洋环境不同生态位的代表性种类, 但适用范围各有侧重。
为了评估不同标准推荐生物对复杂体系的钻井废液毒性测试的适用性, 筛选钻井废液毒性测试合适的实验生物, 作者以Hg2+、Zn2+、苯酚以及SDS为特征污染物, 研究其对6种海洋生物的急性毒性效应, 并分析了不同生物间的生物毒性敏感性和相关性, 为中国海洋环境生态风险评价及生态毒理学研究提供基础数据。
1 材料与方法
1.1 受试物质
七水硫酸锌(ZnSO4∙7H2O)、氯化汞(HgCl2)、十二烷基硫酸钠、苯酚均为分析纯试剂。
1.2 实验生物
发光细菌(费氏弧菌)由国家海洋局第一海洋研究所崔志松博士惠赠, –80℃保存; 牟氏角毛藻、蒙古裸腹溞、卤虫、凡纳滨对虾、诸氏鲻虾虎鱼为广东省实验动物监测所省实验动物重点实验室保种、培育。
1.3 试验方法
1.3.1 发光细菌毒性试验
费氏弧菌在2216E培养基、20℃、180 r/min培养30 h的新鲜菌液, 菌浓度OD600>1.6(分光光度计UV1800, 岛津公司), 初始发光强度>4×106(生物发光检测仪Tecan Spark 10M TM, 瑞士帝肯公司)[15]。试验操作参照ISO 11348-1(2007)的方法进行: 根据预实验结果, 各污染物分别设置5个浓度梯度和1个空白对照组, 每个试验组设置3个平行; 2%氯化钠溶液为稀释水, 稀释水和样品溶液在15±1℃预冷后, 分别取20 μL加入96 孔板(白色不透明), 立即测定初始发光强度I0; 在各反应孔分别加入180 μL不同浓度的试验溶液, 对照组加入稀释水, 立即置于15℃±1℃恒温孵育; 暴露15 min后, 测定各反应孔最终发光强度It; 发光抑制率按ISO 11348-1(2007)的公式(1)~(6)计算。
1.3.2 藻类生长抑制试验
牟氏角毛藻在T2藻类培养基、25℃±2℃培养2~4 d, 藻密度>1×106cells/mL。试验操作按照GB/T 21805-2008方法进行: 采用150 mL的三角瓶, 测试溶液体积为40 mL; 选择对数生长期的藻液, 各试验溶液中初始藻液浓度5×104cells/mL(藻类培养液为稀释液); 根据预实验结果, 各污染物分别设置5个浓度梯度和1个空白对照组, 每个试验组设置3个平行; 在3 000 Lx、24±1℃条件下暴露72 h, 采用血球计数板进行计数; 藻类比生长抑制率按照GB/T 21805-2008的公式(1)~(2)计算。
1.3.3 诸氏鲻虾虎鱼、凡纳滨对虾、卤虫、蒙古裸腹溞毒性试验
诸氏鲻虾虎鱼为实验室培育的封闭群, 养殖条件为23~27℃、盐度25~32、pH 7.6~8.2, 虾虎鱼10日龄仔鱼用于试验, 孵化和仔鱼培育条件为25~30℃、盐度20~30。卤虫无节幼体为22~27℃、盐度30~35、光照强度3 000 Lx条件下孵化20~24 h后收集使用。蒙古裸腹溞培育条件为22~27℃、盐度26~30, 一龄幼虫用于试验。凡纳滨对虾10日龄幼体用于试验, 实验室23~30℃、盐度 8~28、pH 8.0~8.3条件下暂养48 h以上。
试验操作按照GB/T 18420.2-2009进行: 根据预实验结果, 各污染物分别设置5个浓度组和1个对照组, 每个浓度组4个重复, 每个试验容器10个实验生物; 采用静态试验方法, 在23~28℃, 盐度20~35, pH 7.6~8.6条件下暴露96 h, 试验结束时记录生物死亡数量。
1.4 数据分析
发光细菌EC50、牟氏角毛藻生长抑制EC50以及诸氏鲻虾虎鱼、凡纳滨对虾、卤虫、蒙古裸腹溞半数致死浓度LC50分别按照ISO11348-1(2007)、GB/T 21805-2008和GB/T 18420.2-2009的方法进行计算。不同生物毒性结果采用SPSS 13.0进行相关性分析。
2 结果
2.1 4种特征污染物对6种海洋生物的急性毒性
4种特征污染物(苯酚、七水硫酸锌、SDS、氯化汞)对6种海洋生物的急性毒性试验结果见表1, 毒性测试数据拟合方程相关系数为0.87~0.99, 6种海洋生物对特征污染物的毒性效应呈显著的剂量-效应关系(<0.05)。结果显示, 苯酚对6种海洋生物的毒性大小依次为: 蒙古裸腹溞>诸氏鲻虾虎鱼>卤虫>凡纳滨对虾>发光细菌>牟氏角毛藻; Zn2+对6种海洋生物的毒性大小依次为: 蒙古裸腹溞>发光细菌>凡纳滨对虾>牟氏角毛藻>诸氏鲻虾虎鱼>卤虫; SDS对6种海洋生物的毒性大小依次为: 诸氏鲻虾虎鱼>卤虫>凡纳滨对虾>牟氏角毛藻>蒙古裸腹溞>发光细菌; Hg2+对6种海洋生物的毒性大小依次为: 蒙古裸腹溞>诸氏鲻虾虎鱼>卤虫>发光细菌>牟氏角毛藻>凡纳滨对虾。
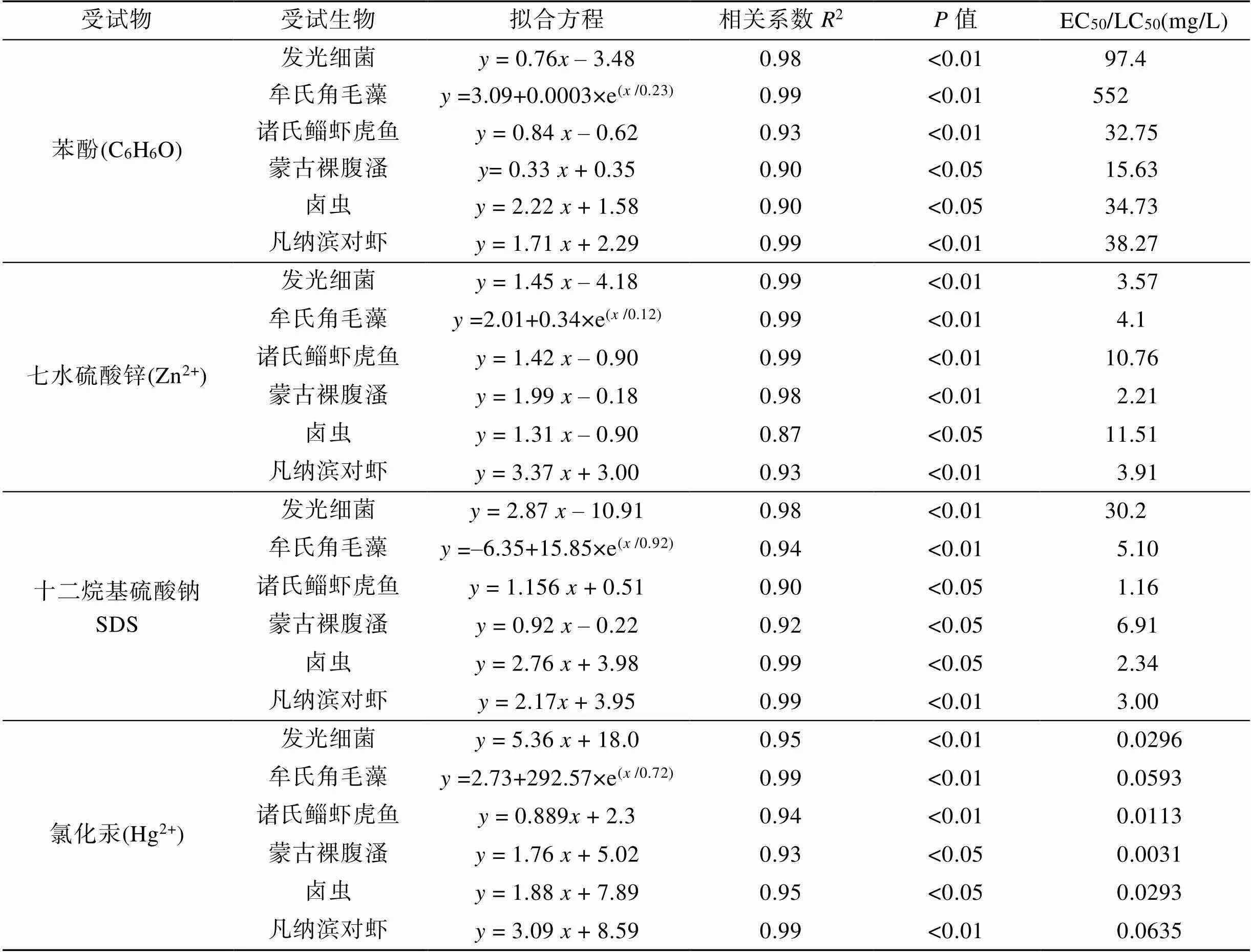
表1 4种特征污染物对6种海洋生物的急性毒性
2.2 4种特征污染物对6种海洋生物的毒性分级
参照HJ/T 154-2004[16]生态毒理学危害性分级标准, 水生生物急性毒性LC50/EC50(mg/L)≤1为极高危害, 1~10为高危害, 10~100为中危害, >100为低危害, Hg2+对6种海洋生物LC50/EC50为0.003 1 mg/L~ 0.063 5 mg/L, 表现为极高毒性; SDS对6种海洋生物LC50/EC50为1.16 mg/L~30.2 mg/L, Zn2+对6种海洋生物LC50/EC50为2.21 mg/L~11.51 mg/L, 表现为中、高毒性; 苯酚对6种海洋生物LC50/EC50为15.63 mg/L~ 552 mg/L, 表现为中、低毒性。4种污染物对发光细菌、牟氏角毛藻、蒙古裸腹溞毒性大小依次为: Hg2+> Zn2+>SDS>苯酚; 对诸氏鲻虾虎鱼、卤虫、凡纳滨对虾毒性大小依次为: Hg2+>SDS >Zn2+>苯酚。上述结果表明, 环境友好型钻井液应严格限制含Hg2+组分的添加量。
2.3 6种海洋生物毒性敏感性比较
根据4种特征污染物对6种海洋生物的生物毒性试验结果, 分别按生物对污染物的LC50或EC50进行排序, 统计各生物的排序频次(表2); 排名1~6对应赋分值为1~6积分, 以各生物在本次测试中的平均积分(排名频次×排名积分/总数)来比较不同生态位生物的毒性敏感性。由表2可知, 诸氏鲻虾虎鱼、蒙古裸腹溞、卤虫、凡纳滨对虾、牟氏角毛藻、发光细菌的平均积分分别为2.5、2.0、3.5、4.0、4.75、4.25, 故6种海洋生物对苯酚、Zn2+、SDS、Hg2+的敏感性顺序为: 蒙古裸腹溞>诸氏鲻虾虎鱼>卤虫>凡纳滨对虾>发光细菌>牟氏角毛藻。
2.4 6种海洋生物毒性相关性分析
将4种特征污染物对6种海洋生物的试验数据取以10为底的对数, 采用spss13.0软件进行Pearson相关分析(双变量, 双尾), 结果见表3。结果显示, 发光细菌与蒙古裸腹溞以及诸氏鲻虾虎鱼与卤虫生物间毒性数据相关性极显著(<0.01); 发光细菌与卤虫以及凡纳滨对虾与5种生物间毒性数据相关性显著(<0.05); 其余生物间毒性数据相关性不显著(>0.05)。
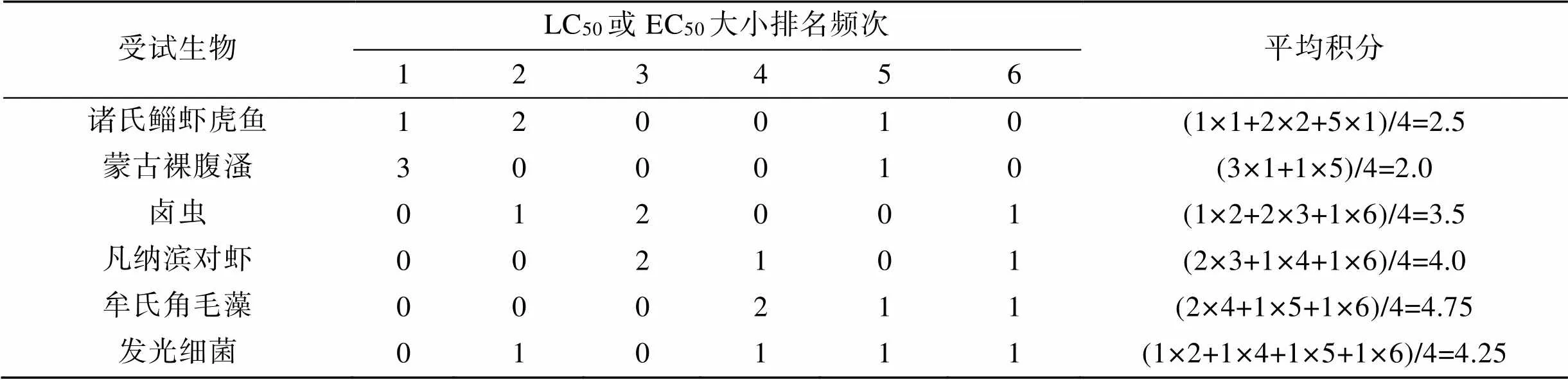
表2 6种海洋生物对4种特征污染物的敏感性比较
注: 生物毒性平均积分=各名次积分×该生物获得该名次的频次/有效数据个数, 积分越小表明敏感性越高
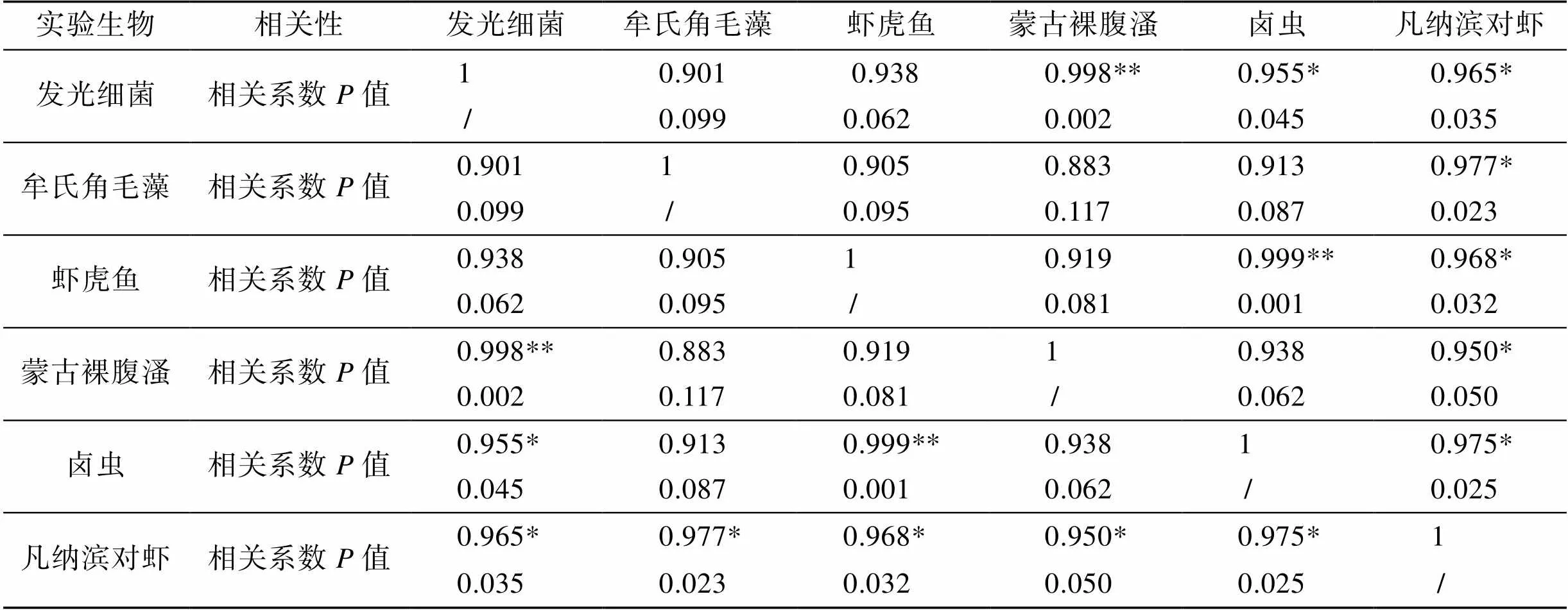
表3 4种特征污染物对6种海洋生物毒性的相关性分析
注: “**”. 相关性极显著(<0.01); “*”. 相关性显著(<0.05); “/”. 表示未比较
3 讨论
理想的指示生物通常应具有对污染物的敏感性和重复性好、本地生态位代表性强、来源方便、易质量控制等特征[17]。而实验生物的环境本底、养殖条件、生理状态直接影响毒性试验结果的准确性和可重复性, 美国环保局规定只有实验室严格控制培养条件的生物才能用于毒性测试[11]。本试验采用的实验生物是中国海洋不同生态位的代表种类, 已广泛应用于海洋环境生物毒性评价研究[18-20], 其中诸氏鲻虾虎鱼、蒙古裸腹溞、费氏弧菌()、牟氏角毛藻、卤虫均为中国本土生物, 且为实验室内全人工繁殖或稳定培育传代, 遗传背景清晰、环境本底一致, 便于数据比较和交流, 为中国海洋钻井废液排放标准的完善积累了本土生物毒性数据。
目前, 国内外通常基于实验室内大量受试生物的毒性测试数据来评估污染物对整个生态系统的影响和危害水平, 且推荐使用本土物种的毒性数据[21-22]。本研究结果显示, Hg2+对牟氏角毛藻的72 h EC50为0.059 3 mg/L, 与战玉杰[23]等海洋硅藻毒性结果接近(旋链角毛藻(), 96 h EC50为0.042 mg/L), 高于国外海洋硅藻毒性结果(布氏双尾藻(), 5 d EC50为0.01 mg/L) (https:// cfpub. epa.gov/ecotox); Zn2+对费氏弧菌的15 min EC50为3.57 mg/L, 对卤虫的96 h LC50为11.51 mg/L, 而国外学者研究Zn2+对费氏弧菌的15 min EC50为26 mg/L[12], 对卤虫的72 h EC50为37 mg/L(https://cfpub.epa.gov/ ecotox),表明中国海洋生物毒性敏感性与国外物种的敏感性存在一定差异, 这与李会仙[17]等研究结果相似, 进一步为中国本地物种毒性数据的重要性提供了理论支持。
对水环境污染物生物毒性评价, 欧美等发达国家要求至少使用3个不同营养级的受试物种, 以确定最敏感的物种。本试验选用的实验生物涵盖了单细胞藻类(生产者)、无脊椎动物甲壳类(初级消费者)以及脊椎动物鱼类(次级消费者)以及细菌(分解者), 可探讨多生态位海洋生物对污染物的毒性敏感性。由于细菌、藻类与其他水生动物对污染物的毒性反馈机制不同, 直接进行毒性效应可比性不足, 而基于污染物对生物的毒性大小分级赋分, 并以此为依据进行积分值比较是综合评价不同生物敏感性的一种简单、常用的方法[16, 24]。本研究中, 蒙古裸腹溞对4种特征污染物敏感性综合评价积分值最低(2.0分), 为最敏感种类; 其次为诸氏鲻虾虎鱼(2.5分); 牟氏角毛藻积分值最高(4.75分), 为最不敏感种类。王颖[20]等研究结果显示, 4种水生动物对消油剂的敏感性顺序为蒙古裸腹溞>虾虎鱼>卤虫>凡纳滨对虾; Li[25]等研究表明, 6种水生生物对钻井液组分敏感性顺序为虾虎鱼>蒙古裸腹溞>卤虫>凡纳滨对虾>牟氏角毛藻>费氏弧菌, 上述结果与本试验敏感性规律相似。
理论上, 采用不同生态位代表性实验生物种类越多, 越能全面客观地反应污染物对水生生态系统的综合毒性影响, 但毒性评价工作量和成本也将随之增加。不同物种间毒性相关性研究有助于以一种生物的毒性预测其他多种生物的毒性, 便于整体评价污染物对不同生态位生物的毒性水平, 因此虽然物种间生物组织结构和污染物毒性作用机制存在差异, 但仍有许多学者探讨了不同物种间的相关性关系[26-27]。本研究中, 诸氏鲻虾虎鱼与卤虫、凡纳滨对虾毒性数据相关性显著(<0.05), 与发光细菌的毒性数据种间相关性不显著(sig=0.062)。王东[28]等研究表明, 钻井液毒性评价时, 发光细菌与糠虾()毒性相关系数仅为0.3; 冯晓娜[29]等研究显示, 有机化合物对发光菌和鱼的毒性呈正相关, 但种间相关性较差, 上述结果与本研究一致; 蒙古裸腹溞与发光细菌、凡纳滨对虾毒性数据相关性显著(<0.05), 与藻类的毒性数据种间相关性不显著(=0.117), 与Zhang[30]等研究结果类似。因此, 综合生物的生态地位、毒性敏感性以及物种间的相关性考虑, 蒙古裸腹溞和诸氏鲻虾虎鱼是较为理想的钻井废液生物毒性综合评价受试生物。
4 结论
4种特征污染物(苯酚、七水硫酸锌、SDS、氯化汞)对6种海洋生物具有不同程度的毒性作用, 其中Hg2+对6种海洋生物表现为极高毒性, 环保型钻井液应严格限制含Hg2+添加剂的使用。6种海洋生物对4种特征污染物的敏感性顺序为: 蒙古裸腹溞>诸氏鲻虾虎鱼>卤虫>凡纳滨对虾>发光细菌>牟氏角毛藻; 诸氏鲻虾虎鱼与卤虫、凡纳滨对虾种间毒性相关性显著, 蒙古裸腹溞与发光细菌、凡纳滨对虾种间毒性相关性显著。综合测试生物的生态地位、毒性敏感性以及物种间的相关性考虑, 诸氏鲻虾虎鱼和蒙古裸腹溞是海洋钻井废液理想的生物毒性综合评价受试生物。以上研究结果为中国海洋钻井废液排放标准的完善积累了本土生物毒性数据。
[1] 刘选, 张永强. 钻井泥浆和钻屑对海洋环境的影响及管理对策研究[J]. 海洋开发与管理, 2014, 31(10): 71-77. Liu Xuan, Zhang Yongqiang. Study on the influence and management countermeasures of drilling mud and drilling chip on marine environment[J]. Ocean Development and Management, 2014, 31(10): 71-77.
[2] 卢芳. 胜利埕岛油田海洋石油勘探开发生态环境影响研究[D]. 青岛: 中国海洋大学, 2010. Lu Fang. Study on ecological environmental impact of offshore oil exploration and exploitation in ShengliIsland Oilfield[D]. Qingdao: Ocean University of China, 2010.
[3] 马媛, 高振会, 杨应斌, 等. 海上石油开采导致生态环境变化实例研究[J]. 海洋学报(中文版), 2005, 5: 54-59.Ma Yuan, Gao Zhenhui, Yang Yingbin, et al. Eco- environment changes in the Chengbei Oil Field due to the marine petroleum exploration[J]. Acta Oceanologica Sinica, 2005, 5: 54-59.
[4] Trannum H C, Nilsson H C, Schaanning M, et al. Effects of sedimentation from water-based drill cuttings and natural sediment on benthic macrofaunal community structure and ecosystem processes[J]. Journal of Experimental Marine Biology and Ecology, 2010, 383(2): 111-121.
[5] 王蓉沙, 邓皓, 谢水祥, 等. 油气田废弃钻井液对生态环境的影响评价研究[J]. 石油天然气学报, 2009, 31(2): 152-156. Wang Rongsha, Deng Hao, Xie Shuixiang, et al. The influence of abandoned drilling fluid in oil-gas field on ecological environment[J]. Journal of Oil and Gas Technology, 2009, 31(2): 152-156.
[6] Breuer E, Stevenson A G, Howe J A, et al. Drill cutting accumulations in the Northern and Central North Sea: a review of environmental interactions and chemical fate[J]. Marine Pollution Bulletin, 2004, 48(1): 12-25.
[7] 中华人民共和国国家质量监督检验检疫总局. GB 4914-2008. 海洋石油勘探开发污染物排放浓度限制[S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. GB 4914-2008. Limitation of Pollutant Emission Concentration in Offshore Oil Exploration and Development[S]. Beijing: Standards Press of China, 2009.
[8] Kumiko A S, Gary P Y, Wohlgeschaffen G, et al. Precipitation of heavy metals in produced water: Influence on contaminant transport and toxicity[J]. Marine Environmental Research, 2007, 63(2): 146-167.
[9] Bakke T, Klungsoyr J, Sanni S, et al. Environmental impacts of produced water and drilling waste discharges from the Norwegian offshore petroleum industry[J]. Marine Environmental Research, 2013, 10(2): 154-169.
[10] ASTM. Annual Book of ASTM[M]. Philadelpia P A: American Society for Testing and Materials, 1988.
[11] Society of Environmental toxicology and chemistry. whole effluent toxicity testing.[EB/OL]. USA: SETAC, 2004. https://cdn.ymaws.com/www.setac.org/resource/ resmgr/publications_and_resources/tip-ion.pdf.
[12] International Organization for Standardization. ISO11348-1 (2007). Water Quality - Determination of the Inhibitory Effect of Water Samples on the Light Emission of(Luminescent bacteria test) - Part 1: Method using freshly prepared bacteria[S]. Switzerland: IHS, 2007.
[13] 中华人民共和国国家质量监督检验检疫总局. GB/T 18420.2-2009.《海洋石油勘探开发污染物生物毒性第2部分: 检验方法》[S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. GB/T 18420.2-2009. Biological Toxicity of Pollutants for Exploration and Exploitation of Marine Petroleum - Part 2: Methods of inspection[S]. Beijing: Standards Press of China, 2009.
[14] 中华人民共和国国家质量监督检验检疫总局. GB/T 21805-2008.《化学品藻类生长抑制试验》[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. GB/T 21805-2008. Chemical Algal Growth Inhibition Test[S]. Beijing: Standards Press of China, 2008.
[15] 余露军, 刘卫丽, 陈小曲, 等. 费氏弧菌急性毒性微孔板检测方法优化[J]. 广东农业科学, 2017, 44(7): 76-82. Yu Lujun, Liu Weili, Chen Xiaoqu, et al. Optimization of the acute toxicity test method using microplate for bibrio fischeri[J]. Guangdong Agricultural Sciences, 2017, 44(7): 76-82.
[16] 国家环境保护总局. HJ/T 154-2004. 新化学物质危害评估导则[S]. 北京: 中国环境科学出版社, 2004. State Environmental Protection Administration. HJ/T 154-2004. The Guldelines for the Hazard Evaluation of New Chemical Substances[S]. Beijing: China Environmental Science Press, 2004.
[17] 李会仙, 张瑞卿, 吴丰昌, 等. 中美淡水生物区系中汞物种敏感度分布比较[J]. 环境科学学报, 2012, 32(5): 1183-1191. Li Huixian, Zhang Ruiqing, Wu Fengchang, et al. Comparison of mercury species sensitivity distributions of freshwater biota in China and the United States[J]. Acta Scientiae Circumstantiae, 2012, 32(5): 1183-1191.
[18] Guo Z, Gao N, Wu Y, et al. The simultaneous uptake of dietary and waterborne Cd in gastrointestinal tracts of marine yellowstripe goby[J]. Environmental Pollution, 2017, 12(7): 31-41.
[19] Anu P R, Nandan S B, Jayachandran P R, et al. Toxicity effects of copper on the marine diatom,[J]. Regional Studies in Marine Science, 2016, 7(1): 498-504.
[20] 王颖, 孙丽萍, 魏社林, 等. 四种水生动物对GM-2消油剂的急性毒性反应[J]. 实验动物与比较医学, 2011, 31(4): 259-263. Wang Ying, Sun Liping, Wei Shelin, et al. Acute toxicity of oil dispersant GM-2 to four species of aquatic animals[J]. Laboratry Animal and Comparative Medicine, 2011, 31(4): 259-263.
[21] 周红, 郭琳琳, 卢玲, 等. 中国化学品环境管理对本土模式生物的需求和应用[J]. 生态毒理学报, 2017, 12(2): 11-19. Zhou Hong, Guo Linlin, Lu Ling, et al. Needs and application of native model organisms for Chinese chemical management[J]. Asian Journal of Ecotoxicology, 2017, 12(2): 11-19.
[22] Davies P E, Cook L S J, Goenarso D. Sublethal responses to pesticides of several species of Australian freshwater fish and crustaceans and rainbow trout[J]. Environmental Toxicology and Chemistry, 1994, 13(8): 1341-1354.
[23] 战玉杰, 杨茹君, 王修林, 等. Hg(Ⅱ)和Pb(Ⅱ)对海洋单细胞藻的急性毒性效应[J]. 生态毒理学报, 2011, 6(5): 523-531.Zhan Yujie, Yang Rujun, Wang Xiulin, et al. Acute toxicity of Hg(Ⅱ) and Pb(Ⅱ) to marine unicellular algae[J]. Asian Journal of Ecotoxicology, 2011, 6(5): 523-531.
[24] Karlsson J, Breitholtz M, Eklund B. A practical ranking system to compare toxicity of anti-fouling paints[J]. Marine Pollution Bulletin, 2006, 52(12): 1661-1667.
[25] Li J, Yu L, Liu W, et al. Toxicity evaluation of common drilling fluid additives and applicability comparison of marine toxicity test organisms[J]. J Marine Sci Res, 2019, 9(3): 1000270.
[26] 于洋, 王晓红, 闻洋, 等. 应用Abraham方程研究有机污染物对七种水生生物的毒性[J]. 环境化学, 2015, 34(1): 23-36. Yu Yang, Wang Xiaohong, Wen Yang, et al. Study on the toxicity of organic pollutants to sevenaquatic organisms based on Abraham model[J]. Environmental Chemistry, 2015, 34(1): 23-36.
[27] Wang X H, Yu Y, Huang T, et al. Comparison of toxicities toand fish based on discrimination of excess toxicity from baseline level[J]. Plos One, 2016, 11(2): 1-17.
[28] 王东, 冯定, 张兆康. 海上油田废弃钻井液的毒性评价及无害化处理技术研究进展[J]. 环境科学与管理, 2011, 36(6): 78-83. Wang Dong, Feng Ding, Zhang Zhaokang. Technical progress on toxicity assessment and innocuous treatment of wasted drilling fluid from offshore oilfield[J]. Environmental Science and Management, 2011, 36(6): 78-83.
[29] 冯晓娜, 杨芷, 孙洁, 等. 有机污染物对发光菌和鱼的毒性相关性研究[J]. 生态毒理学报, 2017, 12(3): 687-694. Feng Xiaona, Yang Zhi, Sun Jie, et al. Investigation of toxicity correlation of organic pollutants betweenand fish[J]. Asian Journal of Ecotoxicology, 2017, 12(3): 687-694.
[30] Zhang X J, Qin H W, Su L M, et al. Interspecies correlations of toxicity to eight aquatic organisms: Theoretical considerations[J]. Sci Total Environ, 2010, 408: 4549-4555.
Toxicity evaluation of drilling fluid characteristic pollutants and comparison of applicability of marine organisms for toxicity test
LIU Wei-li1, YU Lu-jun2, LI Jian-jun2, CHEN Xiao-qu2, ZHANG Lei3
(1. China Oilfield Services Limited, Tianjin 300450, China; 2. Guangdong Laboratory Animals Monitoring Institute; Guangdong Provincial Key Laboratory of Laboratory Animals, Guangzhou 510663, China; 3. Beijing Tiantai Zhiyuan Technology Co., Ltd., Beijing 100020, China)
Given the yearly increases in the number of offshore drillings, the utilization of drilling fluids has rapidly increased. The environmental hazards associated with drilling waste have attracted a lot of attention. Therefore, it is important to select ecofriendly drilling fluid additives and screen for reliable bioindicators. In this study, the toxicity of ZnSO4∙7H2O, HgCl2, phenol, and sodium dodecyl sulfate (SDS) was investigated according to the guidelines of ISO 11348-1 (2007) and the Chinese national standards (GB/T 21805-2008 and GB/T 18420.2-2009). Marine test organisms, including bioluminescent bacterium, marine diatom, cladoceran, anostracan, whiteleg shrimp, and fish, were selected for this study, considering their high sensitivity. The results showed that Hg2+is highly toxic to the six marine organisms. Zn2+and SDS are moderately and highly toxic, respectively, whereas phenol exhibits a moderate to low toxicity. The order of sensitivity of the species to drilling fluidcharacteristic pollutantsis as follows:>>>>>Furthermore, there are significant correlations between,, andand between,, and. This study aids in the selection of test marine organisms for the evaluation of toxicity of drilling fluids.
drilling waste; acute toxicity; test organisms
Dec. 6, 2019
X82; Q95.3
A
1000-3096(2020)10-0074-07
10.11759/hykx20191202002
2019-12-02;
2020-04-28
中海油田服务股份有限公司项目(YHB20YF014)
[Capacity Promotion of Scientific Research Platform of Oilfield Chemicals, No. YHB20YF014]
刘卫丽(1984-), 女, 工程师, 主要从事海洋石油钻井液与完井液研究, 电话: 15343168569, E-mail: 277465200@qq.com; 张磊,通信作者, 022-59551616, E-mail: 342704462@qq.com
(本文编辑: 谭雪静)

