硫酸盐还原菌处理低浓度含镉废水的试验研究
(湖南工业大学 土木工程学院,湖南 株洲 412007)
1 研究背景
近年来,随着工农业的快速发展、城市圈的扩大和矿产资源的开发,我国流域重金属污染日趋严重。以湖南省湘江流域为例,根据相关资料[1]的统计,大多数有色金属和稀有金属矿藏的开采和冶炼主要分布在湘江流域两岸,导致了土壤中重金属污染的加剧,又由于金属元素大多具有较强的迁移性,使得流域被污染后,金属元素在水流中以离子的形式流经被污染土壤后迁移到自然水体中。危害较大的为有色金属,主要包括汞、铅、镉、铜、铬等重金属离子[2]。李倩[3]采用Hakanson指数法对湘江流域某研究区域土壤重金属潜在生态风险进行了评价。其中一项结果表明,镉在该地土壤中的富集程度最大,且具有严重的潜在生态风险,应引起高度重视。
镉(Cd)是存在于自然界中的一种金属元素,常见的镉化合物有氧化镉、氯化镉和硒化镉等。镉在水体中的存在形态除了简单离子,还可以与氨、氰化物、氯化物、硫酸根形成配合离子的形态存在[4]。在天然水域pH值范围内,水体中的镉离子容易发生水解而生成轻基配合物和氢氧化物沉淀[5]。镉的迁移能力强,容易通过吸入灰尘和植物富集进入食物链,对人体造成较大危害。重金属镉进入人体后会损伤神经系统、免疫系统、生殖系统,引发肿瘤等[6]。
含镉废水属于重金属废水,针对该类废水传统常规处理方法主要有电解法、离子交换法、不溶性络合物法、沉淀法、反渗透法、气浮法、吸附法等[7]。一般的化学沉淀法只能对高浓度污水具有较高的去除效率,并且处理后的污水容易造成二次污染。离子交换法处理含镉废水的净化程度高,可以回收镉,无二次污染,但成本较高,并且一次性交换容量有限。膜分离法、电化学法等方法虽然能有效处理低浓度重金属废水,但由于运行成本较高等问题导致无法被大规模应用于工程实践中。相较于传统常规处理方法,微生物修复技术具有成本低、操作便利、环境友好等优点[8-11]。在众多可修复重金属污染的微生物中,硫酸盐还原菌(sulfate-reducing bacteria,SRB)是兼性厌氧的异养型微生物,其种类众多且不同种类的代谢类型不同[12],其主要处理含镉废水的途径是通过SRB 在无氧呼吸过程中,将SO42-作为最终电子受体进行异化还原[13],从而将SO42-还原成为H2S。H2S 会与废水中的重金属离子反应生成金属硫化物沉淀,从而达到将溶解性的金属离子从水中分离出来的目的。由于多数重金属硫化物的溶解度很小,所以该方法可以适用于多种低浓度重金属废水的处理。
本研究从株洲市某污水厂的污泥中培养驯化出以SRB为优势菌种的混合菌液,以Cd2+去除率为考察指标,考察了镉离子初始浓度对SRB 去除含镉废水的影响,为SRB处理含镉废水的进一步深入研究提供一定的基础。
2 材料与方法
2.1 试验材料
2.1.1 菌种
取自湖南省株洲市某污水处理厂污泥池底层污泥,呈灰黑色,颗粒粒径均匀。
2.1.2 主要仪器与试剂
高速台式离心机、电子天平、岛津Shimadu 原子吸收发射光谱仪、UV-1800 型紫外分光光度计,均为市购;K2HPO4和NaCl 等化学试剂均为市购,国产分析纯;镉离子标准溶液参照国标配制,所用试剂为CdCl2·2.5H2O,国产分析纯。
2.1.3 培养基
基础培养基:NaCl 10.0 g、酵母粉5.0 g、胰蛋白胨10.0 g、水1 000 mL。富集或分离培养基:K2HPO4,0.01 g/L;MgSO4·7H2O,0.2 g/L;维生素C,0.1 g/L;酵母浸膏,1.0 mL/L;乳酸纳,4 mL/L,pH值为7.5;NaCl,10.0 g/L;(NH4)2Fe(SO4)2·6H2O,10.0 g/L。
用0.1 mg/L NaOH 溶液和0.1 mg/L HCl 溶液将液体培养基的pH值调节至7.5 左右,之后将培养基放入高压蒸汽灭菌锅,在121℃条件下使用高压蒸汽灭菌20 min。由于Fe2+在高温条件下容易被氧化,所以针对(NH4)2Fe(SO4)2·6H2O 采用紫外线灭菌,灭菌后放置备用,等液体培养基降至室温后再加入。
2.2 试验方法
2.2.1 菌株的筛选分离与纯化
将取样的污泥分装在锥形瓶中,按每升加入5 g无水硫酸钠,在35℃下振荡培养驯化1 周。然后将其接入液体富集培养基进行厌氧培养,大约2~3 d后,锥形瓶中氧气耗尽,形成厌氧环境,培养基颜色变黑(FeS所致)。打开锥形瓶封口膜,可闻到浓烈的臭鸡蛋气味(H2S),将打湿的醋酸铅试纸置于瓶口位置进行检测,变黑,说明培养基中含有SRB。每周将10 mL 菌液接种至新鲜培养基,连续培养4 周后获得以SRB为优势菌种的混合菌液。即可采用稀释涂布-夹层培养法进行厌氧分离培养[14]。
2.2.2 菌株对镉离子的耐受性试验
参考D.Teclu 等的试验方法[15],将富集后的SRB 混合菌液在厌氧条件下培养50 h。然后,在无菌条件下,取50 mL 菌液,在转速为5 000 r/min 下离心8 min。舍去上清液,用2.5 g/L的NaHCO3溶液对离心管底部的菌体沉积物进行稀释,控制OD(optical density,OD)值在0.1 左右,各接种10 mL 于5个250 mL 液体培养基中。密闭封口,并用体积分数为99.99%的N2吹托这4个锥形瓶10 min,放入恒温培养箱中于35℃下培养12 h后(此时无H2S 生成),用移液管加入用CdCl2·2.5H2O 配置好的Cd2+溶液,使培养基内Cd2+的质量浓度分别为10,20,40,60,80 mg/L,并且于7d取样后置于离心机中于3 000 r/min 下离心10 min。取上清液用微孔滤膜(孔径为0.22 μm)过滤,经酸化-消化处理后稀释不同倍数,用原子吸收分光光度计测定剩余Cd2+的质量浓度。
2.2.3 菌株处理镉离子的去除效果试验
取厌氧培养50 h处于对数生长期的SRB 混合菌液,在无菌条件下取50 mL 菌液在转速为5 000 r/min下离心8 min。舍去上清液,再用浓度为2.5 g/L的NaHCO3溶液对离心管底部的菌体沉积物进行稀释,控制OD值在0.1 左右,在1个250 mL 液体培养基中接种10 mL,密闭封口,放入恒温培养箱中于35℃下培养12 h后,加入初始质量浓度为20 mg/L Cd2+溶液。同上述方法取样并测定剩余Cd2+的浓度。按下式计算菌体对Cd2+的去除率:
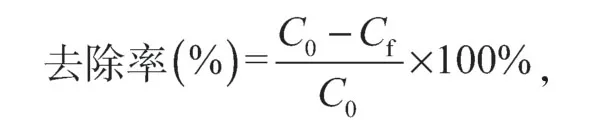
式中C0和Cf分别为镉离子的起始质量浓度和最终质量浓度(mg/L)。
3 结果与分析
3.1 菌液对Cd2+耐受性试验
根据2.2.2节的试验步骤,打开瓶口密封膜对瓶内气味进行鉴别,考察7 d后耐受试验中各浓度梯度下锥形瓶内培养基表观变化情况,以此判断该试验条件下SRB 对Cd2+的耐受性,结果如表1所示。

表1 不同质量浓度梯度下的培养基变化Table1 Changes of culture medium under different mass concentration gradients
从表1的结果可知,在培养基中Cd2+的质量浓度低于40 mg/L时,7 d后锥形瓶内的培养基会变黑,打开瓶口密封膜会散发出浓烈的臭鸡蛋气味。当培养基中Cd2+的质量浓度达到60 mg/L 以上时,7 d后锥形瓶内的培养基无颜色变化,打开瓶口密封膜瓶内无明显臭鸡蛋气味。该结果初步说明当培养基中Cd2+的质量浓度低于40 mg/L时,对SRB的正常生长代谢无明显影响,当培养基中Cd2+浓度达60 mg/L 以上时,SRB的生长代谢受到明显影响。相关资料[16]显示,低浓度的重金属可刺激微生物生长,而高浓度的重金属可抑制微生物的生长繁殖,损害其呼吸作用,使细胞形态异常,甚至裂解。SRB可以通过细胞的主动吸收并积存重金属在细胞的原生质内,从而降低重金属的毒害作用,但重金属离子超过了自身的耐受性也会使SRB的代谢生长受到抑制[17]。黄志等[18]研究发现,随着重金属离子初始浓度的升高,SRB 对于Cu2+、Pb2+、Zn2+、Cd2+、Fe2+各重金属离子的去除率均降低,当Cd2+的初始质量浓度达50 mg/L后,重金属对SRB的抑制作用开始显现。
去除率是考察SRB 在不同环境下去除能力的指标,7 d后课题组对培养基内Cd2+质量浓度进行测定,并依照2.2.3中的公式计算SRB 对Cd2+的去除率,结果如图1所示。
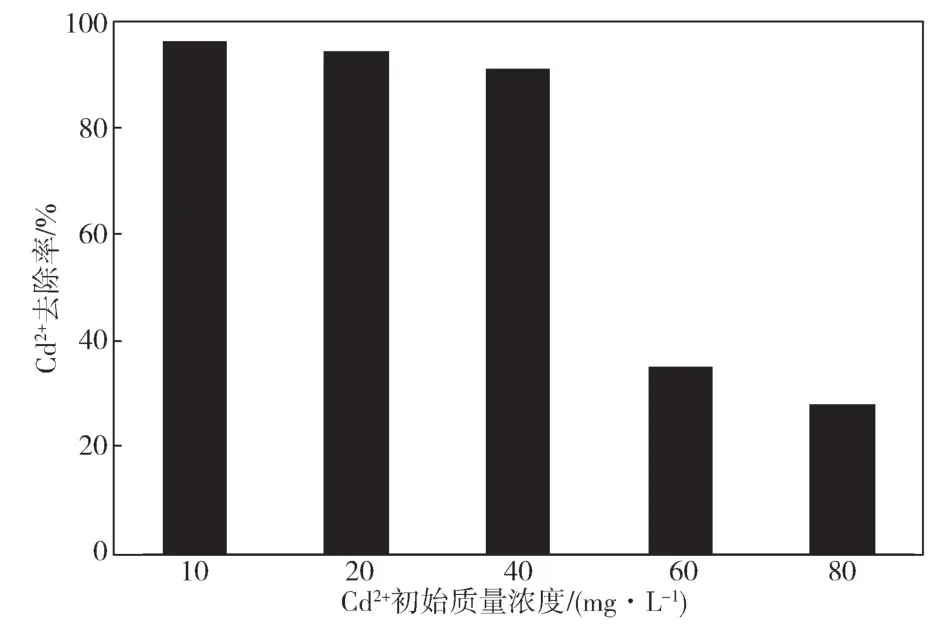
图1 不同初始质量浓度下SRB 对Cd2+的去除率Fig.1 Removal rate of Cd2+ by SRB under different initial mass concentrations
从图1中可以看出,当培养基中Cd2+的质量浓度低于40 mg/L时,SRB 对于Cd2+的去除率接近100%;当培养基中Cd2+的质量浓度达到60 mg/L 以上时,SRB 对于Cd2+的去除率较低。试验结果从另一方面说明当生长环境的Cd2+浓度超出SRB 耐受性时,会对菌体的正常代谢生长有较为明显的抑制作用,从而降低其去除效果。而观察到高质量浓度(60,80 mg/L)Cd2+条件下,Cd2+的去除率也有所下降,其原因可能是细胞的直接吸附作用,也有可能是细胞受到Cd2+剧毒性裂解后的死菌体所具有的吸附作用,它能够通过吸附作用为SRB 去除溶液中的高浓度重金属离子做出一定的贡献,金显春[19]在研究微生物法除砷时,将试验所用的烟曲霉菌球经过高温杀菌后,制成吸附剂,并通过试验发现该吸附剂对As (III)和As (V) 均有着良好的吸附效果。可以推断,本试验所培养驯化的SRB 菌对于Cd2+耐受极限应在40~60 mg/L,这与参考文献[18]中所得结论(50 mg/L)较为吻合,说明该菌适用于低浓度Cd2+废水的处理。
3.2 菌液对Cd2+去除效果的试验
SRB 能否达到应用中解决含镉废水的问题,还需研究其在不同浓度下对于Cd2+的去除效果。在2.1节的试验结果基础上,研究通过试验测定不同初始质量浓度(10,20,40,60 mg/L)下SRB 菌液对Cd2+的处理效果,结果如图2所示。
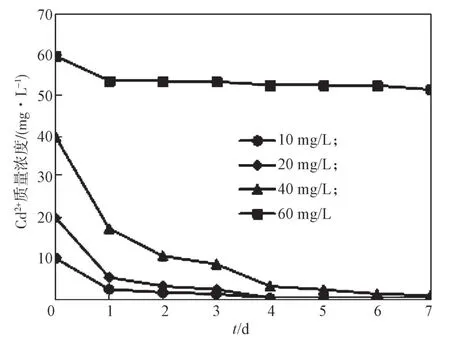
图2 不同初始质量浓度下经SRB 作用后废水中Cd2+质量浓度的变化曲线Fig.2 Variation of residual concentration of Cd2+ in wastewater after SRB treatment under different initial mass concentrations
从图中2可以看出,当培养基内Cd2+溶液的质量浓度为60 mg/L时,SRB 对Cd2+几乎没有去除效果,在1~2 d 内有部分Cd2+浓度下降。当培养基内Cd2+的质量浓度低于40 mg/L时,在SRB 生长的各个阶段对于Cd2+都有较高的去除效果,SRB可以完全去除培养基中的Cd2+,去除率接近100%。在整个过程中,Cd2+质量浓度随反应时间而不断下降,培养基内的Cd2+质量浓度在反应的前4 d 下降得最快,此后下降的速度趋于缓慢。这符合微生物生长的规律,SRB在经过一段时间的适应期后,在对数期的去除能力突出,去除率在其对数期达到最高值,其次为稳定期,该结果与董静等[20]的研究结果相符。有学者在研究SRB处理含铀废水时,发现利用以SRB为优势菌种的混合菌液在延滞期和对数期对于U(Ⅵ)的处理效果较好[21]。
进一步分析SRB处理Cd2+的效果随时间的变化规律,以更好地在高效处理时间内利用SRB的去除能力解决含镉废水治理问题。课题组单独研究了Cd2+初始浓度为20 mg/L时,不同时间节点SRB 对Cd2+的去除效果,结果如图3所示。

图3 初始质量浓度为20 mg/L时SRB 对Cd2+的去除效果随时间的变化曲线Fig.3 Time depondent of Cd2+ removal rate by SRB with an initial mass concentration of 20 mg/L
从图3中可以看出,向培养基中加入20 mg/L的Cd2+溶液后,前4 d 去除的效果达到了94%,说明在整个7 d的处理过程中,SRB 前4 d的处理效果占据了重要地位。随着时间的增加,SRB 对于Cd2+的去除速率(单位时间内的去除率)逐渐降低,一方面可能与菌株的生长规律有关,另一方面可能是与菌液中的硫酸根离子浓度下降有关[22]。菌株在衰亡期对硫酸根离子的还原速率变慢,其次,随着反应的进行,底物硫酸根离子的浓度减少。
SRB 对于各种重金属离子的去除机理一直是学者们研究的热点,潘响亮[23]等通过试验发现硫酸盐还原菌群分泌的胞外聚合物对Cu2+也有一定的吸附效果。本研究对反应后瓶底的沉积物进行了观察与分析,判断SRB 去除Cd2+反应过程中的机理。图4为7 d后用于系统反应的锥形瓶底部的沉淀物图像。
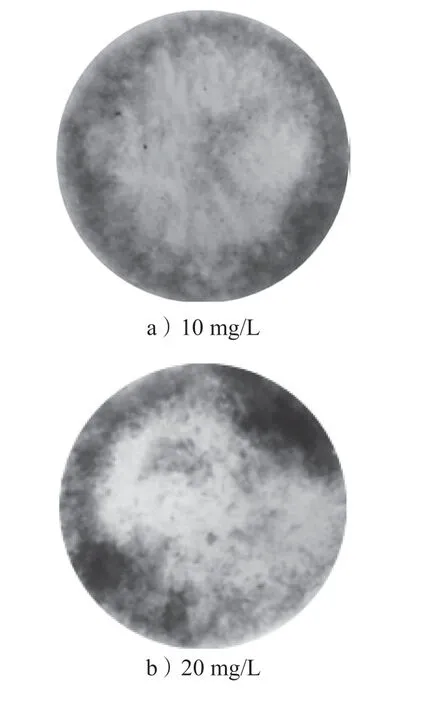

图4 不同初始质量浓度下锥形瓶底部沉淀物图像Fig.4 Sediment images at the bottom of the conical flask under different initial mass concentrations
从图4中可以观察到,10~40 mg/L的3个锥形瓶底部有大量明显的黑色沉淀物,经初步分析为CdS沉淀。由此可以得出,在SRB 菌株生长较好时,对Cd2+的去除途径中H2S 占据了主导地位,其机理就是通过SRB 还原产生的H2S 反应生成CdS 沉淀而得以去除。含有60 mg/L的Cd2+溶液的锥形瓶底部有少量暗黄色沉淀物,猜测沉淀物为少量CdS与死菌体的混合物。
结合3.1节的试验结果,分析SRB 菌株在耐受性范围以外的生长状况,可以进一步掌握SRB处理含镉废水的条件,在Cd2+初始质量浓度为60 mg/L的情况下,SRB 对其几乎没有处理效果,过高的Cd2+浓度会抑制SRB的还原过程,甚至对细胞内部产生很大的损伤作用。相关资料[24]表明,重金属离子的剧毒性会导致其细胞内部的过度氧化和选择性损伤。它们和细胞结构组分的必要金属竞争含内部硫化合物和氧的结合位点,从而破坏DNA 链和蛋白质结构,干扰细胞代谢中正常的氧化磷酸化[25],从而使微生物死亡。
4 结论与展望
利用生物技术对环境进行修复兴起于21世纪,在治理重金属污染方面有很大的应用前景,关于含镉废水的处理目前有很多。安毅夫[26]利用硫酸盐还原菌和解磷菌联合修复Cd 污染土壤,修复效率为73.96%。赵美花等[27]利用黄孢原毛平革菌处理镉污染废水,在最佳处理条件下,对镉的去除率可达64% 左右。本研究利用从污水处理厂污泥池中分离得到的以SRB为优势菌种的混合菌液处理低浓度含镉废水。
在适宜的环境条件下,SRB 对Cd2+的耐受极限应为40~60 mg/L,有研究表明,SRB的耐受性可以通过有效途径提高,田玉斌等[28]通过采用聚乙烯醇-硼酸二次交联的方式,制作了新型硫酸盐还原菌生物活性填料,SRB 被包裹在包埋填料中,提升了SRB对于重金属的耐受程度。此外,可以通过驯化的方式来提高微生物的耐受性,叶锦韶等[29]认为在微生物的生长环境中含有一定浓度的某类重金属时,可有效地诱导出微生物体内对重金属的运输与毒性起到拮抗与解毒作用的抗性基因。
初始质量浓度低于40 mg/L的含镉废水可以被SRB 完全去除,并且处理效果可以达到国家排放标准。从沉淀底物CdS可以说明将SO4-还原为S2-从而与重金属离子形成沉淀,是SRB 去除重金属的主要途径。
在最佳的反应条件下Cd2+的去除率接近100%,效果比较理想,说明利用SRB处理含镉废水具有一定的可行性,试验所得数据可以为SRB处理低浓度含镉废水提供一定的基础参数支撑。由于微生物本身的处理机制和实验条件的不同,如菌液投加浓度、pH值和温度等因素的影响,不同微生物对不同重金属离子的去除效果存在一定差异。
反应过程中菌液pH值的变化与SRB 还原SO4-为S2-形成CdS沉淀的关系是本试验有待解决的问题,以及菌体裂解后高浓度Cd2+废水浓度仍有所下降的原因也有一定的研究空间。同时,不同的地区有着不同的环境条件,相较于实验室研究有很大的差异,如何结合实际开展实际的治理应用具有更深远的研究意义。

