基于茶树油/盐酸奥替尼啶的纳米胶囊的制备及抗菌性能
邢 幸, 康 宁, 曾 天, 徐云龙
(1. 华东理工大学材料科学与工程学院,上海200237;2. 上海微纳科技有限公司,上海 200237)
随着细菌耐药性[1-2]的增加迫切需要一种具有非特异性作用模式且不产生耐药菌的抗菌药物;银、铜等金属粒子虽然杀菌能力强但细胞毒性大[3-4]。本文选用不产生耐药菌且细胞毒性低的茶树油(TTO)和盐酸奥替尼啶(OCT) 作为抗菌药。TTO 是迄今为止发现的杀菌效果最强的天然抗菌剂之一,抗菌广谱、抗菌活性强、细胞毒性低。TTO 抗菌性依赖于其亲油性的碳氢结构对细菌细胞膜结构的破坏[5-6]。双子乳化剂OCT 是一种双吡啶胺类广谱抗菌药,它有两个相距较远且互不干扰的阳离子活性中心,具有更强的吸附能力及更高的荷电特性,从而更易改变细胞壁原生质膜的渗透性以杀死细菌[7-8]。OCT 对大肠杆菌和金黄色葡萄球菌的杀菌率为醋酸氯已定的3~10 倍,并且不产生耐药性[9]。Hübner 等[10]在首次体外抗菌研究中证实OCT 和抗生素联用时具有协同增效作用,而不像醋酸氯已定一样产生拮抗作用。Müller 等[11]通过比较9 种常见抗菌药对大肠杆菌、金黄色葡萄球菌的抗菌性能和对小鼠成纤维细胞的细胞毒性发现,在产生相同的杀菌效果时OCT的浓度最低且细胞毒性最小。
TTO 的缺点是易挥发、不稳定,其中的萜烯类有效成分易被氧化[12],高浓度时刺激伤口[13-14]。为了提高TTO 的稳定性、降低TTO 释放浓度、延长TTO 释放时间,本文将其包封于纳米二氧化硅胶囊中。纳米二氧化硅胶囊具有高的比表面积(载药量比介孔纳米二氧化硅大3~5 倍)、可控的尺寸[15-16]、良好的力学性能、化学稳定性和生物相容性[17]。纳米胶囊还具有控制药物释放速率,保护药物不被外界环境破坏,增加挥发性油的稳定性等作用[18-20]。
本文研究TTO 与OCT 对金黄色葡萄球菌和大肠杆菌的联合抗菌作用,成功制备出一种同时具有TTO 和OCT 两种抗菌剂的纳米二氧化硅胶囊SINCOCT/TTO,并与乳化剂十六烷基三甲基氯化铵(CTAC)制备的纳米胶囊SINC-TTO 在形貌、粒径分布、比表面积、载药量、体外释药、抗菌性等方面进行比较。
1 实验部分
1.1 试 剂
十六烷基三甲基氯化铵(分析纯,纯度99%),阿拉丁试剂有限公司;正十六烷(HE, Hexadecane, 分析纯,纯度99%),阿拉丁试剂有限公司;茶树油(纯度100%),AA 英国护肤品公司;盐酸奥替尼定(分析纯,纯度98%),毕得医药有限公司;正硅酸乙酯(TEOS,纯度98%)、橄榄油(OO, 分析纯,纯度100%),上海麦克林生化试剂有限公司;牛肉浸膏(生物试剂)、琼脂粉(生物试剂)、蛋白胨(生物试剂),上海天莲化工科技有限公司;吐温-80(化学纯)、氯化钠(分析纯)、磷酸氢二钠(分析纯)、磷酸二氢钾(分析纯),上海凌峰化学试剂有限公司;金黄色葡萄球菌(ATCC65388)、大肠杆菌(CCTCC AB 93154),上海瑞普生物科技有限公司;去离子水实验室自制。
1.2 二氧化硅载药纳米胶囊的制备
采用微乳液模板界面水解缩合硅氧烷的方法制备包裹油性药物二氧化硅纳米胶囊。称取2 g TEOS、1 g TTO 与125 mg HE 混合,加入30 mL、 0.77 mg/mL对应的CTAC 或OCT 水溶液,以1 000 r/min 的转速于室温搅拌1 h 进行预乳化。将超声细胞粉碎机功率调到450 W,振幅调到50%,使用6#变幅杆(30 s 超声、10 s 暂停)在冰水浴连续超声180 s 获得微乳液,随后以1 000 r/min 的搅拌速度于室温搅拌12 h,预冷冻8 h 后,用冷冻干燥机冻干。以OO 为油核、OCT为乳化剂,用相同的方法和配比制备纳米胶囊SINCOCT。
1.3 载药纳米二氧化硅胶囊的形貌和结构表征
采用傅里叶变换红外光谱仪(FT-IR,Nicolet is50 型,美国热电公司)对纳米胶囊中的药物成分进行分析,纳米胶囊分散液预冷冻8 h 后于冷冻干燥机(SCIENTZ-10N 型,宁波新芝)中冻干,冻干粉末采用KBr 压片的方法制样,茶树油涂在KBr 盐片上制样。用综合热分析仪(TGA,STA-409PC 型,德国耐驰公司)测定纳米胶囊热重曲线来确定纳米胶囊中包裹的茶树油含量。纳米胶囊的水合粒径采用动态光散射仪(DLS,ZEN-3700 型,英国马尔文公司)测定。采用场发射扫描电子显微镜(SEM,S-4800 型,日本日立公司)和透射电子显微镜(TEM,JEM-1400型,日本电子株式会社)对纳米二氧化硅微胶囊进行形貌表征。采用酶标仪(AMAX384 型,美国分子器件公司)测试茶树油和盐酸奥替尼啶两种药物单独作用与联合作用时混合反应液的吸光度(OD)值。用紫外分光光度计(UV-vis,UV-3600 型,日本岛津公司)测试纳米胶囊的释药性能。采用比表面积及孔隙度分析仪(ASAP-2460 型,美国麦克仪器公司)在液氮温度−196 ℃下测定样品的吸附-脱附等温线,基于吸附-脱附等温线,采用BET(Brunauer Emmett Teller )法计算样品的比表面积,通过BJH 模型估算得到样品的孔径分布曲线。BET 制样方法:将纳米胶囊冻干粉放置于马弗炉中以4 °C/min 升温至400 °C,保温5 h,随后在200 °C 的真空干燥箱内脱气12 h。
1.4 茶树油和盐酸奥替尼啶单独作用与联合作用时的最小抑菌浓度(MIC)的测定[20]
选用革兰氏阳性菌金黄色葡萄球菌(S.aureus)和革兰氏阴性菌大肠杆菌(E.coli)作为抗菌实验的菌种。配制液态培养基[21](GBl5979―2002),用磷酸盐缓冲溶液(PBS)配制0.5 麦氏比浊浓度菌悬液的1 000 倍稀释液(细菌浓度约为1.5×105cfu/mL)。取96 孔板,在其中A、B 排每孔添加90 μL 液态培养基,随后在A、B 排第1 个孔加入90 μL 初始质量浓度为10 mg/mL 抗菌剂TTO(体积分数5%的吐温−80 水溶液)[22],采用对倍稀释法逐步稀释,随后在每个孔滴加入10 μL 菌悬液 (液体总体积为100 μL)。C、D 排步骤同上,抗菌剂为初始质量浓度770 μg/mL 的OCT溶液。在同一个96 孔板中,有4 个孔只加液体培养基作为阴性对照,4 个孔只加液体培养基和菌悬液作为阳性对照。在37 ℃振荡摇床中培养12 h,用酶标仪读取600 nm 处的吸光度OD600,每次测试2 个平行样,实验重复3 次。每个孔的细菌生长率S 通过式(1)计算。然后将所得数据绘制成柱状图,得到抗菌药物的MIC。

其中:MICTTO-unite为联合用药时TTO 的MIC;MICOCT-unite为联合用药时OCT 的MIC;MICTTO为TTO 单独用药时的MIC;MICOCT为OCT 单独用药时的MIC。判断方法为:FIFC≤0.5,协同作用;0.5 测定两种纳米胶囊中抗菌药物TTO 的释放质量浓度随时间变化的关系曲线。配制体积分数为10%的乙醇的PBS 溶液。取50 mg 冻干纳米胶囊粉末于透析袋中,另取1 mL 透析液于透析袋中作为内液,9 mL 透析液作为外液。在固定的时间点内取出0.4 mL 外液,测其在264 nm 处吸光度,随后外液补充0.4 mL 透析液。利用标准曲线换算出TTO 的质量浓度[24],绘制出TTO 质量浓度随时间变化的关系曲线。 测定SINC-OCT/TTO 中的OCT 释放质量浓度随时间变化的关系曲线。测试方法同上,测定281 nm处的吸光度,利用标准曲线换算出OCT 的质量浓度,绘制出OCT 质量浓度随时间变化的关系曲线。 采用稀释平板计数法测试纳米胶囊的杀菌性能。实验前所有玻璃仪器在121 ℃下灭菌30 min。取8 个试管,分别标记为A、B、C、D、E、F、G、H。每个试管加入5 mL PBS 溶液,滴加10 μL 0.5 麦氏比浊浓度的菌悬液的1 000 倍稀释液(其中A、C、E、G 滴加金黄色葡萄球菌,B、D、F、H 滴加大肠杆菌)。A、B 试管分别加入10 mg SINC-TTO,C、D 试管分别加入10 mg SINC-OCT/TTO,E、F 试管分别加入10 mg SINC-OCT,G、H 组为阳性对照组,不加抗菌纳米胶囊。混合液分别置于摇床中室温振荡反应1、3、6 h,并分别于1、3、6 h 吸取10 μL 混合液接种平板,将15 mL 冷却至40~45 ℃琼脂培养基倾注于平板中转动混匀,37 ℃恒温培养16 h 后观察菌落生长情况。 以溶有阳离子乳化剂OCT 或CTAC 的水溶液为连续相,TTO、HE、TEOS 为分散相,利用超声处理将分散相转化为微乳液。随后以微乳液滴为模板,TEOS 在微乳液滴表面水解缩聚成Si―O―Si 结构,将TTO 封装于纳米胶囊核心 (图1),SINC-TTO 和SINC-OCT/TTO 的粒径分布曲线见图2,由图2 可知,SINC-TTO、SINC-OCT/TTO 的 流 体 力 学 直 径(dn)分别为67.36、121.7 nm。由扫描电镜(图3 (a1),3 (b1), 3 (c1))、透射电镜(图3 (a2), 3 (a3), 3 (b2), 3 (b3),3 (c2), 3 (c3))可见纳米胶囊成空心球状结构,球壳厚度约为6~10 nm,SINC-OCT/TTO 的分散性好于SINC-TTO。这是由于SINC-OCT/TTO 使用双子乳化剂OCT,其电荷密度更高,静电排斥力更强,因此分散性更好。以没有抗菌性能的OO 作为油核,用乳化剂OCT 制备的纳米胶囊为SINC-OCT。由图3 可见使用OO 制备的纳米胶囊比使用TTO 制备的纳米胶囊分散性差、结构完整性差。这说明油的种类对纳米胶囊的制备存在影响。 图 1 微乳液法合成二氧化硅纳米胶囊的原理图Fig. 1 Schematic illustration of the synthesis of silica nanocapsules(SINCs) by using miniemulsion 图 2 SINC-TTO,SINC-OCT/TTO 粒径分布曲线Fig. 2 Particle size distribution of SINC-TTO and SINC-OCT/TTO 微乳化时两相界面处乳化剂并未完全充满,而是有油水渗入其中,油水渗入位置形成孔洞[25]。由SINC-TTO,SINC-OCT/TTO 氮气吸附-脱附曲线(图4)可见两种纳米胶囊存在介孔结构,滞回环形状表明孔洞形状为狭缝状孔与墨水瓶状孔的组合[26],TEM 图也证实了纳米胶囊呈现空心球状结构。表面活性剂的种类影响到纳米胶囊的粒径、孔径、载药量、比表面积。与传统乳化剂CTAC 相比,拥有更高的正电荷密度的双子乳化剂OCT 与带负电的SiO2有强烈的静电吸引作用,导致Si―O―Si 壳体密度增加、孔径减小、比表面积增加(表1)。纳米胶囊的载药量与其比表面积成正比。实验中加入HE 的目的是缩小胶囊尺寸实现微乳化[17]。 图5 (a)示出了两种纳米胶囊(SINCS)冻干粉末的热重分析曲线。曲线可以分为两个阶段,第1 阶段25~108 °C,此时质量损失为3.8%、6.1%,这是由于部分残留水分挥发导致。第2 阶段108~900 °C,此时质量损失分别为33.3%、47.7%,这是TTO 的挥发和碳化。由此可以确定两种载药纳米胶囊的TTO 含量分别约为33.3%、47.7%。以OCT 作为乳化剂合成的纳米胶囊中TTO 的含量高于以CTAC 为乳化剂合成的纳米胶囊。SINC-TTO 热重曲线较SINC-OCT/TTO 有明显的滞后,这可能是由于纳米胶囊SINCTTO 的冻干粉团聚结块分散性比SINC-OCT/TTO 差(图3)。多孔材料的载药量与比表面积成正比,纳米胶囊SINC-TTO 的比表面积小,载药量比SINC-OCT/TTO 少(表1、图5 (a))。 图 3 SINC-TTO,SINC-OCT/TTO,SINC-OCT 纳米胶囊的扫描电镜与透射电镜照片Fig. 3 SEM and TEM micrographs of the SINC-TTO, SINC-OCT/TTO and SINC-OCT 图 4 SINC-TTO,SINC-OCT/TTO 的氮气吸附-脱附曲线Fig. 4 N2 adsorption-desorption isotherms of SINC-TTO and SINC-OCT/TTO 表 1 两种用不同表面活性剂合成的包裹茶树油纳米胶囊的流体力学直径、包油率、比表面积、孔径Table 1 Hydrodynamic diameters, encapsulation efficiency, surface area and mean pore diameter of silica nanocapsules containing tea tree oil stabilized by different surfactants 图5(b)示出了茶树油、二氧化硅及两种载药胶囊的红外光谱图。从红外光谱确认两种纳米胶囊中含有TTO 成分,其中1 095 cm−1处是SiO2中 Si―O―Si反对称伸缩振动吸收带,1 072.85、1 077.94 cm−1处是SINC-TTO、SINC-OCT/TTO 中的Si―O―Si 反对称伸缩振动吸收带[27-28]。944.6、803 cm−1处分别是SiO2、SINC-TTO、SINC-OCT/TTO 中的Si―OH 弯曲振动吸收峰、Si―O 对称伸缩振动吸收峰。462.3、456.2 cm−1处 分 别 是SiO2、SINC-TTO、SINC-OCT/TTO 中的Si―O 对称弯曲振动吸收峰[27-28]。可见,纳米胶囊壳中含有SiO2。同时,TTO 的红外光谱中的峰(2 958 cm−1处为―CH3反对称伸缩振动、2 925 cm−1处为―CH3伸缩振动、2 871 cm−1处为―CH2对称伸缩振动)是TTO 的特征峰。SINC-TTO、SINC-OCT/TTO 中的2 951、2 924 、2 857.8 cm−1处的峰均是TTO 的特征峰,由此可以确定两种载药纳米胶囊中均含有茶树油成分。 图 5 (a) 两种载药纳米胶囊冻干粉末的热重分析曲线;(b) 茶树油、二氧化硅及两种载药胶囊红外光谱图Fig. 5 (a) TGA curves of freeze dried SINCs; (b) FT-IR spectra of TTO, SiO2, two kinds of SINCs 通过测试TTO、OCT 对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度MIC 来比较TTO 和OCT 的抑菌性能,并为证明纳米胶囊中OCT 与TTO 的协同抗菌作用提供依据。图6 示出了两种药物单独作用与联合作用时药物浓度与细菌存活率的关系。TTO 对金黄色葡萄球菌和大肠杆菌的MICTTO分别为1.25、2.5 mg/mL(图6 (a),(b));OCT 对金黄色葡萄球菌和大肠杆菌的MICOCT分别为3、6 μg/mL(图6 (c),(d))。可见OCT 对两种菌的MIC 都远小于TTO,并且两种抗菌剂对金黄色葡萄球菌的抑菌能力均强于对大肠杆菌的抑菌能力。 TTO 与OCT 联用时对金黄色葡萄球菌和大肠杆菌的MICTTO-unite为0.31、1.25 mg/mL,MICOCT-unite为0.75、3 μg/mL (图6 (e),(f))。通过测试两种药物单独与联合作用时的MIC,比较计算得出TTO 与OCT 联合作用时对大肠杆菌的FITC=1,对金黄色葡萄球菌的FITC=0.49。所以TTO 与OCT 联合作用时对大肠杆菌具有相加抗菌效应,而对金黄色葡萄球菌具有协同抗菌效应。 TTO 和OCT 的标准曲线如图7 (a)、(b)所示,两种纳米胶囊的TTO 释放质量浓度对时间变化的曲线如图7 (c)所示,SINC-TTO 中TTO 的释放曲线在0~1 h较为陡峭,有部分TTO 被吸附在纳米胶囊表面,在4 h质量浓度达到最大值15.9 μg/mL。SINC-OCT/TTO在3 h 质量浓度达到最大值22.8 μg/mL,随后质量浓度基本保持恒定,不断有TTO 从胶囊中释放补充。此时释放到混合液中的TTO 质量浓度低于MICTTO。纳米胶囊的缓释作用降低了TTO 的质量浓度,避免了其对伤口的刺激,同时延长了药物的杀菌作用时间。SINC-OCT/TTO 的TTO 释放速度大于SINC-TTO(图7),这是由于SINC-OCT/TTO 的比表面积大于SINC-TTO (表1)。 图 6 两种药物单独作用 (a, b, c, d) 与联合作用 (e, f) 时药物浓度与细菌存活率的关系Fig. 6 Relationship between the two kinds of drug alone (a, b, c, d) and combined (e, f) act on the bacterial concentration and the survival rate of bacterial 图 7 (a) 茶树油乙醇溶液和 (b) 盐酸奥替尼啶水溶液的标准曲线; 两种纳米胶囊释放的 (c) 茶树油和 (d) 盐酸奥替尼啶质量浓度随时间的变化曲线Fig. 7 Calibration curves for the determination of TTO in ethyl alcohol (a) and OCT in water (b); Release of (c) TTO and (d) OCT from SINCs SINC-OCT/TTO 中的OCT 释放质量浓度随时间变化曲线(图7 (d))与其中的TTO 释放类似,在3 h达到最大值0.85 μg/mL,随后维持动态平衡,此时释放到混合液中的OCT 质量浓度接近于MICOCT(图6 (c), 6 (d))。纳米胶囊不断地补充由于新添加透析液造成的药物质量浓度的下降,使透析液中的药物质量浓度维持稳定(图7 (d))。通过测试透析液中的药物质量浓度随时间的变化,并将透析液中的TTO、OCT 质量浓度分别与MICTTO(图6 (a), (b))、MICOCT(图6 (c), (d))进行比较,为接下来验证纳米胶囊分散液的抗菌性测试中的TTO 与OCT 的协同抗菌作用提供依据(图8 (a), (b))。 Jiang 等[19]用CTAC 制备包裹OO 的纳米胶囊时发现此时的纳米胶囊并没有抗菌性,这是因为纳米胶囊在PBS 混合液中释放的CTAC 的质量浓度(3.9 μg/mL)远低于CTAC 的MIC (32 μg/mL),所以本实验中CTAC 的抗菌性同样不予考虑。SINCTTO 作为对照组纳米胶囊只有一种抗菌药TTO,SINC-OCT/TTO 有两种抗菌药TTO、OCT。 TTO、OCT 抗菌作用机理不同,不会因竞争同一靶位产生拮抗作用。两种纳米胶囊在释药透析液中TTO 的质量浓度相近,SINC-OCT/TTO 的释药透析液中含有一定质量浓度的OCT(图7 (d)),增强了SINC-OCT/TTO 的抗菌性能。图8 示出了纳米胶囊分散液对金黄色葡萄球菌、大肠杆菌的杀菌率及杀菌效果。从图中看出,用SINC-TTO、SINC-OCT/TTO、SINC-OCT 处理金黄色葡萄球菌悬液1 h 后细菌存活率分别下降到41.5%、6.7%、80%;处理的大肠杆菌悬液细菌存活率分别下降到83.8%、22.18%、88%。受到纳米胶囊的控释作用影响,抗菌实验中的PBS 缓冲液中的药物质量浓度随时间延长逐渐增加,菌落数随时间延长逐渐减少。在同一时间点3 种纳米胶囊的抗菌能力SINC-OCT/TTO>SINC-TTO>SINC-OCT。在3 h SINC-OCT/TTO 将金黄色葡萄球菌和大肠杆菌全部杀灭。这是因为与只含有一种抗菌剂TTO 的SINC-TTO 相比,SINC-OCT/TTO 不仅TTO的包载率(47.7%)大于SINC-TTO(33.3%)(图5 (a)),而且OCT 的抗菌能力高于TTO(图 (6));此外纳米胶囊不断补充消耗的抗菌剂,添加SINC-OCT/TTO 的PBS 缓冲液中药物质量浓度在3 h 达到最大值(图7 (c),7 (d))。不同细菌细胞膜的结构差异造成细菌耐药性差异,大肠杆菌的耐药性较强[29,30],同时由于OCT 联合TTO 对金黄色葡萄球菌的协同抗菌作用强于对大肠杆菌的相加抗菌作用,纳米胶囊处理过的金黄色葡萄球菌的失活率高于大肠杆菌。 图 8 不同SINCs 对金黄色葡萄球菌(a)和大肠杆菌(b)的灭活效率Fig. 8 Inactivation efficiency of S.aureus (a) and E. coli (b) in the presence of different SINCs (1)TTO 是自然界中杀菌性能最强的天然产物,然而由于其稳定性差、不溶于水、易挥发、易被紫外线氧化等缺陷限制了它的应用。本文以不产生耐药菌、杀菌能力强、细胞毒性低的TTO 为油核,TEOS为硅源,分别用两种不同的乳化剂CTAC、OCT 制备了两种纳米胶囊。 (2)两种纳米胶囊均呈现空心球形结构,平均直径分别为67.36 nm 和121.7 nm。以双子乳化剂OCT制备的茶树油纳米胶囊SINC-OCT/TTO 的TTO 包载率 (47.7%) 高于以传统乳化剂CTAC 制备的纳米胶囊SINC-TTO (33.3%)包载率,并且SINC-OCT/TTO的分散性好于SINC-TTO 的分散性。 (3)OCT 与TTO 联合作用于金黄色葡萄球菌与大肠杆菌时分别起到协同与相加作用,两种药物联用时无拮抗。抗菌实验证明了SINC-OCT/TTO 的杀菌性能远强于SINC-TTO、SINC-OCT,SINC-TTO 的杀菌性能强于SINC-OCT。纳米胶囊具有良好的药物缓释性能,纳米胶囊的杀菌性能随时间的延长而增强。微乳液法可以在合成的同时将药物包裹于纳米胶囊中,制备方法简单、反应条件温和、应用前景广阔。1.5 载药纳米胶囊释药性能测试
1.6 载药纳米胶囊的抗菌性测试
2 结果与分析
2.1 载药纳米胶囊的合成流程及其形貌和结构表征

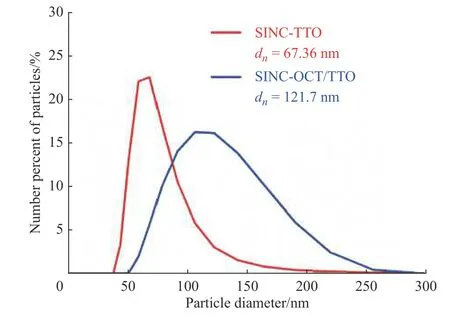

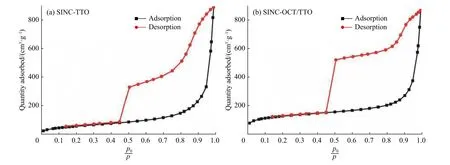

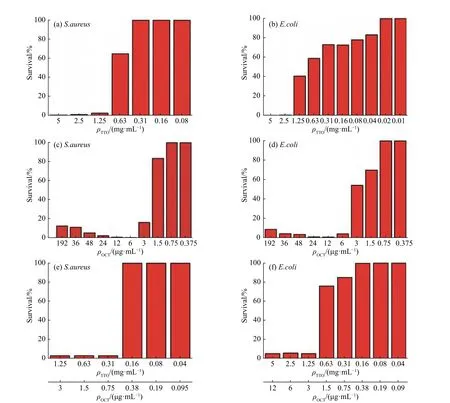
2.2 两种抗菌药物最小抑菌浓度MIC

2.3 纳米胶囊的释药性能研究

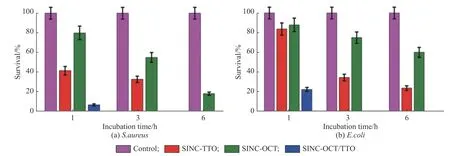
2.4 载药纳米胶囊分散液的抗菌性测试
3 结 论

