WWOX与ERK1在食管鳞状细胞癌中表达及其临床病理意义
张 琼,甘怀勇,武世伍
全球每年新增食管癌病例约46万,死亡约40万,其死亡率居各种恶性肿瘤前列[1]。在我国食管癌是最常见的恶性肿瘤之一,其中约90%的病例为食管鳞状细胞癌。尽管近几十年来各种新技术、新方法不断发展,但食管癌病人总的生存时间并没有明显提高,术后转移和复发是其主要原因。含WW结构域的氧化还原酶(WW domain-containing oxidoreductase,WWOX)是一种抑癌基因,该基因位于人染色体16q23.216q24.1。WWOX基因表达异常在多种肿瘤中均可出现,主要为杂合性缺失和甲基化[2]。细胞外信号调节蛋白激酶1(extracellular signal regulated protein kinase 1,ERK1)是调节细胞生长、增殖及分裂信号网络的关键分子,其通过磷酸化激活后可以从细胞质转到细胞核,并通过诱导其上下游多种相关基因表达,从而促进肿瘤细胞的增殖、浸润和转移[3]。本研究主要通过免疫组织化学EliVisionTMplus法检测150例食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)病人肿瘤组织中WWOX和ERK1蛋白的表达,分析其与ESCC病人临床病理各参数之间的关系。现作报道。
1 资料与方法
1.1 一般资料 收集蚌埠医学院第一附属医院临床病理科2010年1月至2012年6月存档石蜡包埋ESCC组织标本150例(术前未行任何放、化疗及其他抗肿瘤治疗)(ESCC组)和正常食管黏膜组织80例(对照组),所有病人均有完整的临床病理资料及随访资料,入选病人随访至病人死亡或截至2019年1月,根据随访者死亡及失访时间设定随访时间为7~100个月。80例对照组食管黏膜组织均取自远离ESCC肿块>5.0 cm,且均经病理HE染色证实为正常食管黏膜组织。
1.2 试剂 兔抗人多克隆抗体WWOX购自美国Abcam公司;鼠抗人ERK1单克隆抗体购自美国Origen公司;EliVisionTMplus和DAB显色试剂盒均购自中国福州迈新生物技术有限公司。
1.3 方法 所有ESCC标本经4%中性甲醛溶液固定、石蜡包埋,4 μm厚连续切片,于二甲苯溶液及梯度浓度的乙醇溶液中脱蜡至水洗。使用pH值6.0的0.1 mol/L枸橼酸钠作为修复液,高压煮沸20 min,进行抗原修复。一抗原液以1∶100稀释作为实验浓度。免疫组织化学其他操作步骤均按试剂说明书进行,同时采用已知阳性片作对照,采用PBS液替代一抗作为空白对照。
1.4 评价标准 WWOX主要以细胞质内出现黄色或棕黄色颗粒为阳性着色;ERK1主要以细胞核出现黄色或棕黄色颗粒为阳性着色,细胞质也可以着色。阳性结果判定根据有关文献[4]描述方法进行。以积分≥3分为阳性,<3分为阴性。免疫标记结果判定由两位病理医生采用独立双盲法得出。
1.5 统计学方法 采用χ2检验、Spearman相关分析、COX多因素分析及log-rank检验。
2 结果
2.1 ESCC组和对照组WWOX、ERK1蛋白表达比较 ESCC组WWOX和ERK1蛋白的阳性表达率分别为46.0%(69/150)和58.7%(88/150),与对照组的85.0%(68/80)和42.5%(34/80)差异均有统计学意义(χ2=32.96、5.47,P<0.05)(见图1)。Spearman相关分析显示,ESCC组织中WWOX表达与ERK1表达呈明显负相关关系(r=-0.420,P<0.01)。
2.2 ESCC组织中WWOX、ERK1表达与临床病理参数的关系 WWOX蛋白阳性率在不同TNM分期、组织浸润深度和有无淋巴结转移的ESCC病人间差异均有统计学意义(P<0.05~P<0.01);ERK1蛋白阳性率在不同组织分化程度、浸润深度、TNM分期和和有无淋巴结转移的ESCC病人间差异均有统计学意义(P<0.01)(见表1)。
2.3 ESCC病人生存预后的COX多因素分析 将ESCC病人的年龄、性别、肿瘤长径、肿瘤位置、分化程度、淋巴结转移、TNM分期、浸润深度、WWOX表达、ERK1表达等因素纳入COX多因素模型进行分析,结果显示,WWOX和ERK1蛋白阳性表达和TNM分期是影响ESCC病人生存的独立预后因素(P<0.05~P<0.01)(见表2)。
2.4 生存分析 本组病例总的5年生存率为26.7%(40/150)。WWOX蛋白阳性组与阴性组的中位生存时间分别为56.0(35.0,72.0)个月和28.0(18.0,54.5)个月,差异有统计学意义(χ2=3.92,P<0.05);ERK1蛋白阳性组与阴性组的中位生存时间分别为29.5(19.0,51.3)个月和56.5(38.0,74.3)个月,差异无统计学意义(χ2=2.27,P>0.05)。
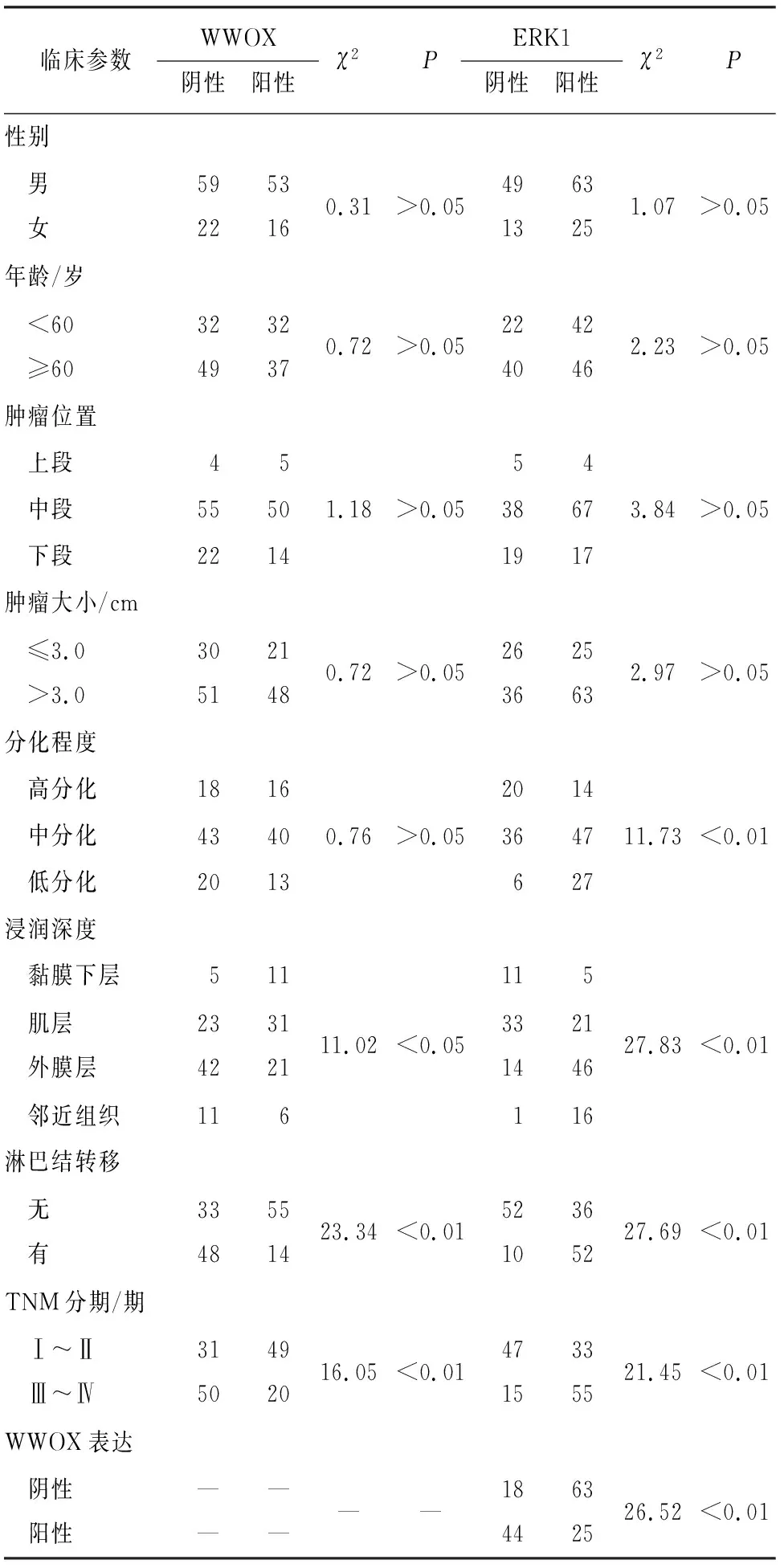
表1 不同临床病理参数ESCC病人的WWOX和ERK1蛋白表达比较(n)
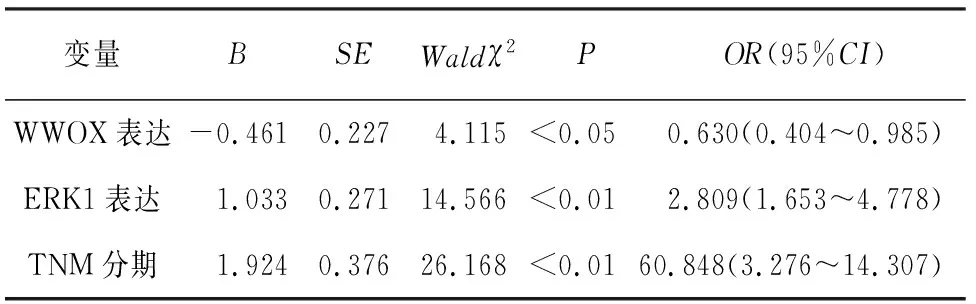
表2 ESCC病人生存预后的COX多因素分析
3 讨论
WWOX基因是一个跨越脆性位点16D的大型基因[5],该基因是抑癌基因,它编码一个WWOX蛋白,在细胞凋亡、细胞代谢以及调节多种相互作用的转录因子方面发挥重要作用[6-8]。WWOX蛋白在大部分正常组织中强表达,但是在多种癌组织中却表达降低或缺失,包括乳腺癌、卵巢癌、膀胱癌、食管癌以及白血病等[6,9-12]。本研究通过免疫组织化学法检测WWOX蛋白在ESCC组织及癌旁正常食管黏膜组织中的表达,结果显示,ESCC组织中WWOX蛋白阳性率明显低于对照组;而在ESCC组织中,随着浸润越深,WWOX蛋白阳性率降低,淋巴结有转移病人的ESCC组织中WWOX蛋白阳性率低于淋巴结无转移者,TNM分期增高,WWOX蛋白阳性率降低。Kaplan-Meier生存分析显示,在WWOX蛋白阳性表达的ESCC病人总生存时间高于其表达阴性者。上述结果提示WWOX的异常表达参与了ESCC的增殖、浸润及转移,且其表达降低意味着病人的预后不良,与相关文献[13]报道一致。
ERK1是MAPK信号通路中的关键成分,其具有丝氨酸/苏氨酸激酶特性,只有当其磷酸化后(p-ERK)才具有活性,而ERK1活化与否决定其在细胞增殖方面发挥的作用[14]。磷酸化的ERK1由细胞质进入细胞核内,从而激活其上下游相关的基因转录,促进细胞的增殖及抑制凋亡,导致细胞异常增殖而最终形成肿瘤。最近有研究者[15]在脑胶质母细胞瘤研究中发现ERK1明显增强,可导致肿瘤细胞异常增生,促进肿瘤生长。有学者[16]研究显示,用二氟甲基鸟氨酸(DFMO)可抑制NMBA诱导的p38α,ERK1/2和AKT/mTOR/p70S6K途径的激活。在NMBA诱导的大鼠模型中,发现DFMO可抑制ERK1通路,并在这些大鼠中被下调,从而进一步阻碍食管鳞状上皮不典型增生向浸润性癌的发展。还有学者[17]发现ESCC中的NONO蛋白水平显着上调,使用siRNA进行NONO耗竭可显著抑制ESCC细胞的增殖,侵袭并促进其凋亡,因为敲低NONO可以降低磷酸化Akt和ERK1的蛋白质水平。此外,ERK1还能促进肿瘤细胞的运动及诱导血管形成,从而促进肿瘤的复发与转移。本研究结果显示,ERK1蛋白在ESCC组织中阳性率高于对照组;且在ESCC组织中,随着ESCC的分化越差、浸润越深、TNM分期越高,ERK1的阳性率越高,淋巴结有转移病人的ERK1阳性率亦高于淋巴结无转移者;生存分析结果也显示,ERK1阳性ESCC病人的总生存时间低于ERK1阴性者。提示ERK1的反常激活促进了ESCC的发生、增殖、浸润及转移,且其阳性表达往往表明病人预后差[18]。
本研究中,Spearman相关分析显示,ESCC组织中WWOX与ERK1表达呈负相关关系。WWOX的表达异常降低或缺失,导致其诱导细胞凋亡的功能丧失,促使细胞异常增殖而导致ESCC的发生。ERK1的异常激活则进一步促进了ESCC发生及增殖[19],其还可以促进MMP的表达而降解基底膜及诱导肿瘤血管形成,最终导致ESCC的浸润及转移。COX多因素分析显示,WWOX和ERK1蛋白阳性表达及TNM分期是影响ESCC病人术后生存时间的独立预后因素。
综上所述,WWOX和ERK1在ESCC组织中的反常表达与ESCC的发生、增殖、浸润及转移相关,ESCC病人早期检测WWOX和ERK1蛋白表达,可作为预测ESCC病人浸润及转移的指标之一。

