淡豆豉多糖及其酶解产物的理化性质和抗氧活性研究
李朋月 朱艳苹 国旭丹 景永帅 郑玉光 吴兰芳
(河北中医学院1,石家庄 050200)(河北省中药炮制技术创新中心2,石家庄 050200)(河北科技大学3,石家庄 050018)
淡豆豉为豆科植物大豆Glycinemax(L.) Merr.成熟种子的发酵加工品,具有良好食用及药用价值,可治疗感冒、寒热头痛、烦躁胸闷、虚烦不眠的症状[1]。淡豆豉中含有大豆异黄酮、多糖等活性成分[2],多糖是由醛基和酮基通过苷键连接的高分子聚合物,目前已经有100多种植物多糖被分离出来应用于临床[3]。
研究表明,经过酶解后的多糖生物活性得到了明显提高。郑岚等[4]通过体外抗氧化实验表明,经纤维素酶、蜗牛酶和硫酸水解的干巴菌多糖的抗氧化能力显著增强。多糖酶解主要是通过改变多糖分子质量、分子结构、黏度及取代基的种类、数量和位置以实现其理化性质的改变、生物活性的增强甚至获得新的生物活性[5];据文献报道,植物多糖具有广泛的生物活性,并表明多糖作为抗氧化剂具有独特的优势[6]。目前鲜见淡豆豉多糖进行纤维素复合酶酶解等的相关报道。
本研究主要对淡豆豉多糖进行提取,利用纤维素复合酶进行修饰,并测定淡豆豉多糖及其纤维素复合酶酶解产物的性质及抗氧化活性,以期为淡豆豉多糖及多糖类成分的修饰和淡豆豉活性成分的开发提供参考。
1 材料与方法
1.1 材料与试剂
淡豆豉、纤维素复合酶:食用级;牛血清蛋白、DPPH、Trolox、AAPH、FL、考马斯亮蓝:分析纯。
1.2 主要仪器与设备
TH-500型梯度混合器,BT-100B型数显恒流泵;UV-2550型紫外分光光度仪,3020-425型多功能微孔板读数仪,1260型高效液相色谱仪。
1.3 实验方法
1.3.1 淡豆豉预处理
取淡豆豉,粉碎,过40目筛,用95%乙醇回流提取2 h,除去脂溶性成分,药渣干燥后,备用。
1.3.2 淡豆豉多糖的提取
取除脂后的淡豆豉粉末,加入20倍体积的蒸馏水提取,在超声波辅助的条件下,55 ℃恒温提取22 min,离心取上清液。淡豆豉残渣重复提取1次,合并滤液。将滤液减压浓缩至一定体积,使用终浓度为80%的乙醇沉淀,抽滤,滤渣挥去酒精后冷冻干燥,得到淡豆豉粗多糖(SSPP)。
1.3.3 淡豆豉多糖的酶解
采用恒温摇床法进行酶解,精密称取2 g淡豆豉多糖,放入具塞锥形瓶中,加纯水搅拌至溶解,调pH至中性,加12%的纤维素复合酶至溶解,在55 ℃恒温摇床中反应1 h。
反应后沸水浴灭活10 min,离心,取上清液用终浓度为80%乙醇进行醇沉,4 ℃静置24 h,抽滤,滤渣挥去酒精后冷冻干燥,得到纤维素复合酶酶解产物SSPP-E。
1.3.4 淡豆豉多糖及其酶解产物糖含量的测定
采用硫酸-苯酚法测定可溶性总糖含量。参照文献[7]方法进行适当改进制定标准曲线,并按该方法在490 nm处测定样品的吸光度值,并代入标准曲线计算可溶性糖含量[8]。
1.3.5 淡豆豉多糖及其酶解产物蛋白质含量的测定
参照文献利用考马斯亮蓝法测定SSPP及SSPP-E中蛋白质含量[8]。
1.3.6 淡豆豉多糖及其酶解产物的紫外-可见光谱分析
精确称取SSPP及SSPP-E样品各1.0 mg,用少量蒸馏水溶解,定容至10 mL的容量瓶中,使其配成质量浓度为0.1 mg/mL的多糖溶液,在200~800 nm波长处进行扫描[9]。检测多糖中是否具有核酸和蛋白质的特征吸收峰。
1.3.7 淡豆豉多糖及其酶解产物的红外光谱分析
精确称取1.0 mg的SSPP及SSPP-E样品,以KBr混合研磨成极细粉末,压片,在4 000~400 cm-1范围内进行红外光谱扫描[10]。检测样品中是否存在多糖的特征吸收峰。
1.3.8 淡豆豉多糖及其酶解产物的单糖组成分析
参照文献对淡豆豉多糖及其酶解产物的单糖组成进行测定[11,12]。
1.3.9 淡豆豉多糖及其酶解产物的抗氧化活性测定
1.3.9.1 DPPH活性的测定
参照Karagozler A A等[13]的方法。
1.3.9.2 羟基自由基的测定
参考许效群等[14]方法。将每个样品浓度平行测定3次,计算平均值,通过式(1)计算清除率:
(1)
式中:K为清除率/%;A1为多糖样品的吸光度;A2为本底吸光度;A0为空白对照的吸光度。
1.3.9.3 ORAC的测定
参考Lin Lianzhu等[15]方法进行测定。ORAC实验需要设定两种对照,即没有添加AAPH的FL荧光自然衰减对照和没有抗氧化剂存在时的AAPH作用对照。
样品的抗氧化能力与自由基作用下荧光衰退曲线的延缓部分面积(Net AUC)直接相关[16],计算ORAC值。
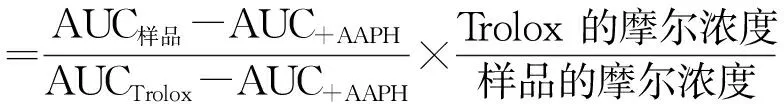
(2)
2 结果
2.1 淡豆豉多糖的提取率
除脂后的淡豆豉粉末经超声波辅助水提后,用乙醇沉淀,沉淀干燥得到淡豆豉粗多糖(SSPP),提取率为4.59%。
2.2 淡豆豉多糖的酶解得率
取2 g的SSPP通过纤维素复合酶进行恒温摇床酶解,得到SSPP-E,酶解得率为58.0%。
2.3 可溶性总糖含量测定
以葡萄糖做标准品,通过曲线得回归方程为y=12.1x+0.151 6 (R2=0.992 7),通过计算可得,SSPP和SSPP-E可溶性总糖含量分别为68.88%和55.08%。
2.4 蛋白含量的测定
以牛血清蛋白做标准品,得方程y=7.312 9x+0.703 5 (R2=0.992 0),SSPP和SSPP-E的蛋白含量分别为4.03%和0.19%。
2.5 紫外-可见光谱分析
由图1可知,吸收峰主要在260~280 nm之间,说明SSPP、SSPP-E内可能含有少量蛋白质或核酸等成分,和蛋白测定结果相一致。

图1 SSPP和SSPP-E的紫外-可见光谱结果图
2.6 红外光谱分析

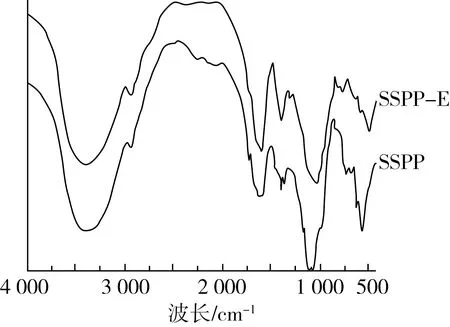
图2 SSPP和SSPP-E红外光谱结果图
2.7 SSPP和SSPP-E的单糖组成分析
为了进一步研究酶解前后的单糖组成变化,采用PMP衍生化HPLC法进行单糖组成测定。
根据图3~图5可知,SSPP单糖组成的摩尔比∶甘露糖∶葡萄糖醛酸∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖为0.05∶0.14∶0.13∶0.26∶0.18∶0.24;SSPP-E单糖组成的摩尔比∶甘露糖∶葡萄糖醛酸∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖为0.08∶0.18∶0.12∶0.18∶0.21∶0.23。从单糖组成来看,组成SSPP和SSPP-E的单糖组成一致,但是单糖的摩尔比发生了变化,甘露糖、葡萄糖、木糖的含量增加,葡萄糖、半乳糖含量减小,阿拉伯糖量基本不变。这可能是因为在酶解修饰过程中,一些支链从糖链上断裂,导致单糖比例发生变化。
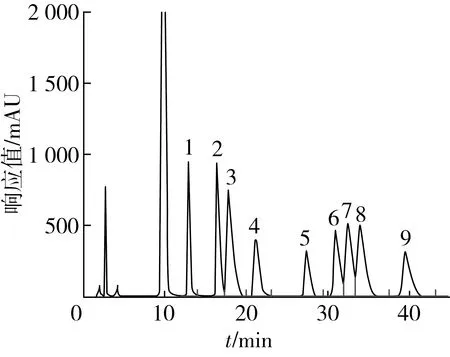
注:1 甘露糖;2 鼠李糖;3 半乳糖醛酸;4 葡萄糖醛酸;5 葡萄糖;6 半乳糖;7 木糖;8 阿拉伯糖;9 果糖。图3 标准品的PMP衍生物HPLC图谱

注:1 露糖;2 葡萄糖醛酸;3 葡萄糖;4 半乳糖;5 木糖;6 阿拉伯糖。图4 SSPP的PMP衍生物HPLC图谱
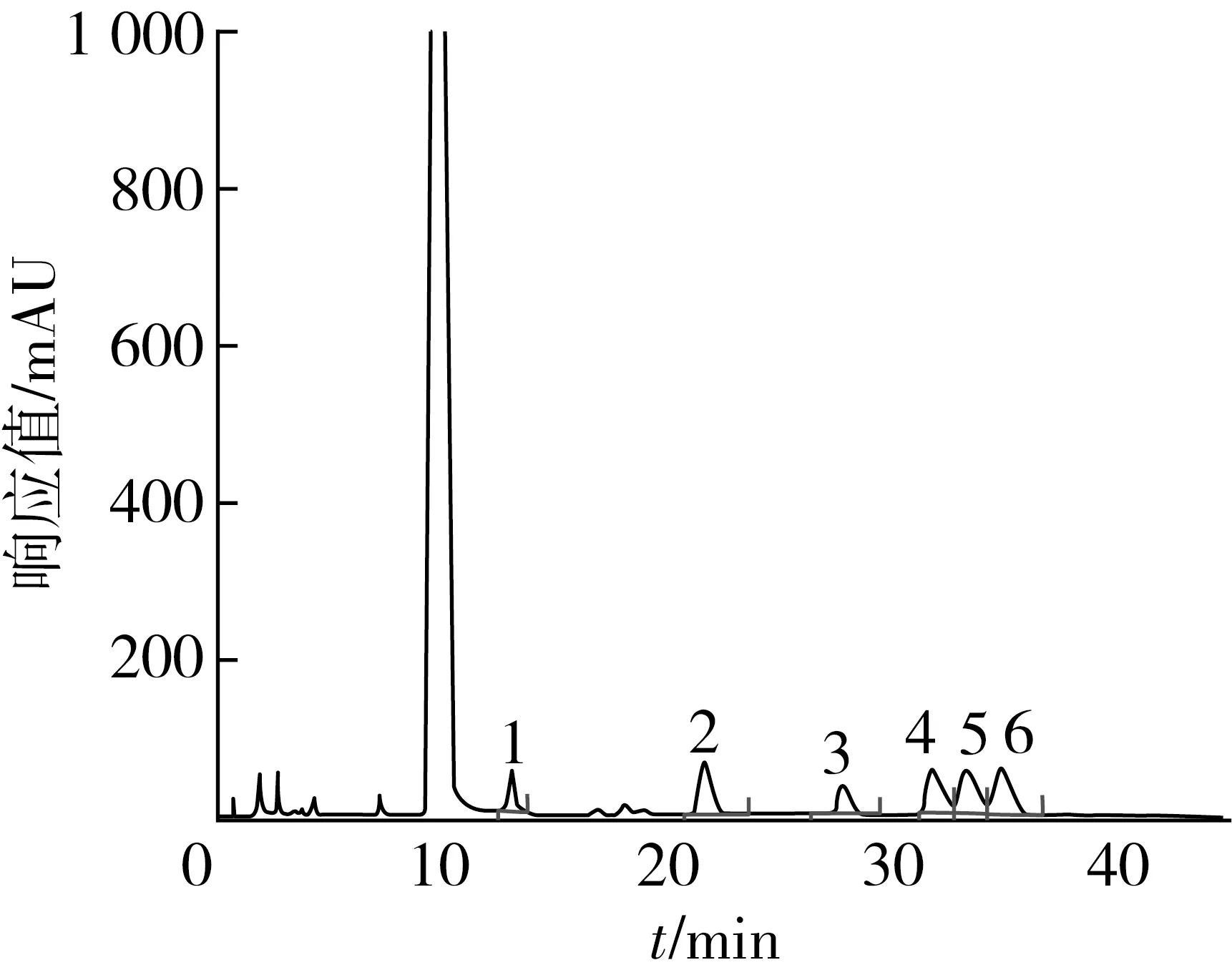
注:1 甘露糖;2 葡萄糖醛酸;3 葡萄糖;4 半乳糖;5 木糖;6 阿拉伯糖。图5 SSPP-E的PMP衍生物HPLC图谱
2.8 淡豆豉多糖及酶解产物的抗氧化活性测定
2.8.1 清除DPPH自由基活性
由图6可知,在一定的质量浓度范围内,样品质量浓度和清除率成一定的量效关系。在浓度为4 mg/mL时SSPP清除率为41.95%,SSPP-E的清除率为55.20%。通过计算IC50值得出,SSPP的IC50值为4.842 mg/mL,SSPP-E的IC50值为3.574 mg/mL,通过方差分析表明P<0.001,具有极显著差异,说明酶解有利于提高淡豆豉多糖清除DPPH自由基的活性。

图6 SSPP和SSPP-E清除DPPH自由基活性结果图
2.8.2 清除羟基自由基的活性
由图7可知,在一定的质量浓度范围内,样品质量浓度和清除率成正比关系,各样品均呈现良好的线性关系。浓度为1.8 mg/mL时,SSPP的清除率为82.52%,SSPP-E为84.22%。田崇梅等[18]在黄芪多糖体外抗氧化性研究中得出当蒙古黄芪多糖的质量浓度为2 mg/mL时其清除率为85%,其研究与本实验结果相差不大。通过计算IC50值得出,SSPP的IC50值为1.099 mg/mL,SSPP-E的IC50值为1.041 mg/mL,通过方差分析无显著性差异(P>0.05),说明在清除羟基自由基的活性时,淡豆豉多糖酶解产物与未酶解组差异不大。

图7 SSPP和SSPP-E清除羟基自由基活性结果图
2.8.3 ORAC的测定
对ORAC测定运用统计分析,采用Origin 8.0软件作图分析。
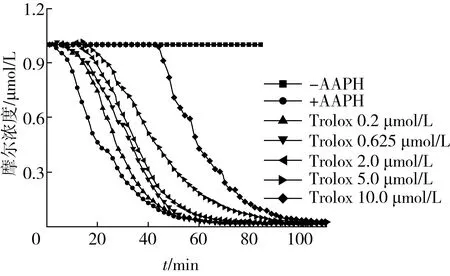
图8 不同浓度的Trolox荧光衰退动力学曲线图
通过计算不同摩尔浓度的Trolox与净AUC值之间的线性关系得到方程:y=0.312 4x-1.625 9(R2=0.995 2),由结果可知标准曲线的相关性较高。

表1 SSPP和SSPP-E的ORAC值
由表1可以看出,酶解后有利于ORAC值的升高,在样品质量浓度为0.005 mg/mL时,SSPP和SSPP-E的ORAC值分别为1 492.16和2 123.90 μmol TE/g,方差分析表明P<0.001,具有极显著差异,从结果可以看出,酶解有利于淡豆豉多糖氧自由基吸收能力的提高。
通过抗氧化活性测定结果表明:SSPP经过酶解后,其抗氧化活性得到增强。
3 结论
通过提取淡豆豉多糖,并对其进行酶解,通过比较酶解前后的理化性质及体外抗氧化活性得出:1)SSPP和SSPP-E均具有多糖的典型特征吸收峰,经过酶解后,SSPP-E的可溶性总糖含量、蛋白含量、单糖组成的摩尔比发生了变化。2)经过酶解后,体外抗氧化活性得到一定程度的提高。
淡豆豉多糖经过酶解后其体外活性有所提高,可能是因为部分蛋白被除去,暴露了更多的活性基团(如葡萄糖醛酸或其他结合的小分子化合物),或者是酶解使得淡豆豉降解为分子质量较低的多糖,分子质量减小之后有利于多糖空间结构的舒展和与自由基的结合,提高抗氧化的能力,但具体的性质与活性之间的关系如何,有待进一步研究。

