雪胆多糖提取工艺优化及其抗氧化活性分析
邱磊 张蓉 赵艳 段柯兆 杨生超 张广辉
摘要:【目的】優化雪胆水溶性和水不溶性多糖提取工艺,并分析其抗氧化活性,为雪胆多糖的开发利用提供参考依据。【方法】采用热水浸提法提取雪胆水溶性多糖、碱液浸提法提取雪胆水不溶性多糖,以多糖提取率为考察指标,通过单因素试验和正交试验优化2种雪胆多糖的提取工艺条件,同时测定雪胆多糖清除羟基自由基(·OH)、1,1-二苯基-2-三硝基苯肼(DPPH)自由基和超氧阴离子(O-2·)的能力及还原能力。【结果】影响热水浸提雪胆水溶性多糖的因素排序为提取温度>料液比>提取时间,最佳提取工艺条件为:料液比1∶16、提取温度80 ℃、提取时间2.0 h,在此条件下,雪胆水溶性多糖提取率为(28.70±0.63)%;影响碱液浸提雪胆水不溶性多糖的因素排序为料液比>提取温度>提取时间,最佳提取条件为:料液比1∶18、提取温度70 ℃、提取时间2.0 h,在此条件下,雪胆水不溶性多糖提取率为(31.43±0.42)%。雪胆水溶性多糖和水不溶性多糖对·OH和DPPH自由基均有较好的清除效果,2种雪胆多糖质量浓度为0.5 mg/mL时,对DPPH自由基的清除率在50.00%以上,质量浓度为0.1 mg/mL时,对·OH的清除率在50.00%以上;此外,2种多糖具有良好的还原能力和清除O[-2]·能力,均随多糖质量浓度的增加而增强。【结论】采用正交试验优化获得雪胆水溶性多糖热水浸提工艺和雪胆水不溶性多糖碱液浸提工艺,提取操作简便,方法可行,提取的2种多糖均具有较强的抗氧化活性,可作为天然抗氧化资源加以利用。
关键词: 雪胆;水溶性多糖;水不溶性多糖;提取工艺优化;活性测定
中图分类号: S567.239 文献标志码: A 文章编号:2095-1191(2020)08-2020-08
Optimization of extraction process of polysaccharides from Hemsleya chinensis and its antioxidant activity
QIU Lei1, ZHANG Rong1, ZHAO Yan1,2*, DUAN Ke-zhao3, YANG Sheng-chao1,
ZHANG Guang-hui1
(1The Key Laboratory of Medicinal Plant Biology of Yunnan Province/National & Local Joint Engineering Research Center on Germplasm Innovation & Utilization of Chinese Medicinal Materials in Southwestern China, Yunnan Agricultural University,Kunming 650201,China; 2College of Agriculture and Biotechnology, Yunnan Agricultural University, Kunming 650201, China; 3Yunnan Kezhao Biological Technology Co., Ltd., Kunming 650201, China)
Abstract:【Objective】To optimize the extraction of water-soluble and water-insoluble polysaccharides from Hemsleya chinensis, analyze its antioxidant activity, and provide a theoretical basis for the further development and utilization of polysaccharides from H.chinensis. 【Method】The water-soluble polysaccharides of H.chinensis were extracted by hot water extraction and water-insoluble polysaccharides of H.chinensis were extracted by alkali extraction. Based on the single factor test and orthogonal experiment, the content of water-soluble polysaccharide and water-insoluble polysaccharide were optimized respectively. Then hydroxyl radical(·OH) scavenging ability,1,1-diphenyl-2-picrylhydrazyl radical (DPPH) scavenging ability,superoxide anion(O[-2]·) scavenging ability and reducing power were analyzed. 【Result】The order of factors affecting the extraction of water-soluble polysaccharide from H.chinensis by hot water extraction were as follows:extraction temperature>solid-liquid ratio>extraction time,and the optimal extraction conditions of water-soluble polysaccharide of H.chinensis were as follow: the solid-liquid ratio was 1∶16,and the extraction temperature was 80 ℃,the extraction time was 2.0 h. Under this condition, the extraction rate of water-soluble polysaccharide was (28.70±0.63)%. The order of factors affecting the extraction of insoluble polysaccharides of H.chinensis by alkali extraction were as follow:solid-liquid ratio>extraction temperature>extraction time,and the best extraction conditions of insoluble polysaccharides of H.chinensis were as follow: the ratio of material to liquid was 1∶18, the extraction temperature was 70 ℃,the extraction time was 2.0 h. Under this condition, the extraction rate of water-insoluble polysaccharide was (31.43±0.42)%. The experimental results showed that two kinds of polysaccharide of H.chinensis on ·OH and DPPH free radical clearance had good effect. When the H.chinensis polysaccharide concentration was 0.5 mg/mL,the DPPH free radical clearance rate reached over 50.00%,when polysaccharide concentration was 0.1 mg/mL,the ·OH free radical clearance rate reached more than 50.00%. At the same time,the results showed that two kinds of polysaccharide had good ability associated with reduction capacity and O[-2]· scavenging, and the ability strengthened as the mass concentration of polysaccharide increased. 【Conclusion】The orthogonal experimental optimized H. chinensis water-soluble polysaccharide hot water extraction process and water-insoluble polysaccharide lye extraction process are simple and feasible,and soluble polysaccharide and insoluble polysaccharide from H. chinensis both have strong antioxidant activity,which can be used as natural antioxidant resources.
Key words: Hemsleya chinensis; water-soluble polysaccharide; water-insoluble polysaccharide; extraction process optimization; activity determination
Foundation item: National Natural Science Foundation of China(81960691,81760694); Yunnan Science and Technology Major Project(2018ZF011,2019ZF011)
0 引言
【研究意义】雪胆(Hemsleya chinensis)是葫芦科雪胆属植物,主要分布于我国西南的热带和亚热带地区,集中分布地区包括云南及四川的东南部(Li et al.,2010)。雪胆具有抗菌、抗炎等生物活性,为民间习用药材,收载于《云南中草药》《全国中草药汇编》,临床上常用于治疗胃肠炎和急性扁桃体炎等疾病(李莹等,2015),具有很高的药用价值。有研究表明,雪胆块茎中含有多糖,但不同产地及不同生长期的含量差异明显(杨王伟等,2014)。多糖是由多个相同或不同单糖间脱水形成的一类结构复杂的大分子聚合物,广泛存在于各种动植物体中,是一类最丰富的天然产物,具有抗氧化、抗菌及抗病毒等多种生物活性(万芳等,2019;钟丽霞等,2019)。来源于植物或真菌中的β-(1→3)-葡聚糖普遍被认为具有免疫调节及抗肿瘤活性,而α-(1→3)-葡聚糖存在于细胞壁中,大多数不溶于水,且难以通过热水浸提法进行提取,常被认为没有生物学功能,对其研究较少,但可利用碱或酸溶液进行处理,获得细胞壁内层的多糖组分。因此,优化水提法和碱提法提取雪胆的2种多糖,对全面了解雪胆多糖活性,以及充分利用和挖掘雪胆资源均具有重要意义。【前人研究进展】雪胆的化学成分及药理研究已受到广泛关注,国内外学者对雪胆属10余种植物进行了详细研究,结果发现有50余种葫芦烷型四环三萜,如雪胆甲素和雪胆乙素等(Chen et al.,2005,2012;Xu et al.,2014),以及20余种齐墩果烷型五环三萜类化合物,如雪胆皂苷A和雪胆皂苷B等(Chen et al.,2003;林玉萍等,2003;徐金中等,2009);丰富的雪胆三萜类化合物具有抗HIV(Tian et al.,2008)、抗菌、抗炎(Zhi et al.,2008)和抗肿瘤(高申等,2012)等生物活性。关于雪胆有效成分的提取,喻世涛等(2006)以萃取压力、温度和时间为考察因素,通过正交试验优化获得超临界CO2流体萃取中华雪胆中齐墩果酸的最佳工艺条件(萃取压力40 MPa,萃取温度55 ℃,无水乙醇为夹带剂,用量5%,萃取时间2 h,CO2流量20 kg/h);周旋(2015)以水为提取溶剂,利用超声方法预处理雪胆,获得了超声优化提取雪胆素的最佳工艺条件(温度55 ℃,溶液pH 4.0,超声时间90 min),并有效缩短了结晶时间。【本研究切入点】至今,已有学者对雪胆的化学成分提取物及活性开展了研究,但有关雪胆水溶性多糖和水不溶性多糖的提取及其抗氧化活性研究尚无文献报道。【拟解决的关键问题】以提取率为考察指标,在单因素试验的基础上,通过3因素3水平正交试验优化热水浸提雪胆水溶性多糖、稀碱溶液提取雪胆水不溶性多糖的工艺条件,并测定比较2种多糖清除羟基自由基(·OH)、1,1-二苯基-2-三硝基苯肼(DPPH)自由基和超氧阴离子(O[-2]·)的活性及还原能力,为雪胆高附加值副产物的挖掘及利用提供参考依据。
1 材料与方法
1. 1 试验材料
雪膽采自云南柯兆生物科技有限公司雪胆种植基地,经云南农业大学杨生超教授鉴定。粉碎过100目筛,密封于干燥器中备用。无水乙醇、苯酚和葡萄糖购自天津市风船化学试剂科技有限公司;氯仿、正丁醇和浓硫酸购自重庆川东化工(集团)有限公司;冰醋酸、氢氧化钠、硫酸亚铁、水杨酸钠、铁氰化钾、三氯乙酸和三氯化铁购自西陇化工股份有限公司;以上试剂均为分析纯。DPPH购自Sigma公司。主要仪器设备:722S型可见分光光度计(上海菁华科技仪器有限公司)、DRHH型数显恒温水浴锅(上海双捷实验设备有限公司)、DC-600高速多功能粉碎机(武义县鼎藏日用金属制品厂)和电子天平(北京赛多利斯天平有限公司)。
1. 2 试验方法
1. 2. 1 雪胆水溶性多糖提取及样品制备 称取雪胆粉末5.00 g,按样品与水1∶16的料液比,提取温度设为80 ℃,热水浸提时间设为2.0 h,重复提取3次(因试验中发现增加提取次数,提取率有显著增加趋势,故采用重复3次,下同)后,离心收集上清液,滤渣用于水不溶性多糖提取。通过旋转蒸发仪浓缩上清液至100 mL左右,加入活性炭进行脱色,经振荡离心去除沉淀后,加入5倍Sevage液(氯仿∶正丁醇=5∶1),经20 min振荡并离心取上清液,加入1倍体积的无水乙醇混匀,放入4 ℃冰箱静置12 h后,醇沉淀液2500 r/min离心3 min,沉淀物在80 ℃鼓风干燥箱中烘干,即为雪胆水溶性多糖。
1. 2. 2 雪胆水不溶性多糖提取及样品制备 取1.2.1的滤渣置于圆底烧瓶中,按滤渣与5%氢氧化钠溶液1∶16的料液比、提取温度设为70 ℃、提取时间设为2.0 h,重复提取3次后,离心弃沉淀,得到的上清液中加入冰醋酸溶液进行中和,离心弃上清液,沉淀经干燥后为雪胆水不溶性粗多糖。用3%氢氧化钠溶解,加入活性炭进行脱色,经振荡离心去除沉淀,在上清液中加入5倍Sevage液(氯仿∶正丁醇=5∶1),经20 min振荡并离心收集上清液,加入1倍体积的无水乙醇混匀,置于4 ℃冰箱12 h,离心后得到的沉淀物干燥即为雪胆水不溶性多糖。
1. 2. 3 雪胆多糖提取率测定 准确称取0.10 g干燥至恒重的无水葡萄糖对照品,加蒸馏水制成0.20 mg/L对照品溶液。吸取对照品溶液分别稀释为0.04、0.08、0.12和0.16 mg/mL的梯度溶液;分别吸取上述溶液1 mL与等体积的5%苯酚溶液混合,再加入8 mL浓硫酸摇匀,于40 ℃水浴中保温30 min,室温冷却,以加入蒸馏水的空白溶液作对照,在486 nm处测其吸光值。根据葡萄糖标准曲线计算多糖质量浓度和提取率:
提取率(%)=(C×V×m1×100)/(m×1000)
式中,C为提取液中多糖质量浓度(μg/mL),V为定容体积(mL),m1为提取多糖重量(g),m为样品重量(g)。
1. 2. 4 单因素试验
1. 2. 4. 1 雪胆水溶性多糖单因素试验 称取雪胆粉末5.00 g,按照1.2.1的方法提取雪胆水溶性多糖:在固定提取温度80 ℃、料液比1∶16的条件下,分别提取1.0、1.5、2.0、2.5和3.0 h;在固定提取温度80 ℃、提取时间2.0 h的条件下,分别以1∶12、1∶14、1∶16、1∶18和1∶20的料液比提取;在固定料液比1∶16、提取时间2.0 h的条件下,分别在50、60、70、80和90 ℃下提取。每组试验平行3次,考察单因素对雪胆水溶性多糖提取率的影响。
1. 2. 4. 2 雪胆水不溶性多糖单因素试验 按照1.2.2的方法提取雪胆水不溶性多糖:在固定提取温度70 ℃、料液比1∶16的条件下,分别提取1.0、1.5、2.0、2.5和3.0 h;在固定提取温度70 ℃、提取时间2.0 h的条件下,分别以1∶12、1∶14、1∶16、1∶18和1∶20的料液比提取;在固定料液比1∶16、提取时间2.0 h的条件下,分别在50、60、70、80和90 ℃下提取。每组试验平行3次,考察单因素对雪胆水不溶性多糖提取率的影响。
1. 2. 5 正交试验 在单因素试验的基础上,以雪胆水溶性多糖和水不溶性多糖的提取率为考察指标,选择提取时间、提取温度和料液比为考察因素(表1),设计L9(33)正交试验。
1. 2. 6 雪胆多糖清除·OH能力测定 配制不同浓度梯度雪胆水溶性多糖和水不溶性多糖溶液,分别吸取2 mL,加入9 mmol/L硫酸亚铁溶液和9 mmol/L过氧化氢溶液各2 mL混匀,置于黑暗处反应20 min,再加入2 mL的9 mmol/L水杨酸钠溶液,静置反应20 min后,于510 nm波长处测定吸光值A1,以水代替多糖溶液测定吸光值A0,以水代替过氧化氢溶液测定吸光值A2,以同等浓度梯度抗坏血酸溶液为对照。根据下式计算·OH清除率:
·OH清除率(%)= (1-[(A1-A2)/A0])×100
1. 2. 7 雪胆多糖清除DPPH自由基能力测定 配制不同浓度梯度雪胆水溶性多糖和水不溶性多糖溶液,分别吸取2 mL,与2 mL的0.2 mmol/L DPPH-无水乙醇溶液混匀,黑暗处静置30 min,于517 nm波长处测定吸光值A1,以水代替多糖溶液测定吸光值A0,以乙醇溶液代替DPPH溶液测定吸光值A2,以同等浓度梯度抗坏血酸溶液为对照。根据下式计算DPPH自由基清除率:
DPPH自由基清除率(%)=(1-[(A1-A2)/A0])×100
1. 2. 8 雪胆多糖清除O[-2]·能力测定 配制不同浓度梯度雪胆水溶性多糖和水不溶性多糖溶液,分别吸取0.2 mL,加入5.7 mL的50 mmol/L Tris-HCl緩冲液(pH 8), 25 ℃反应20 min,再加入0.1 mL的6 mmol/L邻苯三酚溶液,静置反应5 min,于360 nm波长处测定吸光值A2,以水代替多糖溶液测定吸光值A1,以同等浓度梯度抗坏血酸溶液为对照。根据下式计算O[-2]·清除率:
O[-2]·清除率(%)=[(A1-A2)/A1]×100
1. 2. 9 雪胆多糖还原能力测定 配制不同浓度梯度雪胆水溶性多糖和水不溶性多糖溶液,分别吸取2种多糖溶液1 mL与1 mL的2 mol/L磷酸缓冲液(pH 6.6)混合,再加入1%铁氰化钾溶液和10%三氯乙酸溶液各1 mL,静置反应20 min后,加入0.1%三氯化铁溶液0.25 mL,最后加入蒸馏水2 mL,静置反应20 min,于360 nm波长处测定吸光值,以同等浓度梯度抗坏血酸溶液为对照。
1. 3 统计分析
采用Excel 2013整理数据,以SPSS 20.0中的LSD法进行差异显著性分析,并用SigmaPlot 12.5作图。
2 结果与分析
2. 1 葡萄糖标准曲线绘制结果
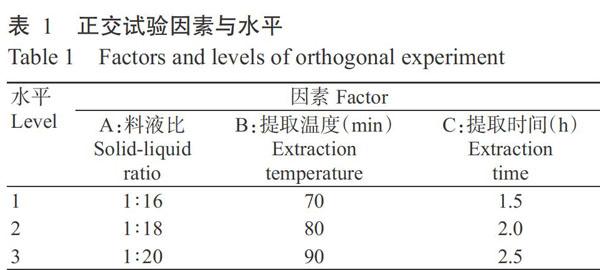
以吸光值(y)为纵坐标、葡萄糖对照品质量浓度(x)为横坐标,绘制葡萄糖标准曲线(图1),其线性方程为y=8.12x+0.01(R2=0.9997)。
2. 2 单因素试验结果
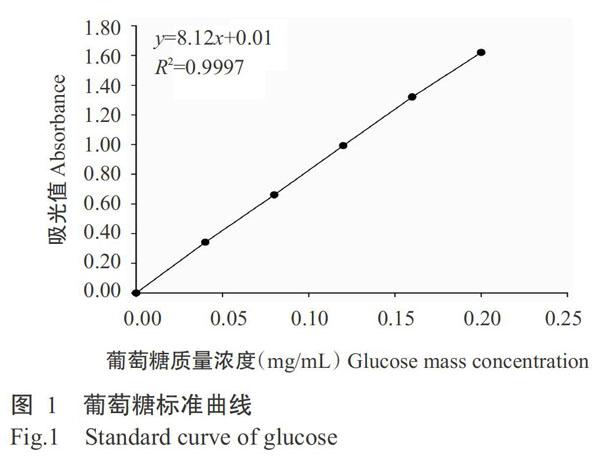
2. 2. 1 提取时间对雪胆多糖提取效果的影响 从图2可看出,雪胆水溶性多糖提取率随提取时间的延长呈先上升后下降的变化趋势,当提取时间为2.0 h时,雪胆水溶性多糖提取率达最大值(11.70%),显著高于1.0、1.5和3.0 h的提取率(P<0.05,下同);而雪胆水不溶性多糖提取率随提取时间的延长呈显著上升趋势,当提取时间为3.0 h时,雪胆水不溶性多糖提取率为3.19%,较2.0 h的提取率(2.66%)增加19.92%。从能源损耗等因素考虑,雪胆水溶性多糖和水不溶性多糖的提取时间以2.0 h为宜。
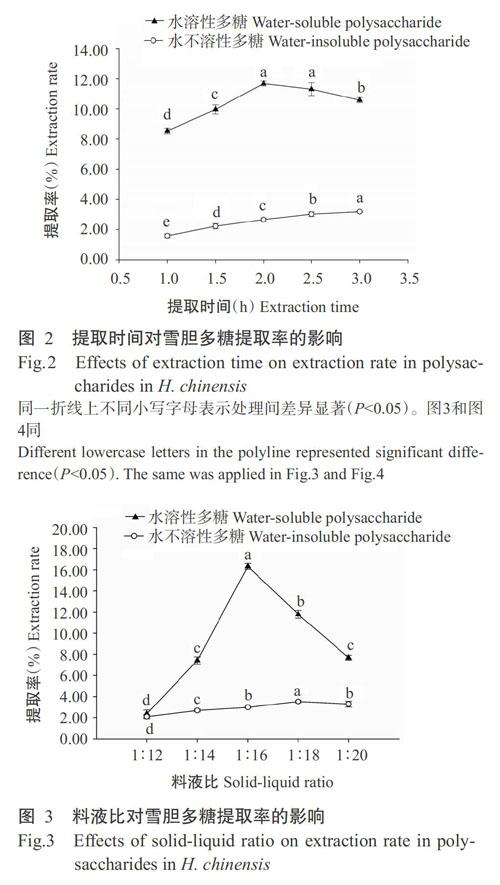
2. 2. 2 料液比对雪胆多糖提取效果的影响 由图3可知,雪胆水溶性多糖提取率随着料液比的减小呈先上升后下降的变化趋势,料液比为1∶16时,提取率达最大值(16.12%);雪胆水不溶性多糖提取率随料液比的减小呈缓慢上升趋势,当料液比达1∶18后,雪胆水不溶性多糖提取率略有下降。随着提取溶剂体积的增大,雪胆多糖提取率增加,同时综合考虑成本等因素,雪胆水溶性多糖和水不溶性多糖提取的料液比选择1∶18为宜。
2. 2. 3 提取温度对雪胆多糖提取效果的影响 由图4可知,雪胆水溶性多糖提取率随提取温度的升高呈先上升后下降的变化趋势,当提取温度达80 ℃时,提取率达最大值(9.90%),显著高于其他提取温度的提取率,超过80 ℃后,雪胆水溶性多糖提取率有所下降;而雪胆水不溶性多糖提取率随提取温度的升高呈先显著上升后趋于平稳的变化趋势,当提取温度达70 ℃后,雪胆水不溶性多糖提取率无显著变化(P>0.05),提取温度为80 ℃时达最大值(2.22%)。高温有可能造成多糖结构稳定性的降低。因此,雪胆水溶性多糖和水不溶性多糖的提取温度选择80 ℃较合适。
2. 3 雪胆多糖提取正交试验优化结果
雪胆水溶性多糖提取正交试验结果见表2,从表中可知影响热水浸提雪胆水溶性多糖的因素排序为提取温度>料液比>提取时间;根据正交试验k值结果,雪胆水溶性多糖提取的理论优化方案为A2B2C2,但根据生产实际及水溶性多糖提取率的综合考虑,选择优化组合为A1B2C2,即料液比1∶16、提取温度80 ℃、提取时间2.0 h。进行最佳工艺条件验证,称取雪胆粉末10.00 g,在料液比1∶16、提取溫度80 ℃的条件下回流提取2.0 h,提取结束对提取液进行抽滤,测定雪胆水溶性多糖提取率。经3次验证试验,得到雪胆水溶性多糖提取率为(28.70±0.63)%,说明该工艺组合提取效果较稳定。
雪胆水不溶性多糖提取正交试验结果见表3,从表中可知影响碱液浸提雪胆水不溶性多糖的因素排序为料液比>提取温度>提取时间,筛选出最佳工艺组合为A2B1C2,即料液比1∶18、提取温度70 ℃、提取时间2.0 h。尽管雪胆水不溶性多糖最佳工艺组合出现在正交试验设计中,但仍有必要对获得的最佳工艺条件进行验证。称取雪胆粉末10.00 g,以1.2.2的方法提取雪胆水不溶性多糖,在料液比1∶18、提取温度70 ℃的条件下回流提取2.0 h,测定雪胆水不溶性多糖提取率。经3次验证试验,得到雪胆水不溶性多糖提取率为(31.43±0.42)%,说明该工艺组合提取效果较稳定。
2. 4 雪胆多糖活性测定结果
2. 4. 1 雪胆多糖清除·OH能力测定结果 由图5可知,雪胆水溶性多糖对·OH的清除率稍低于抗坏血酸,在0.5~0.7 mg/mL质量浓度区间的量效关系较好,表明雪胆水溶性多糖对·OH具有良好的清除能力,清除率最高可达83.33%;在0.2 mg/mL后,雪胆水不溶性多糖对·OH的清除率与质量浓度呈良好的线性关系,随着样品质量浓度的升高,雪胆水不溶性多糖和抗坏血酸对·OH的清除能力增强趋势明显,表明雪胆水不溶性多糖对·OH有较强的清除能力。
2. 4. 2 雪胆多糖清除DPPH自由基能力测定结果
由图6可知,雪胆水溶性多糖在0.1~0.5 mg/mL范围内随着质量浓度的增加对DPPH自由基的清除能力也逐渐增强,0.5 mg/mL之后雪胆水溶性多糖对DPPH自由基的清除能力趋于平稳,与抗坏血酸相比,雪胆水溶性多糖对DPPH自由基的清除能力在0.5 mg/mL之后差距变大,但其在一定质量浓度范围内对DPPH自由基具有良好的清除能力;雪胆水不溶性多糖对DPPH自由基的清除能力随多糖质量浓度的增加而加强,具有良好的量效关系,雪胆水不溶性多糖对DPPH自由基有较强的清除能力。
2. 4. 3 雪胆多糖清除O[-2]·能力测定结果 由图7可知,雪胆水溶性多糖对O[-2]·的清除率低于抗坏血酸,但总体上随样品质量浓度的增加而逐渐增强,表明雪胆水溶性多糖具有一定的O[-2]·清除能力;雪胆水不溶性多糖对O[-2]·的清除能力稍弱于抗坏血酸,但总体上呈现出随样品质量浓度的增加而逐渐增强的变化趋势,表明雪胆水不溶性多糖具有一定的O[-2]·清除能力,且稍强于雪胆水溶性多糖。
2. 4. 4 雪胆多糖还原能力测定结果 由图8可知,雪胆水溶性多糖和水不溶性多糖的还原能力均随样品质量浓度的增加而逐渐增强,其中雪胆水不溶性多糖的还原能力稍强于水溶性多糖,但二者均弱于抗坏血酸。
3 讨论
提取多糖的方法主要有溶剂提取、酶解、超声波辅助提取、微波辅助提取和超临界辅助提取等(李瑶佳,2019),其中溶剂提取法操作简便,条件温和,对仪器设备要求低,是目前工业上提取多糖应用最多的一种方法(朱玲等,2017),被广泛用于植物多糖的提取,如羊肚菌多糖提取(周益帆等,2019)、芒果皮渣多糖提取(赵巧丽等,2019)等。本研究采用热水浸提法提取雪胆水溶性多糖、碱液提取法提取雪胆水不溶性多糖,在单因素试验的基础上,利用正交试验优化得到2种雪胆多糖提取最佳工艺条件。在单因素试验中,延长提取时间,雪胆水溶性多糖随时间的变化呈先上升后下降趋势,而雪胆水不溶性多糖的提取率呈不断增加趋势,可能是由于2种雪胆多糖随提取时间的延长而不断溶解于提取溶剂水或碱性溶液中,导致一定时间范围内多糖提取率不断提高。料液比也会影响多糖提取率,提取获得的雪胆水溶性多糖随料液比减小呈先升高后降低的变化趋势,而水不溶性多糖随料液比减小而逐渐趋于稳定,推测是由于料液比高时,雪胆水不溶性多糖在溶剂中的溶解度早已达到饱和,从而抑制了剩余雪胆水不溶性多糖的释放。此外,提取温度也影响雪胆多糖提取率,因为提取温度过低时,雪胆多糖在溶剂中的溶解度也低,从而抑制了剩余雪胆水溶性多糖的释放,而当高温时可能降低多糖结构的稳定性。
利用DPPH法、·OH清除法、O[-2]·清除法和还原能力测定法评价植物有效成分的抗氧化作用,因操作简便、快速、有效而应用广泛。本研究通过测定雪胆水溶性多糖和水不溶性多糖对·OH、DPPH自由基和O[-2]·的清除能力及还原能力,并与抗坏血酸对比,发现2种雪胆多糖均具有较强的自由基清除能力和还原能力,能有效清除·OH、DPPH自由基和O[-2]·,且清除能力与还原能力随多糖样品质量浓度的升高而增强,其中雪胆水不溶性多糖的抗氧化活性明显高于水溶性多糖。相关研究表明,中草药提取物如中草药多糖作为饲料添加剂,能有效改善动物肠道微生物区系,提高免疫力(刘惠,2007)。僧晓兰(2016)以峨眉雪胆原料制备成微丸,作为中草药饲料添加剂能增强断奶仔猪的抗氧化能力,显著增加血清超氧化物歧化酶(SOD)活性,且有长时间的持续影响,同时能提高仔猪谷胱甘肽(GSH)活性,在一定程度上降低丙二醛(MDA)含量。因此,本研究结果可为雪胆水不溶性多糖的高值化利用提供理论基础。
4 结论
采用正交试验优化获得雪胆水溶性多糖热水浸提工艺和雪胆水不溶性多糖碱液浸提工艺,提取操作简便,方法可行,提取的2种多糖均具有较强的抗氧化活性,可作为天然抗氧化资源加以利用。
参考文献:
高申,于孟可,魏佳慧,刘百歌. 2012. 雪胆甲素对人非小细胞肺癌 A549 细胞增殖的抑制作用[J]. 中国生物制品学杂志,25(1):69-71. [Gao S,Yu M K,Wei J H,Liu B G. 2012. Inhibitory effect of cucurbitacinⅡa on proliferation of human non-small cell lung cancer A549 cells[J]. Chinese Journal of Biologicals,25(1):69-71.]
李瑤佳. 2019. 植物多糖提取方法研究进展[J]. 现代农业科技,(1):222-223. [Li Y J. 2019. Research progress on extraction methods of plant polysaccharides[J]. Modern Agricultural Science and Technology,(1):222-223.]
李莹,徐晓婷,郑重飞,李玲,姚庆强. 2015. 雪胆属植物的化学成分及生物活性研究进展[J]. 中草药, 46(18):2800-2808. [Li Y,Xu X T,Zheng Z F,Li L,Yao Q Q. 2015. Research progress on chemical constituents and biological activities of plants from Hemsleya Cogn.[J]. Chinese Traditional and Herbal Drugs,46(18):2800-2808.]
林玉萍,邱明华,李忠荣,高旭红. 2003. 古蔺雪胆中的新三萜皂苷[J]. 云南植物研究,25(2):235-240. [Lin Y P,Qiu M H,Li Z R,Gao X H. 2003. New triterpenoid glycosides from Hemsleya penxianensis var. gulinensis[J]. Acta Botanica Yunnanica,25(2):235-240.]
刘惠. 2007. 中草药复合粗多糖对断奶仔猪肠道消化生理影响的研究[D]. 长沙:湖南农业大学. [Liu H. 2007. Study on effects of compound polysaccharides on digestion physiology of weaned piglets[D]. Changsha:Hunan Agricultural University.]
僧晓兰. 2016. 峨眉雪胆微丸的制备及对断奶仔猪免疫功能和抗氧化性能的影响[D]. 雅安:四川农业大学. [Seng X L. 2016. Preparation of Emei Hemsleya pellets and its effects on immune function and antioxidant capacity in weaned piglets[D]. Yaan:Sichuan Agricultural University.]
万芳,张冕,李瑶瑶. 2019. 白芨多糖载纳米粒对肝癌小鼠抗肿瘤活性的实验研究[J]. 中国现代医学杂志,29(2):14-17. [Wan F,Zhang M,Li Y Y. 2019. Antitumor activity of Bletilla striata polysaccharide-loaded nanoparticles on liver cancer in mice[J]. China Journal of Modern Medicine,29(2):14-17.]
徐金中,董建勇,叶筱琴,马喜彦,张红叶. 2009. 中华雪胆皂苷类化学成分研究[J]. 中国中药杂志,34(3):291-293. [Xu J Z,Dong J Y,Ye X Q,Ma X Y,Zhang H Y. 2009. Studies on triterpenoid saponins in Hemsleya chensnsis[J]. China Journal of Chinese Material Medica,34(3):291-293.]
杨王伟,雷祖培,王为民,梁卫青,周莹莹,金孝锋. 2014. 不同产地和不同生长期的浙江雪胆有效成分积累变化[J]. 中国中药杂志,39(16):3123-3127. [Yang W W,Lei Z P,Wang W M,Liang W Q,Zhou Y Y,Jin X F. 2014. Changed accumulation of active ingredient in different localities and growth period of Hemsleya zhejiangensis(Cucurbitaceae)[J]. China Journal of Chinese Material Medica,39(16):3123-3127.]

