生物素对发酵过程中MscCG外排L-谷氨酸的影响
聂志华 朱蕾蕾
(1. 天津科技大学,天津 300457;2. 中国科学院天津工业生物技术研究所,天津 300308)
L-谷氨酸是人体的非必需氨基酸,由葡萄糖转变而来[1],是食物蛋白质的重要组成,参与动物、植物和微生物中的许多重要化学反应,在生物体内的蛋白质代谢过程中占重要地位[2]。L-谷氨酸作为一种重要氨基酸被广泛应用于食品、饲料、药品和化妆品等领域,是世界上产量最大的氨基酸。在氨基酸市场中,L-谷氨酸每年生产总量约250万t,占氨基酸生产总量的60%-70%[3]。目前发酵法是生产谷氨酸的主要方法,而主要的生产菌株是谷氨酸棒杆菌。谷氨酸棒杆菌大多为生物素缺陷型,生物素浓度过低会影响谷氨酸棒杆菌的生长,生物素过量则影响谷氨酸的分泌[4-6]。在谷氨酸发酵时控制生物素亚适量是谷氨酸发酵的优化操作模式之一[7]。
近几年,谷氨酸棒杆菌的氨基酸外排系统越来越受到关注[8-10]。在谷氨酸棒杆菌中鉴定出的谷氨酸外排蛋白主要有两个:MscCG(最初命名为 NCgl1221)和 MscCG2,均为机械敏感通道蛋白[11-12]。其中,MscCG是主要的谷氨酸外排蛋白,其外排作用受到细胞膜张力的控制,而细胞膜张力则受生物素浓度的影响。因此,只有在合适生物素浓度范围内才能使外排蛋白通道打开从而外排大量的谷氨酸。研究发现 MscCG折叠成跨膜七聚体,其中每个亚基具有4个跨膜螺旋[13]。有文献报道通过原生质球的单通道记录了MscCG在谷氨酸棒杆菌的天然膜中的机械敏感性通道活性,结果表明MscCG具有约340 pS的电导,同时确定了MscCG的半激活需要约5.5 mN/m的膜张力[14]。而且研究证明了MscCG门控受谷氨酸棒杆菌膜的“软”特性影响显著,可利用作为MscS类机械敏感通道的MscCG专门外排谷氨酸[15-17]。因此,在谷氨酸棒杆菌中表达MscCG蛋白将会对谷氨酸的胞外积累起到促进作用。
本研究在谷氨酸棒杆菌模式菌株ATCC13032中表达了MscCG蛋白,并通过M2P BioLector微型生物反应器[18]在线实时检测不同浓度的生物素对谷氨酸发酵中的生物量、pH和溶氧的影响,旨为谷氨酸发酵的优化控制提供一定的理论依据和实用参考。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 菌种ATCC13032、ATCC13032△mscCG、质粒pTRCmob-mscCG与pTRCmob均由中国科学院天津工业生物技术研究所郑平课题组赠予。
1.1.2 培养基 LBG 固体培养基:5 g/L酵母膏,10 g/L蛋白胨,5 g/L氯化钠,5 g/L葡萄糖,1.8 g/L琼脂;25 μg/mL卡那霉素。
CGXII种子培养基:5 g/L葡萄糖,20 g/L硫酸铵,5 g/L尿素,1 g/L磷酸二氢钾,1.3 g/L三水合磷酸二氢钾,80 g/L MOPS,0.01 g/L氯化钙,0.25 g/L七水合硫酸镁,0.01 g/L七水合硫酸亚铁,0.01 g/L一水合硫酸锰,0.001 g/L七水合硫酸锌,0.2 mg/L硫酸铜,0.02 mg/L六水合氯化镍,0.03 g/L 二羟基苯甲酸,0.1 mg/L Thiamine HCl VB1,2.5 μg/L-4 μg/L 生物素,25 μg/mL卡那霉素,用氢氧化钠调pH为7.0。
CGXII发酵培养基:80 g/L葡萄糖,20 g/L硫酸铵,5 g/L尿素,1 g/L磷酸二氢钾,1.3 g/L三水合磷酸二氢钾,80 g/L MOPS,0.01 g/L 氯化钙,0.25 g/L七水合硫酸镁,0.01 g/L七水合硫酸亚铁,0.01 g/L一水合硫酸锰,0.001 g/L七水合硫酸锌,0.2 mg/L硫酸铜,0.02 mg/L六水合氯化镍,0.03 g/L二羟基苯甲酸,0.1 mg/L Thiamine HCl VB1,0.25 μg/L-4 μg/L 生物素,25 μg/mL卡那霉素,用氢氧化钠调pH为7.0。1.1.3 主要仪器及设备 见表1。
表1 主要仪器设备及生产厂家
1.2 方法
1.2.1 重组菌构建 将质粒pTRCmob-mscCG与空载体pTRCmob分别转化至谷氨酸棒杆菌ATCC13032△mscCG中,获得重组菌ATCC13032△mscCG/pTR Cmob-mscCG与ATCC13032△mscCG/pTRCmob。
1.2.2 摇瓶发酵检测外排蛋白MscCG对L-谷氨酸发酵的影响 分别挑取ATCC13032,ATCC13032△mscCG,重组菌ATCC13032△mscCG/pTRCmob和ATCC13032△mscCG/pTRCmob-mscCG接种于LBG固体培养基中活化24 h;活化后接入装有10ml CGXII种子培养基的100 mL锥形瓶中,在30℃、220 r/min条件下培养12 h;最后以起始OD600为0.15的接种量从种子培养基接种至装有25 mL CGXII发酵培养基的500 mL锥形瓶中,在生物素浓度为0.5 μg/L、30℃、220 r/min的条件下培养40 h,发酵结束后将菌体离心并取上清液,使用SBA-40D生物传感分析仪检测发酵液中L-谷氨酸的含量。
1.2.3 生物素梯度对L-谷氨酸发酵的影响 以重组菌ATCC13032△mscCG/pTRCmob-mscCG为研究对象,在发酵装置中进行发酵培养。将M2P BioLector微型生物反应器转速设置为1 000 r/min,以生物素添加量为变量,选取0.25 μg/L、0.5 μg/L、1 μg/L、2 μg/L、3 μg/L和4 μg/L共6个梯度,用CGXII发酵培养基分别进行3个批次实验,记录实验数据并绘制曲线图。发酵装置BioLector微型孔发酵反应板总体积为3 mL,其中发酵培养基体积为1.2 mL。
1.2.4 L-谷氨酸发酵过程参数的检测方法 菌体生物量、发酵液中的pH和溶氧均在微孔板中由M2P BioLector微型生物反应器在线监测;经过16 h、24 h、30 h和40 h发酵后,分别取样、离心并取上清液,利用SBA-40D生物传感分析仪分别测定发酵液内L-谷氨酸、乳酸的含量。
2 结果
2.1 重组菌的构建及验证
将质粒pTRCmob-mscCG转入谷氨酸棒杆菌ATCC13032△mscCG后,进行质粒提取。图1为质粒pTRCmob-mscCG的电泳图,在8 029 bp附近出现目标条带。将提取的质粒进行测序,测得的序列与原mscCG序列完全一致。说明质粒成功转入。
2.2 表达外排蛋白MscCG对L-谷氨酸产量的影响
本实验在谷氨酸棒杆菌ATCC13032△mscCG中用质粒表达外排蛋白MscCG,同时与菌株ATCC 13032、ATCC13032△mscCG、ATCC13032△mscCG/pTRCmob摇瓶发酵后的L-谷氨酸产量进行对比。结果表明,敲掉ATCC13032基因组上mscCG基因的菌株(ATCC13032△mscCG)和敲掉ATCC13032基因组上mscCG基因且表达空载体pTRCmob的菌株(ATCC13032△mscCG/pTRCmob)摇瓶发酵几乎没有L-谷氨酸的排出;表达基因组上外排蛋白MscCG的菌株(ATCC13032)摇瓶发酵L-谷氨酸的产量为8.6 g/L;而用质粒表达外排蛋白MscCG的菌株(ATCC13032△mscCG/pTRCmob-mscCG)摇瓶发酵L-谷氨酸的产量为11.4 g/L(图2);综上,说明用表达载体(pTRCmob-mscCG)在ATCC13032△mscCG中表达外排蛋白MscCG能够提高摇瓶发酵中L-谷氨酸的产量,提高了32%。

图1 质粒成功转入验证电泳图
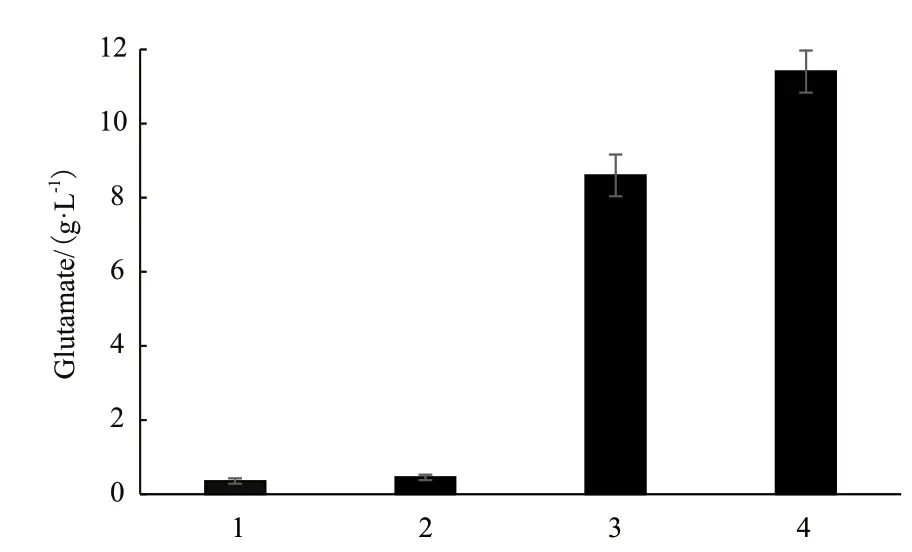
图2 表达外排蛋白MscCG对L-谷氨酸产量的影响
2.3 不同生物素添加量对菌体生长及L-谷氨酸产量的影响
随生物素添加量浓度(0.25 μg/L-4 μg/L)的增加,谷氨酸棒杆菌的生物量从6.89提高到23.42(图3-A)。其中,0.5 μg/L生物素是本实验条件下的亚适量,L-谷氨酸的产量最高,为15.6 g/L(图3-D),菌体生物量为8.18(图3-A);在4 μg/L生物素下谷氨酸的产量最低,为4 g/L,但菌体生物量最高,为23.42。可见,生物素添加量对谷氨酸棒杆菌的生长及L-谷氨酸产量的影响显著,在发酵培养基中生物素浓度越高,菌体生长越快,最终菌体生物量越高;而生物素含量适中才能使谷氨酸的积累量达到最高。
2.4 不同生物素添加量下发酵液中溶氧的变化
谷氨酸发酵中的溶氧浓度是影响发酵的关键因素,对谷氨酸棒杆菌的生长和谷氨酸的生产有重要的影响。在40 h发酵培养过程中,不同生物素的发酵液中溶氧的变化也不同(图3-A);低生物素的发酵液中溶氧较高,其原因可能是菌体的生物量较低(图3-A),发酵液中消耗的氧较少。高生物素的发酵液中溶氧较低,其原因可能是菌体的生物量较高(图3-A),发酵液中消耗的氧较多,并且高生物素的发酵液中溶氧最早开始下降(图3-B)。
2.5 不同生物素添加量对培养基中pH的影响
谷氨酸发酵过程需要对pH进行控制,pH过高或过低都会影响菌的生长与谷氨酸的生成。在40 h发酵培养过程中,不同生物素的发酵液中pH的变化也不同,并且高生物素的发酵液中pH最早开始下降(图3-C);低生物素的发酵液中pH下降较慢,其原因可能是发酵过程中产生的谷氨酸和乳酸较少;高生物素的发酵液中pH下降较快,其原因可能是发酵过程中产生的乳酸较多(图3-E)。
2.6 不同生物素添加量对副产物乳酸的影响
乳酸作为谷氨酸发酵过程的主要副产物,其量越小对谷氨酸发酵越有利。随生物素添加量浓度(0.25 μg/L-4 μg/L)的增加,乳酸从0.1 g/L提高到9.8 g/L。其中,当生物素浓度为0.25 μg/L与0.5 μg/L时,发酵过程中几乎不产乳酸(低于1 g/L);当生物素浓度为1 μg/L-4 μg/L时,发酵过程中乳酸开始积累,且随生物素浓度的增加积累量也在增加(图3-E)。
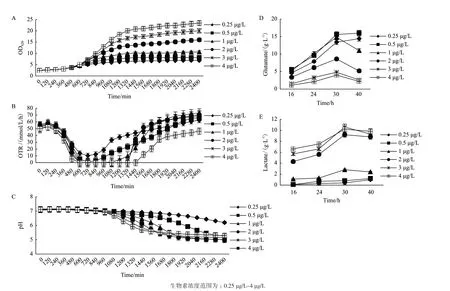
图3 L-谷氨酸发酵过程中的参数
3 讨论
在使用谷氨酸棒杆菌作为生产菌株发酵生产L-谷氨酸时,生物素的用量直接影响生产菌的生长、增殖和代谢,并通过影响细胞膜中脂质的合成来影响细胞膜的通透性[19]。当生物素控制在亚适量时,不仅能提供给菌体生长所必须的生长因子,还能使菌体代谢失调。由于细胞膜是磷脂双分子层组成的,当磷脂含量减少到正常量的一半时,细胞发生变形[20],机械敏感通道蛋白在细胞膜拉伸下打开通道使谷氨酸从胞内排出,积累于发酵液中使得谷氨酸产量提高,而且谷氨酸棒杆菌代谢的副产物乳酸产量较低。当生物素过量,由于细胞内有大量的磷脂质,使细胞壁、细胞膜增厚,细胞仍能维持正常形态,机械敏感通道蛋白感受不到机械力,谷氨酸不易从胞内排出,造成谷氨酸产量减少[21];而且生物素过量(本文2 μg/L-4 μg/L生物素)时,菌体生长增殖速度加快,细胞液中的溶氧相对较低且最早下降,丙酮酸节点流量过多地流向乳酸途径,从而减弱了L-谷氨酸途径,谷氨酸产量减少,谷氨酸棒杆菌代谢的副产物乳酸产量升高;而大量的乳酸也使得发酵液中pH迅速下降[20-21]。当生物素添加量过少(本文0.25 μg/L生物素)时,菌体生长所必需的生长因子量不足,导致菌体生长速度缓慢,细胞液中的溶氧相对较高,谷氨酸棒杆菌代谢的副产物乳酸产量较低,发酵液中pH下降较缓慢,但是谷氨酸的产量受菌体数量影响也相对较少。因此,在谷氨酸发酵过程中确定一个合适的生物素添加量是提高L-谷氨酸产量的有效手段。
本实验通过在谷氨酸棒杆菌ATCC13032△msc-CG中表达MscCG外排蛋白,研究其在发酵生产L-谷氨酸过程中,不同生物素添加量下菌体的生物量、溶氧、pH、L-谷氨酸产量及副产物乳酸的情况。结合图3中的结果可以发现,在谷氨酸棒杆菌发酵生产谷氨酸的过程中,生物素、生物量、谷氨酸产量、乳酸含量及pH与溶氧息息相关(图4)。生物素添加量过少(本文0.25 μg/L生物素)时,虽然溶氧、pH条件合适,乳酸含量较低,但由于菌体生物量较低,谷氨酸仍不能够大量积累。生物素添加量较多(本文2 μg/L-4 μg/L生物素)时,菌体生物量较高,导致发酵液中溶氧下降较快,谷氨酸发酵的副产物乳酸含量积累较多,且导致发酵液中pH下降迅速;较低的pH使得菌体活力下降,最终谷氨酸产量较少。因此,在实际谷氨酸棒杆菌发酵生产L-谷氨酸过程中,当生物素浓度较高时应该增大溶氧同时调节发酵液中的pH才能使L-谷氨酸产量达到最大,并且副产物乳酸的积累较少。生物素浓度满足一定菌体生物量的需求且溶氧能够满足菌体生长代谢需求时,谷氨酸发酵副产物乳酸含量较少、pH处于合适值[22],将有利于谷氨酸的积累。

图4 生物素、生物量、溶氧、pH、谷氨酸、乳酸之间的关系
4 结论
本研究发现用表达载体(pTRCmob-mscCG)在ATCC13032△mscCG中表达MscCG外排蛋白能够提高摇瓶发酵中L-谷氨酸的产量。通过用BioLector体系研究生物素对ATCC13032△mscCG/pTRCmobmscCG发酵产谷氨酸的影响,过程中监测了生物量、发酵液中的溶氧、pH、谷氨酸、乳酸等发酵参数并讨论了它们之间的联系,明确了只有综合考虑对生物素浓度、溶氧及pH值的动态控制,才可能达到谷氨酸棒杆菌的最佳谷氨酸产量。

