肿节风SCAR 分子标记克隆与验证
罗 育 黄春喜 蔡丹昭 贺菽嘉 朱 丹
(1.广西医科大学基础医学院, 广西 南宁530021; 2.广西医科大学第一附属医院药学部, 广西 南宁530021; 3.广西医科大学药学院, 广西 南宁530021)
肿节风为金粟兰科草珊瑚属植物草珊瑚Sarcandra glabra(Thunb.)Nakai 的干燥全草,又名九节茶、草珊瑚、九接风等,2015 年版《中国药典》 收载其作为法定药材[1]。肿节风为常用中药,其浸膏及以肿节风作为原料的中成药如肿节风片、血康口服液、万通炎康片也收载入2015 年版《中国药典》[1];肿节风注射液、新癀片、三蛇胆川贝膏及糖浆则收载入部颁药品标准中[2]。肿节风作为我国传统中药材,对其相关研究主要集中在化学成分、药理活性和临床应用等方面[3⁃5]。现代药理研究表明[6⁃7],肿节风具有抗菌、抗辐射、抗肿瘤、促进骨折愈合及镇痛等多种药理作用,尤其在治疗肿瘤(胰腺癌、胃癌、直肠癌、肝癌、食道癌等)方面具有显著效果[8⁃9],且具有较好的安全性[10]。
由于肿节风需求量较大,市场上出现了鸡爪兰、金粟兰、及己等与肿节风功效不尽相同的混淆品,已影响肿节风的医疗用途,降低了其药用价值。目前,对中药材鉴别的方法主要有理化鉴别、性状鉴别和显微鉴别[11⁃14],若通过理化和性状进行鉴别,其优点是方法较可靠,但缺点是比较费时耗力,而若采用显微结构进行鉴别,其局限性较大,原因是该方法要求实验人员有较高的鉴别能力,还要有合理的鉴别依据。相比而言,分子鉴别法鉴别中药材,具有准确性高,其技术经培训后实验人员容易掌握,经验性少,且省时省力的优点。
目前,应用分子鉴别法从基因水平对中药材进行鉴定已有报道,常用的技术主要包括DNA 条形码技术、DNA序列分析技术以及RAPD 技术等[15⁃19]。其中,DNA 条形码技术是目前影响较大、应用较广泛的DNA 鉴定技术,主要利用种间基因序列差异来进行物种鉴定[20],但目前尚未有一致的植物DNA 条形码标准片段,也甚少应用于对肿节风进行鉴定,因此需要筛选针对肿节风基因组的特异条形码并标准化,最终是否适用于肿节风有待实验验证,这将是本课题组下一步考虑的研究。RAPD 技术是一种有助于研究新发现或改良物种遗传多样性的技术,也经常用于药用植物或中草药鉴定[21⁃25],但准确性低,而如果通过RAPD技术获得SCAR 分子标记,可以提高特异性和稳定性,虽然有时可能找不到特异的SCAR 分子标记,且需要大量的样本数予以支持,但因所获得的SCAR 分子标记可靠且易于使用,仅需PCR 和凝胶电泳便可以从电泳图上直观地反映鉴定结果,已被用于中草药与其混淆品的区分,是鉴定中草药的重要分子工具[26]。
本研究拟在分子水平上应用RAPD 技术及SCAR 分子鉴定标记对肿节风进行鉴别,以期找到能够鉴别并区分其混淆品的特异引物,从理论上提供鉴定肿节风的新思路,并为鉴定肿节风及区分混淆品提供参考。
1 材料与方法
1.1 材料 9 种肿节风和3 种同科混淆品鸡爪兰、及己与金粟兰来自广西药用植物园、广西融水、融安及福建三明等地区,由广西中医药研究院赖茂祥研究员鉴定为正品,具体见表1,-20 ℃条件下贮藏于广西医科大学103 馆2 楼综合实验室内。
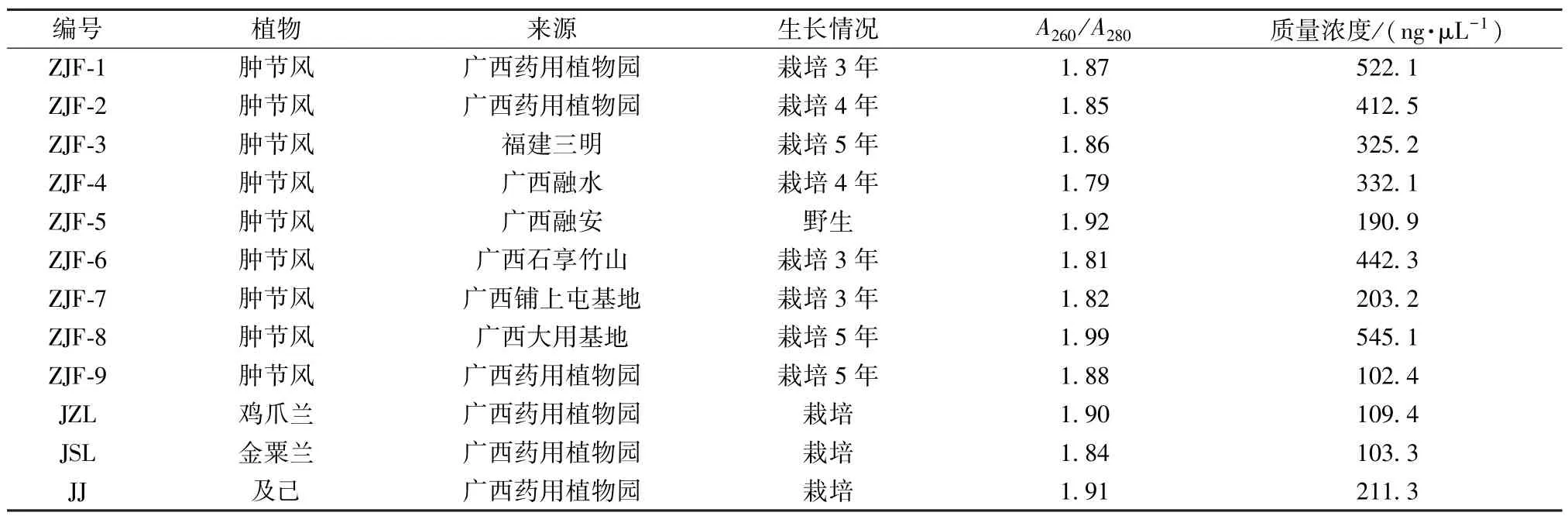
表1 不同来源肿节风及其部分同科植物基因组DNA 纯度与浓度
1.2 方法
1.2.1 肿节风基因组DNA 提取 采用课题组前期改良CTAB 法[27]提取肿节风基因组DNA。选取适量细嫩叶片,液氮中研碎并分装至EP 管中。加入1.5×CTAB 及β⁃巯基乙醇,混匀后,65 ℃恒温反应30 min,12 000 r/min 离心10 min。将上层溶液吸取至另一EP 管中,加等体积氯仿/异戊醇(24 ∶1),混匀后12 000 r/min 离心10 min,吸取至另一EP 管中,加1/10 体积1×CTAB 和等体积的氯仿/异戊醇(24 ∶1),混匀后同条件离心10 min,吸取至另一EP管中,加等体积1×CTAB,混匀后65 ℃恒温反应30 min,同条件离心10 min,去除溶液留沉淀,加NaCl 溶解,同条件离心10 min。将溶液吸取至合适的离心管中,加2.5 倍体积无水乙醇,混匀后-20 ℃静置15 min,同条件离心5 min,去除溶液留沉淀,70% 乙醇漂洗,同条件离心10 min,去除溶液,挥干管中残液后加适量超纯水,即得DNA 溶液,于-20 ℃下保存。
1.2.2 肿节风基因组DNA 质量检测 取适量DNA 提取液,上样于1% 琼脂糖凝胶,电泳缓冲液1×TAE,电压100 V,电泳15 min,凝胶成像系统观察并拍照。采用Quawell 3000 分析仪,直接读取其A260/A280及浓度。
1.2.3 肿节风基因组DNA 进行RAPD 扩增[28]根据植物基因组DNA 特征,由Takara 公司提供的45 条随机引物进行单一引物PCR 反应,反应体系包括10×缓冲液、Mg2+、dNTPs、胎牛血清蛋白、单一引物、Templates、rTaqDNA 聚合酶、超纯水,反应程序为94 ℃预变性;94 ℃变性,36 ℃退火,72 ℃延伸,进行35 个循环;最后补充延伸。产物进行琼脂糖凝胶电泳,观察并拍照电泳结果。
1.2.4 肿节风SCAR 分子标记胶回收 用刀片将胶块中的目的条带切下,放置于已灭菌的1.5 mL 离心管中,称定质量。按天根DNA 纯化回收试剂盒说明书进行操作,回收产物通过琼脂糖凝电泳进行检测。
1.2.5 肿节风SCAR 分子标记的克隆、鉴定及测序 按照pEASY⁃T1 Cloning Kit(TransGen Biotech)的说明书进行连接反应,取3 μL 胶回收产物、1 μL 灭菌超纯水、1 μLpEASY⁃T1,25 ℃保温10 min。在上述连接产物中加入感受态细胞,冰上放置30 min,42 ℃水浴45 s,冰上放置2 min,加入细菌培养基,摇床中复苏1 h,涂于平板上,37 ℃培养14~16 h,采用α⁃互补筛选携带重组质粒的细菌。
将重组菌落制成重组菌液,进行PCR 扩增,反应体系与程序同“1.2.3” 项。产物进行琼脂糖凝胶电泳,观察并拍照电泳结果。
经α⁃互补筛选及PCR 鉴定后,取阳性重组菌液置于灭菌离心管中,做好标记并用封口胶密封,送往武汉金开瑞生物工程有限公司进行双向测序。
1.2.6 肿节风鉴定特异性引物设计 利用Vector NTI 软件对测序进行比对,确定4 种不同产地肿节风分子标记的同源序列,肿节风样本分别是广西药用植物园3~4 年栽培品、福建三明5 年栽培品、广西融水4 年栽培品,按照引物设计原则[29],使用Primer Premier 5.0 软件获得评分高的引物,交由公司合成。
1.2.7 肿节风SCAR 分子标记特异性引物验证 以表1 中9 种肿节风及鸡爪兰、及己与金粟兰等3 种同科易混淆植物基因组DNA 为模板,使用自行设计引物进行PCR 反应,引物序列分别为S41⁃正向,5′⁃ATTTCCCATCCATCGTCG⁃3′;S41⁃反向,5′⁃CCTCCTCTTCCTGCTCCA⁃3′,反应体 系包括10×缓冲液、Mg2+、dNTPs、引物、Templates、rTaq DNA 聚合酶、超纯水,反应程序为94 ℃预变性;94 ℃变性,53.8 ℃退火,72 ℃延伸,进行30 个循环;最后补充延伸。产物进行琼脂糖凝胶电泳,观察并拍照电泳结果。
2 结果
2.1 肿节风基因组DNA 提取与质量检测 不同来源的肿节风基因组DNA 电泳结果见图1。由此可知,9 种肿节风及3 种同科易混淆植物基因组DNA 条带清晰明亮,表明提取获得的基因组DNA 纯度较高,而且所含杂质较少,DNA分子完整。核酸蛋白分析仪测定肿节风基因组DNA 的相关数据见表1,显示所有样品基因组DNA 的OD260/OD280值均在1.7~2.0 之间,质量浓度在100~550 ng/μL 之间,表明提取到的基因组DNA 纯度较高,质量较好,可作为后续PCR 扩增的模板。

图1 不同来源肿节风及部分同科植物基因组DNA电泳结果
2.2 肿节风基因组DNA 进行RAPD 扩增 从S41号随机引物扩增的结果中获得SCAR 片段,见图2,显示4 种不同产地的肿节风样本RAPD 扩增后出现一致片段(1 000~2 000 bp),重复扩增均有相同的结果。因其片段大小适中,故可以筛选作为SCAR 分子标记。

图2 4 种不同产地肿节风RAPD 扩增结果
2.3 菌液PCR 鉴定 α⁃互补筛选出阳性克隆菌落后,PCR扩增阳性克隆菌落进行鉴定,见图3。由此可知,在1 000~2 000 bp 之间均出现了扩增条带,且是唯一的条带,大小与图2 一致,清晰明亮,表明S41引物扩增获得的SCAR 分子标记已成功插入pEASY⁃T载体中,克隆完成。
2.4 特异性引物鉴定 采用测序合并Vector NTI 软件分析SCAR 分子鉴定标记的碱基序列,长度为1 352 bp(GenBank 登记号为MN244913),此序列作为模板设计出鉴别引物,扩增9 种不同产地肿节风及3 种同科混淆品鸡爪兰、及己与金粟兰等基因组DNA,见图4。由此可知,9 种肿节风均出现有唯一条带(大小约为500 bp),并与预期扩增长度相符;3 种同科混淆品没有扩增条带,因为该引物是从肿节风基因组DNA 的碱基序列中获得,也说明其属于肿节风与同科植物的鉴别引物。同时,获得了一种新的可进行肿节风鉴别的SCAR 分子标记。
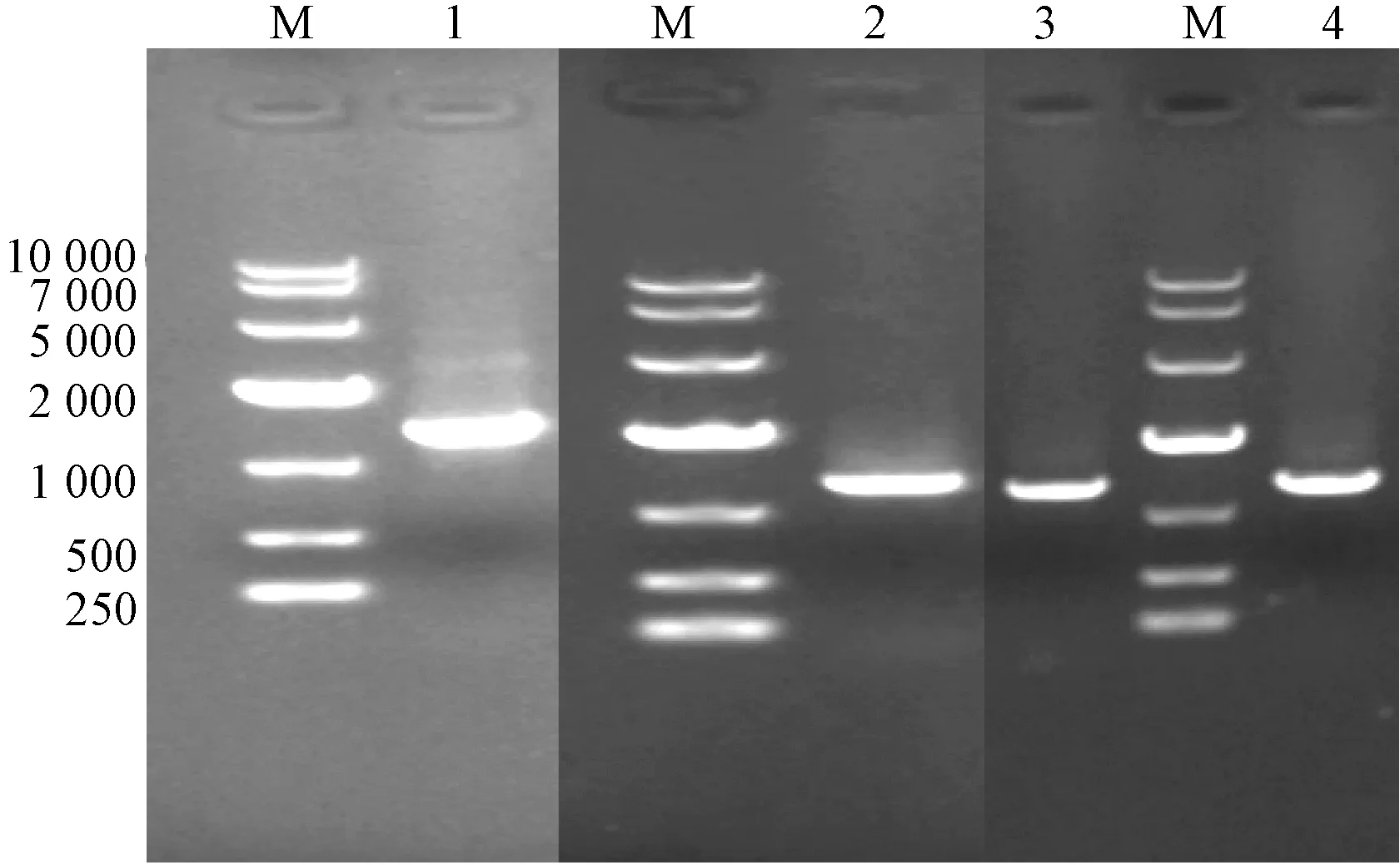
图3 菌液PCR 扩增结果

图4 9 种不同产地肿节风及3 种同科混淆品特异引物扩增
3 讨论
中草药等药用植物因其自身次生代谢物较复杂,提取基因组DNA 相对较为困难,若其中的次生代谢物不能有效去除,必将会影响到后续的PCR 扩增;本研究前期使用试剂盒提取肿节风基因组DNA,虽电泳检测时能看到完整的DNA 条带,但其A260/A280比值较差,均不在1.7~2.0 范围,后续的PCR 扩增也得不到稳定的条带。鉴于此,本研究选择了CTAB 法并加以改良,最终获得完整、高质量的肿节风及其他科植物基因组DNA,并能用于后续的PCR 扩增。
本研究在解决了基因组DNA 质量的基础上,通过随机引物获得肿节风RAPD 标记,克隆并筛选转化为SCAR 标记,与GenBank 上其他物种植物基因组DNA 序列进行比对,显示同源性较低,表明其属于肿节风基因组DNA 中的特有序列;以此SCAR 标记为模板设计鉴别引物,PCR 扩增结果显示对9 种不同产地肿节风样本的DNA 具有特异性,而在其他同科植物的DNA 中没有PCR 扩增结果,表明筛选到了可用于肿节风鉴别的特异性SCAR 分子标记,因此结合RAPD 和SCAR2 种分子标记技术,以期建立一种可以对肿节风与其混淆品鉴别的方法,为药用植物以及其他植物物种的遗传特性与鉴别提供参考。

