浅谈农药膳食风险评估中的几个问题
朴秀英,张峰祖,李富根
(农业农村部农药检定所,北京 100125)
农药膳食风险评估是我国农药登记评审和农药残留标准制定中的一个重要评估手段和技术依据。为科学规范开展农药膳食风险评估,原农业部发布了《食品中农药残留风险评估指南》,规范了程序和技术要求[1];2017年颁布实施的《农药登记资料要求》中,明确规定了登记申请者应提交农药膳食风险评估报告[2]。本文结合国外相关规定和评估实践,就农药膳食风险评估中的几个技术问题进行探讨。
1 关于农作物残留试验
1.1 试验设计原则 农药膳食风险评估所依据的农作物残留试验,其试验结果应能够反映农药使用或拟推荐使用的良好农业规范(Good Agricultural Practice,以下简称GAP)下的最高残留水平。因此,对于每一农药登记申请者来说,通常基于拟申请的良好农业规范中的最高施药剂量、最多施药次数、最短施药间隔、最短安全间隔期来设计农作物残留试验[3],并据此结果估算规范残留试验中值(Supervised Trials Median Residue,以下简称STMR)和最高残留值(Highest Residue,以下简称HR)。
1.2 试验选择 在某一产品的登记评审过程中,若提交的农作物残留试验符合相关管理和技术要求,则以此试验结果估算STMR和HR。然而,推荐农药最大残留限量时所开展的农药膳食风险评估来说,可能会面对相同农药/农作物组合的多个残留试验报告。例如,目前吡虫啉在防治小麦蚜虫的登记产品共有309个[4],假设有20项吡虫啉在小麦上农作物残留试验报告,并且试验GAP、农药产品剂型不尽相同。这时,需要确定最严格的GAP(critical GAP,以下简写cGAP),即能导致最大残留水平的GAP,并以能够反映cGAP的残留试验结果来估算STMR和HR。如果不加区分地采用不同GAP的试验数据,膳食风险评估结果可能会出现偏差。
1.3 cGAP的确定 确定cGAP时,需要考察施药剂量、施药时期、施药次数及安全间隔期等参数。通常,施药剂量越高、施药次数越多、安全间隔期越短,则残留水平就越高。但是,可能会遇到两种以上参数发生反方向变化的情况,这时需要综合分析各种数据进行研判。例如,2018年FAO/WHO JMPR评估推荐吡唑醚菌酯在茶叶上的限量时,虽然我国(0.25kg ai/ha)的最高施药剂量高于日本(0.136 kg ai/ha),但消解动态试验表明,吡唑醚菌酯在鲜茶叶上降解更快(表1),因此最终选择安全间隔期短(日本:7d,我国:21d)的日本GAP作为cGAP[5]。

表1 吡唑醚菌酯在鲜茶叶上的残留数据[5]
2 GAPs的可比性
残留数据越多,越能够反映真实客观的情况。为了以更多的数据开展膳食风险评估并推荐MRL,需要考察以其他GAP(相对于cGAP)开展的残留试验是否能够获得与cGAP相同或相似残留水平,即判断其他GAP与cGAP之间的可比性(comparability)。欧盟对残留水平可比性概念的解释是采用OECD计算器算出相同或相近的MRL,可用适当的统计学方法进行评估判断[6]。考察GAPs的可比性时,施药剂量、安全间隔期、施药时期和次数、施药方法、农药剂型是主要考虑因素。
2.1 “±25%”原则 JMPR和OECD都遵循“±25%”原则,即导致残留量±25%偏离的GAPs是具有可比性的[7,8]。
对于土壤施药、种子处理和叶面施药方式,通常认为施药剂量与残留量之间线性相关。因此,在其他参数一致时,与cGAP相比较,±25%施药剂量的GAP与cGAP是具有可比性的[7,8]。果树的施药剂量通常按浓度(mg a.i./kg)表示,这时应考虑所用的药液量和施药表面积。
安全间隔期(PHI)对残留结果的影响主要看农药消解情况。如果农药消解符合一级动力学规律(半衰期为T1/2),可以推算安全间隔期为在PHI-0.32 *T1/2和PHI+0.42*T1/2之间的GAPs是具有可比性的[7]。欧盟经验表明,安全间隔期偏离不超过±25%的,则认为具有可比性[8]。
2.2 施药时期和次数 农药的持久性和施药间隔会影响施药次数对残留水平的贡献度。一般情况下距最后一次施药3个半衰期前的施药不会显著影响最终残留水平。对于非持久性农药,如果施药次数多于5次的,前期的施药一般不会对最终残留有显著的贡献[6,7]。另外,从农作物残留试验中最后一次施药前的残留数据,也可以判断前期施药是否对最终残留有明显的影响。
2.3 施药方式和农药剂型 相对于上面几个参数,不同剂型不会对最终残留产生明显影响。用于种子处理、苗前或苗期施药、土壤沟施等剂型的残留数据也具有可比性。对于后期兑水叶面施用的剂型,如乳油、可湿性粉剂、水分散粒剂和悬浮剂等,需要考虑两个因素,一是农药产品中是否含有有机溶剂或油,二是安全间隔期。如果PHI长于7d,并且农药产品不含有机溶剂或油,则认为导致相近的残留水平[7]。
2.4 其他 不同残留试验的GAPs虽然具有可比性,但是其残留数据存在明显差异时,需要判断不同试验的残留数据是否来自同一总体,必要时可采用统计检验,如曼-惠特尼秩和检验(Mann-Whitney U-test)或多组独立样本的秩和检验(Kruskal-Wallis H test)[7]。
3 数据处理
3.1 独立试验的判定 独立试验是相对重复试验提出的概念,并且是针对具有可比性的GAPs的。估算STMR和HR时,一个独立试验仅选择一个残留数据。确定独立试验时需要考虑试验点地理位置、种植(一年生作物)和施药时期、农药产品剂型、施药方式、施药剂量、施药器械等。地理位置不同的试验,以及在同一试验点点的不同方式施药、作物种植和施药时期间隔>30d、额外使用助剂的试验,均被认为是独立试验[7]。但是,在相同试验点、相同喷药操作、不同施药器械(其他要素均一致)的试验,则被认为是非独立试验,即是重复试验[7]。同一试验点施药剂量不同的试验,按照2.1的“±25%”原则,若判定具有可比性,则认为是重复试验;若判定为不具有可比性,可以采用比例推算原则选择导致最高残留量的试验[7,8]。
3.2 重复数据的处理 农作物残留试验中会出现不同类型的“重复”数据,主要有以下几个情形;(a)实验室重复制备样品;(b) 重复检测样品;(c) 一个试验小区的重复样品;(d) 一个试验点的重复试验小区;(e)一个试验点的重复试验。对于a和b类的重复数据,平均值则被认为对一个实验室样品残留量的最佳估计值;对于c和d类,平均值用于STMR估算、最大残留限量推荐以及动物膳食负荷的计算;然而,确定HR则是基于有重复样品的最高残留值;e情况时,选择产生最高残留水平的小区的试验,用于最高残留限量推荐和膳食摄入评估[7]。
3.3 低于定量限的残留数据 一般来说,当所有相关试验数据都小于定量限时,可将STMR 值设定为定量限。在具有多个不同定量限的试验设计中,如果试验数据均小于定量限,则通常使用最低的定量限作为 STMR值,但需要考虑最小定量限试验的数据量[7]。
3.4 数值修约和异常值处理 为STMR和HR能够反映客观真实的残留水平,通常在数据计算最后一步进行数值修约,即报告最终结果时进行。对于异常值,应充分论证可获得的相关信息后才可以舍去,即不能随意舍去异常值。
4 用于膳食风险评估的残留物
用于膳食风险评估的残留物主要有三种情形,即仅为母体、仅为代谢物、母体和代谢物。不同情况的膳食风险评估中所选取的数据及计算方法有所差异。
4.1 用于膳食风险评估的残留物仅为母体或代谢物 仅为母体时最简单,STMR、HR、每日允许摄入量(Accepted Daily Intake,以下简称ADI)或急性参考剂量(Acute Reference of Dose,以下简称ARfD)均选择母体残留数据和毒理学终点。仅为代谢物时,则选择代谢物的残留数据估算STMR和HR,并且应选用代谢物的ADI或ARfD。例如丙硫菌唑,其用于膳食风险评估的残留定义为脱硫丙硫菌唑,丙硫菌唑的ADI为0.05mg/kg bw,其ARfD为0.8mg/kg bw(妇女和育龄女性);而脱硫丙硫菌唑的ADI低于丙硫菌唑(0.01mg/kg bw),ARfD是分不同人群制定,对一般人群和育龄妇女分别为1mg/kg bw和0.01mg/kg bw[9]。
4.2 用于膳食风险评估的残留物为母体和代谢物 第一种情形是当母体和代谢物具有相似的毒性效应时,用于膳食风险评估的残留物为母体和代谢物,以母体表示。这时选用母体的ADI和ARfD,并以母体和代谢物残留量之和估算STMR和HR,其中代谢物的残留量需要用母体和代谢物的摩尔分子量进行折算。
第二种情形是母体和代谢物具有相同的毒性作用机理,但毒性水平不一致,通常代谢物毒性高于母体,如乙酰甲胺膦,其代谢物甲胺磷的ADI和ARfD分别是母体乙酰甲胺磷的7.5倍和10倍。在膳食风险评估中需要同时考虑乙酰甲胺磷和甲胺磷,既要考虑残留水平,也要考虑毒性水平的差异。因此,估算STMR时采用乙酰甲胺磷和7.5倍甲胺磷残留量之和,估算HR时则采用乙酰甲胺磷和10倍甲胺磷残留量之和。
第三种情形是母体和代谢物分别评估,其原因主要是毒性机理不相同。例如噻虫嗪和百菌清,其用于膳食风险评估的残留定义为噻虫嗪和噻虫胺、百菌清和SDS3701[10]。这时需要分别估算母体和代谢物的STMR和HR,并采用各自的ADI和ARfD(如需要),分别开展膳食风险评估。需要注意的是,由于噻虫胺也是一种农药,因此在开展噻虫胺膳食风险评估时,需要考虑使用噻虫嗪导致的噻虫胺残留水平。
4.3 低于定量限的残留量之和的计算 残留试验结果中经常会遇到残留量低于定量限的情况,这时根据所获得的信息,具体情况具体分析(case-by-case)后,计算母体和代谢物之和。下面以3个JMPR的评估实例简单介绍[7]。
JMPR实例1:咪唑菌酮(fenamidone)用于膳食风险评估的残留定义为咪唑菌酮和代谢物RPA 410193、RPA 412636、RPA 412708之和,以咪唑菌酮表示(后两个代谢物仅为土壤代谢物)。当母体和代谢物的残留量低于定量限时,由于不同作物的安全间隔期不同,在不同作物上残留量之和的计算不能简单相加。在PHI为4~5周收获的葡萄和草莓中,RPA 410193与母体残留量的数量级相同,残留量之和为母体和代谢物相加;但是,在较短的安全间隔期(2~21d)内收获的其他植物商品中,代谢物比母体残留量低得多,残留量之和只考虑母体(表2)。
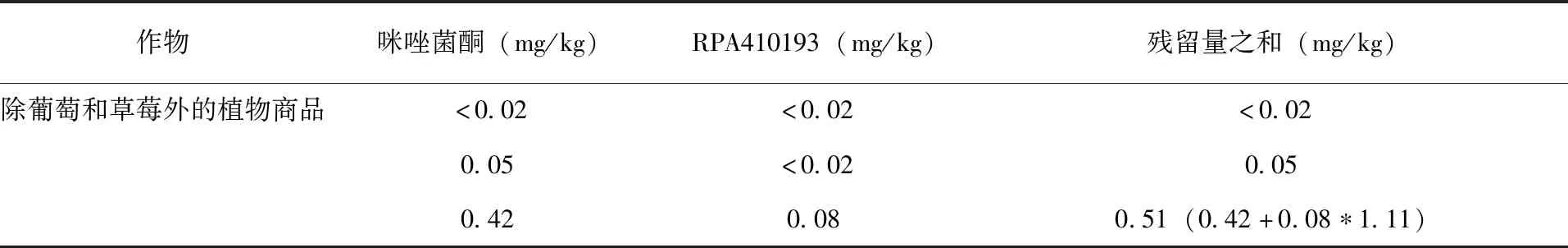
表2 咪唑菌酮和RPA410193的残留量
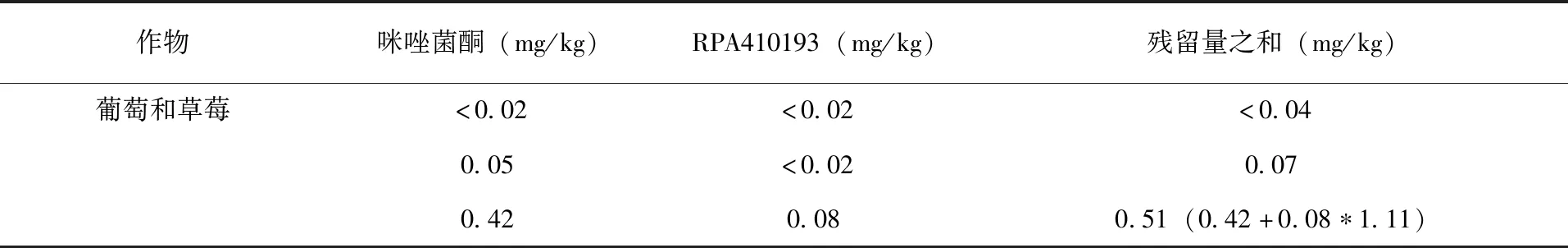
续表
JMPR实例2:腈菌唑(myclobutanil)在植物商品中用于膳食风险评估的残留定义为腈菌唑与代谢物RH-9090及其共轭物之和,以腈菌唑表示。RH-9090的定量限为0.01mg/kg,检出限为0.0025mg/kg。当RH-9090的残留量高于检出限、低于定量限时,认为腈菌唑和RH-9090的残留量在一个数量级水平,残留量之和为两者之和;但是,当RH-9090的残留量低于检出限,认为腈菌唑的残留量明显高于RH-9090,残留量之和只考虑母体(表3)。

表3 腈菌唑和RH-9090的残留量
JMPR实例3:肟菌酯(trifloxystrobin)用于膳食风险评估的残留定义为肟菌酯和代谢物CGA321113之和,以肟菌酯表示。考虑到CGA321113通常在农作物的农药残留中占比很小,当CGA321113残留量低于定量限时,不计入残留量之和表(4)。
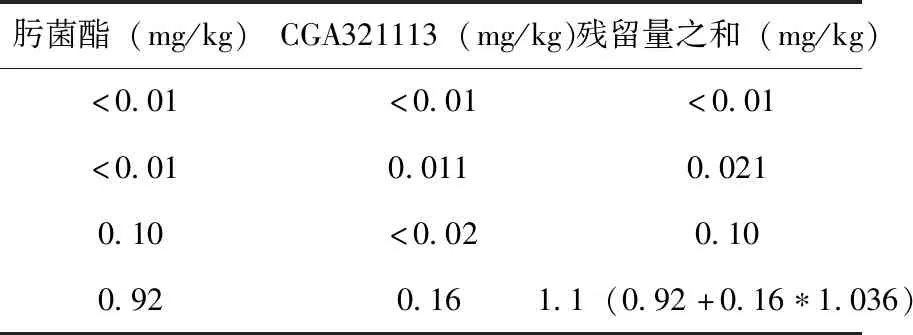
表4 肟菌酯和CGA321113的残留量
5 小结
5.1 一是规范开展农作物残留试验,是农药膳食风险评估的重要基础 试验设计应能够反映拟推荐的GAP,且能够获得最高残留水平,特别是待测残留物应包含用于监测和膳食风险评估的残留物。试验过程中,特别注意施药和田间样品采样的均匀性,样品运输条件符合相关要求,如实记录气象数据、田间管理以及试验过程中的任何偏离。试验报告应描述清楚试验开展、数据计算过程,完整规范呈现试验数据及计算结果,对试验数据异常值要有客观分析。
5.2 是充分利用和分析数据信息,是农药膳食风险评估的重要手段 农药膳食风险评估过程中常常会遇到新情况新问题。从国外的评估实践来看,最有效快捷的方法是充分利用数据信息,比如植物代谢试验、消解试验、作物生长、农药特性等,具体问题具体分析,从有限的数据客观预测现实情况,做出合理的判断和解释。对农药膳食风险评估感兴趣的技术人员可多研读JMPR评估报告,逐步锻炼和积累数据分析能力和经验。

