11号染色体三体、嵌合体和单亲二体综述
张华 胡蓉 薛婷 袁二凤 卢建 章钧 张琳琳*
(1.郑州大学第三附属医院 检验科,河南 郑州 450000;2.广东省妇幼保健院 医学遗传中心,广东 广州 511400;3.中山大学附属第三医院 产前诊断中心,广东 广州 510000)
11号染色体属于C组中等亚中着丝粒染色体(ISCN2016),全长共135 006 516个碱基,涉及疾病相关的OMIM基因共276个(https:∥www.gena.tech/)。完全型11号染色体三体(trisomy 11,T11)为致死性异常,可导致早期胚胎停育和自然流产。嵌合型11号染色体三体(trisomy 11 mosaicism,T11M)为一种较罕见的染色体数目异常,活产儿中少见报道。11号染色体上包含已知的基因组印迹疾病区域(11p11.5),11号染色体单亲二体(uniparental disomy,UPD)与基因组印迹疾病与脐膨出-巨舌-巨体综合征(Bechwith-Wiedemann Sydrome, BWS, OMIM #130650)和不对称身材-矮小-性发育异常综合征(Silver-Russell Sydrome, SRS, OMIM #180860)相关。另外,11号染色体上常见的相关综合征,如WAGR 11p13缺失综合征(OMIM#194072),以无虹膜、泌尿生殖系统异常、Wilms瘤及智力障碍为主要临床表现,该综合征相关的基因有WT1、PAX6等;另Potocki-Shaffer综合征(OMIM#601224),其临床症状有颅面畸形、发育迟缓、智力障碍及多发性外生性骨疣等,该综合征相关的基因有EXT2、PHF21A、ALX4等;此外,Jacobsen综合征(OMIM#147791),其主要表现为智力障碍、先天性心脏畸形及血小板减少等,相关的基因有ETS1、FLI1、BSX、NRGN等[1,2]。本文结合以往相关文献报道,对11号染色体三体、嵌合体及单亲二体其各自发生机理、临床特征、治疗预后、再发风险评估及遗传咨询意见等方面进行综述,以期为11号染色体的产前诊断及遗传咨询提供参考。
1 11号染色体三体
1.1 发生机制及相关报道 11号染色体三体可由于减数分裂Ⅰ期同源染色体不分离、减数分裂Ⅱ期或有丝分裂姐妹染色体单体不分离而导致11号染色体三体及嵌合体。完全型11号染色体三体为致死性异常,可导致胚胎停育及自然流产,目前尚无完全型11号染色体三体活婴出生的报道。但11号染色体三体限制性胎盘嵌合在大样本研究中的绒毛膜样品中也偶有发现[3,4]。统计参与本综述3家单位的相关数据,郑州大学第三附属医院在1727例流产组织中共检出6例完全型11号染色体三体,检出率约0.34%;广东省妇幼保健院产前诊断中心在2619例流产组织中共检出7例完全型11号染色体三体,检出率约0.26%;中山大学附属第三医院产前诊断中心在1005例流产组织中完全型11号染色体三体的检出3例,约占0.29%。具体流产组织中11号染色体三体,嵌合型11号染色体三体和11号染色体单亲二体的检出情况详见表1。

表1 参与统计的3家实验室流产组织检出情况统计汇总
1.2 再发风险评估及遗传咨询 11号染色体三体的再发风险与夫妇双方是否存在生殖腺低比例嵌合11号染色体三体,或是否涉及11号平衡易位相关。若排除生殖腺低比例嵌合等因素,目前尚无证据表明11号染色体三体的再发风险会相对正常人群高。有11号染色体三体流产史的正常夫妇可在下次妊娠选择行介入性产前诊断,送检胎儿染色体核型分析和染色体微阵列分析(chromosomal microamay analysis, CMA)检测。
2 11号染色体三体嵌合
2.1 发生机制及概况 嵌合型11号染色体三体十分罕见,仅在早期的自然流产的细胞遗传学分析和产前通过绒毛膜绒毛取样(chorionic vellussampling,CVS)和羊膜腔穿刺术取样的胎儿的核型分析中被报道,且更多的是关于产前限制性胎盘嵌合(confined placental mosaicism,CPM)和真正的胎儿嵌合(true fetal mosaicism,TFM)的研究。二倍体和三体嵌合发生的机制有合子后有丝分裂不分离、二倍体合子后期分裂迟滞、部分三体合子在后期有丝分裂中丢失1条染色体(三体合子挽救)。染色体嵌合在自然流产胎儿中约占25%[5-7],在绒毛膜绒毛样本中约占2%左右,进而通过胎儿核型检测到的真染色体嵌合的总频率约为0.2%[4,8],可能涉及不同染色体的数目和结构异常以及在有丝分裂的不同阶段、位置及和形成机制中出现错误所导致的异常细胞系[9-13]。Malvestiti等[14]对60 347例进行CVS诊断的回顾性调查中,检测到1317 例(2.18%)嵌合病例,其中 1001 例接受了羊膜穿刺术,染色体嵌合率为 2.18%,TFM率是1.4%,这与欧洲CVS中嵌合研究[4]和Battaglia等[15]进行的孕早期CVS嵌合研究的结果一致。关于11号染色体嵌合的报道大部分基于CVS提示后进行胎儿核型确认后的个例研究,目前染色体嵌合网站(http:∥mosaicism.bcchr.ca/specific.htm等)及PubMed共检索到涉及11号染色体嵌合的病例共17例,其中产前16例,产后1例。统计参与本综述3家单位的相关数据,有1例11号染色体嵌合三体的病例。
2.2 11号染色体三体嵌合的临床特征 鉴于嵌合型11号染色体三体较为罕见,其相关表型报道也比较局限。故在探讨其临床特征时,除需考虑11号染色体嵌合的真假及嵌合比例引起的表型外,还要排除三体自救引起的UPD导致的表型,以及由于UPD状态下导致隐性遗传致病基因的纯合突变而导致的相应表型。三体自救所产生的UPD常表现为胎盘或胎儿细胞嵌合,在这种情况下,UPD的特异性临床表型很难与嵌合三体区分[16]。
在大多数情况下,对嵌合的检测会引起假阳性,因为它通常局限于胎盘CPM,而非TFM[17,18]。但胎儿核型已确认为正常,也将近10%的CPM可能反映出隐秘的胎儿嵌合,但这不一定会导致表型异常。Malvestiti等[14]在1001例CVS中检出的5例11号染色体三体嵌合的样本在进行羊膜腔穿刺后未检测到嵌合。在直接CVS细胞遗传学分析中检测到9例11号染色体三体低比例嵌合。其中3例未进行羊膜腔穿刺,没有随访结果;1例流产组织嵌合比例为5.5%,取皮肤成纤维组织进行核型分析未检测到嵌合;1例嵌合比例为2.7%,在出生后外周血核型分析正常,15个月体检发育正常;1例嵌合比例为46,XX/47,XX, + 11(11/4)拒绝羊穿继续妊娠,随访未成功;3例在CVS中检出嵌合比例分别为35/2、9/8、2.7%,后续在羊水、脐血及皮肤成纤维细胞中未检测到嵌合,出生后发育正常。Daniel等[19]和Basel-Vanagaite等[20]分别在羊水中检测到11号染色体三体嵌合比例为26%和6%,后经血液、尿液及皮肤成纤维细胞核型分析未检测到嵌合,出生后发育正常。因此,在 CVS标本中发现的异常细胞比例不能反映整个胎盘或胎儿的嵌合程度,因为用于产前诊断的绒毛膜绒毛仅从一个胎盘部位取样,来自羊水、血液、胎儿皮肤或其他胎儿组织的样本可以更全面地反映胎儿的真正核型。
Wilmot等[21]早已在1例无心、无脑的双胞胎的皮肤成纤维细胞上鉴定报道了11号染色体三体嵌合。也有文献报道11号染色体三体嵌合与头畸形相关[22]。
Balasubramanian等[23]报告了1例患有双侧肾脏发育不全的男性胎儿,该男胎存在11号染色体三体嵌合。通过20周的超声检查发现胎儿异常,显示双侧肾脏发育不全和羊水过少,在孕21周时终止妊娠,分娩的胎儿出生体重为480g(适合该胎龄的体重)。尸检发现双肾发育不全、羊水过少、Potter’s 面容、鹰钩鼻、左脚足内翻、羊膜结节、肺发育不全。胎盘检查正常,对胎儿皮肤和胎盘绒毛进行细胞遗传学分析,在胎儿皮肤样本发现核型为47,XY,+11[7]/46, XY[23]。进一步分析来自胎盘绒毛的30个细胞,未检测到11号染色体三体,可能是由于三体细胞系由一个内细胞团祖细胞的合子后有丝分裂复制所致。正常细胞系的存在解释了胎儿能发育至20周,甚至如果不终止也有可能足月妊娠。此外,Curry等[24]报道了80例因肾脏或泌尿系统异常而导致的Potter序列征,其中1例 3号和11号染色体平衡易位产生的衍生 11q13.2-qter重复,提出11号染色体重复可能与肾脏畸形有关。中山大学附属第三医院产前诊断中心检出1例11号嵌合三体的病例,为父源UPD(11) BWS患者,嵌合比例为30%,产前孕16周超声表现为胎盘增厚呈蜂窝状;孕21周超声表现为脐膨出、双肾增大、回声增强、胎盘增厚呈蜂窝状;孕23周家属选择终止妊娠。通过以上文献及实验室数据提示,11号染色体嵌合三体的临床特征与肾脏异常可能有关。
Webb等[25]报告了1例11号染色体嵌合三体,表现为严重的宫内生长受限。超声检查发现羊水过少,妊娠19周时双顶径、头围和腹围的测量值相当于孕17周,股骨长相当于孕14周。妊娠19~20周之间宫内死亡,尸检显示肠旋转和尿道下裂、肺发育不全、耳垂较低、睑裂较长、鼻梁较短。胎盘活检直接制备的染色体分析显示47,XY,+11(10个细胞),对同一胎盘活检的长期培养核型分析显示46,XY/47,XY,+ 11(4∶6)嵌合。常规的胎盘组织和胎儿皮肤培养分别在分娩后、宫内死亡3天后进行,均失败。从皮肤活检和胎盘的5个不同部位获得间期细胞的悬浮液进行FISH检测,在来自5个不同部位胎盘的间期细胞中提示11号染色体三体嵌合比例为78%(404/518)。相比之下,来自皮肤活检的间期细胞提示11号染色体三体体嵌合比例只有2.5%(7/280)。通过微卫星多态性分析发现在胎儿组织中存在11号染色体父源UPD,由于11p11.5的父源UPD与BWS相关,导致过度生长,这个胎儿没有任何与BWS相关的结构异常,反而生长发育迟缓,这说明胚胎外组织中三体细胞系占的比重更大。
Carella等[26]报道了1例 12 岁男孩出生时新生儿检查显示睑裂上斜、耳位低、右足内翻和轻度髋臼异常、神经系统检查显示轻度的精神障碍、以及全身性肌张力低下。分别在1 个月和13个月大时腹部超声检查发现左右肾存在实性结节,手术切除并接受化疗,组织病理学显示Wilms肿瘤。外周血核型分析显示患者是11号染色体3个细胞克隆的嵌合:46,XY,r(11)(p15.5,q25)[90]/45,XY,-11 [8]/47,XY,r(11)(p15.5,q25)x2 [2],患者的外周血及左右肾脏进行微阵列CGH,FISH 和微卫星多态性分析相结合,显示在r(11)(p15.5,q25)区段上存在11p15.5-15.4 区域的父源性串联重复,父母双亲核型未见异常。此外,对瘤形成的研究表明,右侧肿瘤极有可能来源于46,XY,r(11)(p15.5,q25)克隆,以及左侧肿瘤可能来源于47,XY,r(11)(p15.5,q25)x2的克隆。r(11)(p15.5,q25)区段上存在11p15.5-15.4 区域的父源性串联重复,与BWS表现为先天性畸形和肿瘤易感性相关的过度生长综合征相关,这可以解释患者嵌合表型由三体自救形成的父源性单亲二倍体导致,在肿瘤的发生中起了重要作用。
由于病例报道较少及缺乏临床表现的共性,涉及发病机制复杂,11号染色体嵌合的临床表现还需要更多的病例报告来描述和增加其表型。
2.3 11号染色体三体嵌合的治疗与预后 由于11号染色体嵌合在产后罕见,所以相应的治疗报道少见。在产后中发现的11号染色体嵌合病例多针对临床相应的表型进行对症治疗,如发现肿瘤异常,可以进行切除+化疗的方案,预后因个体差异而不同。
2.4 11号染色体三体嵌合的再发风险评估及遗传咨询意见 11号染色体嵌合的再发风险较低,遗传咨询特别具有挑战性。这些患者的遗传咨询应包括以下几点:①表型结果的变异,从正常到严重异常的表型;②对三体细胞系的鉴定/确认/定量,其中成纤维细胞(和胎盘)比血液更倾向于显示三体细胞系的存在或更高的嵌合比例;③由于三体(或单体)自救机制,特别是在CVS检测到嵌合现象和在已知三体(单体)染色体有印迹区域的情况下,对可能存在的单亲二倍体的情况进行家系CMA、或者STR技术进验证已排除单亲二倍体;④认识到临床结果会由于检测的方法不同而有所不同,例如是通过绒毛膜绒毛取样检测到的嵌合还是羊膜穿刺术或出生后检测到的嵌合;⑤用于定义嵌合的技术标准(真嵌合与假嵌合)与再发风险相关[8]。
对于产前检查后确定的嵌合病例,建议进行胎儿超声监测表型,并建议继续后续的确认染色体检查,大多数病例可能在出生时或终止妊娠时未发现细微的异常,也未诊断出发育迟缓或产后生长迟缓,但对所有产前诊断为11号染色体三体嵌合的活产儿进行长期随访以进行发育评估是至关重要的。
3 11号染色体单亲二体[uniparental disomy of chromosome 11,UPD(11)]
3.1 UPD(11)概况 人类11号染色体携带了大量的印记基因,主要包括KCN11OT1、CDKN1C、PHLDA2、IGF2、SLC22A18、INS、ANO1、ZC3H12C、NTM。印记基因倾向于聚集在同一染色体区域,该染色体的印记基因簇主要位于11号染色体短臂(p)区域(11p15)。父源UPD(paternal uniparental disomy,pUPD)与母源UPD(maternal uniparental disomy,mUPD)异常可导致两种完全不同的罕见疾病。pUPD可导致BWS,BWS是一种先天性的过度生长并有癌症倾向的疾病,它涉及到染色体11p15.5-11p15.4区域印记基因不均衡表达,涉及印记基因包括H19、IGF2、KCNQ1OT1、CDKN1C。该疾病发病率约1/13 700,男女发病率均等[27,28]。BWS散发性疾病约为85%,遗传性约为15%。BWS的确诊大多在产后,产前妊娠早期结合超声辅助检查可发现脐膨出,妊娠晚期可检测到巨大儿、脏器肿大、巨舌和颌异常等,但产前BWS的检出率仍然未知[29]。有文献报道BWS早产率约为28.9%~53%[30, 31]。大约80%的BWS患者在11p15区域有明确的分子异常,主要包括:①IC1甲基化增加,占5%~10%;②IC2甲基化缺失,约占BWS患者的50%;③pUPD约占BWS患者的20%,其中大多数为不同长度的部分型单亲二体,只有8%的患者为整条父源UPD;④CDKN1基因突变约占5%;⑤1%~2% BWS患者与印记区域的染色体微缺失、微重复或印记基因的点突变有关[32-34]。20%的患者临床诊断明确但仍未检测到分子异常[35]。
mUPD可导致SRS,是一种以宫内和产后发育迟缓为主要特征的临床异质性疾病。SRS涉及到11号染色体印记区域及印记基因与BWS相同,但不同亲本UPD产生疾病截然相反。SRS疾病发病率约为1/100 000[36,37],研究显示SRS疾病中约10%患者为UPD(7),而UPD(11)相对较为少见。SRS疾病的产前报道甚少,若通过观察宫内是否有生长受限,通常需清楚仔细连续的观察到生长发育状态,且通常为妊娠后期,因此在产前做出诊断具有很大的局限性[38-40]。
UPD(11)导致的临床表型已被证实,嵌合型UPD(11)可导致相似的临床表现,嵌合比例通常与临床表现没有直接的相关性[41]。
3.2 UPD(11)形成机理UPD(11) 通常是由三体挽救、单体自救、配子互补和受精后有丝分裂错误等机制导致。图1是母源UPD产生的机理图,同样父源UPD的发生机制相同。三体挽救是减数分裂I过程中染色体不分离产生二体卵母细胞,二体卵母细胞和正常精子受精产生三体合子,卵裂过程中将三体合子中一条染色体丢失,由三体挽救为二体,以恢复正常的染色体数目。如果丢失的染色体是来自正常的配子精子,则保留在合子里的两条染色体均来自母亲,形成母源UPD(图1A)。理论上三体挽救发生单亲二体的概率为1/3。单体挽救是由减数分裂I过程中染色体不分离产生缺体精子,缺体精子和正常卵母细胞受精形成单体,随后母源染色体自我复制产生母源UPD(图1B)。配子互补是由二体卵母细胞和空精子受精产生的母源UPD(图1C)。有丝分裂异常是由正常合子形成后发生染色体间交换,导致染色单体分离重组后染色体中存在纯合状态(图1D),从而形成节段性UPD。
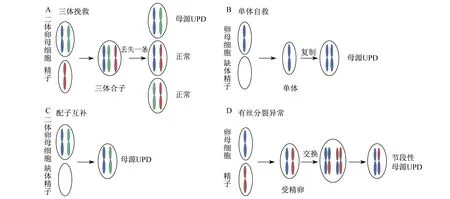
图1 mUPD形成机理图
3.3 UPD(11)的临床特征 BWS临床表现多样,2018年Brioude等[29, 31, 36, 53]发表国际共识,声明其临床表现分为主要特征(2分)和附加特征(1分),主要特征为巨舌、脐膨出、单侧过度生长、多灶性和/或双侧肾母细胞瘤或肾母细胞瘤、高胰岛素血症(持续1周以上,需治疗),病理表现:肾上腺皮质巨细胞畸形,胎盘间质发育不良或胰腺腺瘤病;附加特征为出生体重大于2个标准差、脏器增大、羊水过多、短暂性低血糖、典型BWS肿瘤(神经母细胞瘤、横纹肌肉瘤、Wilms肿瘤、肝母细胞瘤、肾上腺皮质癌或嗜铬细胞瘤)、肾肥大或肝肿大、脐疝、耳部折痕、面部鲜红斑痣等。临床表现评分大于等于4分可诊断为BWS,评分大于等于2分需通过基因检测等方法诊断BWS。BWS同时伴有肿瘤风险增加,肿瘤发生的整体概率为8%,最常见的肿瘤类型为Wilms肿瘤(52%)和肝母细胞瘤(14%),其次是神经母细胞瘤(10%)、横纹肌肉瘤(5%)和肾上腺癌(3%),其中由pUPD导致的肿瘤发生率约为16%,且Wilms肿瘤和肝母细胞瘤的发生率相同[33]。BWS产前结合胎儿超声检查可发现巨舌、巨大儿、腹壁缺损、羊水过多、胎盘增大及孕妇异常生化指标如妊娠高血压、先兆子痫[30,33]。Barisic I等[30]报道了234例BWS患者临床表现,数据显示巨舌80.8%(189/234),腹壁缺损76.9%(180/234),脐膨出52.1%(122/234),肾脏异常26.9%(63/234),单侧过度生长20.9%(49/234)。中山大学第三附属医院产前确诊1例pUPD(11)嵌合体的BWS患者,产前孕16周超声表现胎盘增厚呈蜂窝状,孕21周超声表现脐膨出、双肾增大、回声增强、胎盘增厚呈蜂窝状,孕23周家属选择终止妊娠。
SRS的临床表现和遗传特征异质性较强,不同年龄阶段的突出表现具有差异性,临床中容易出现漏诊和误诊。2015年由Azzi提出①Netchine-Harbison 临床评分系统(Netchine-Harbison clinical scoring system,NH-CSS),提出符合以下6项临床表现中至少4项,则可考虑进行临床SRS诊断。6项主要临床表现:①出生时身高或体重低于平均值2个标准差;②出生后生长发育迟缓(两岁时身高或体重低于平均值2个标准差);③出生时大头畸形(出生头围超过出生体重/身高的1.5个标准差);④前额突出(1~3岁时侧面显示前额突出);⑤身体不对称[下肢长度差大于0.5cm,或下肢长度差小于0.5cm伴有其他2个及以上部位不对称(其中1个为非面部)];⑥喂养困难(2岁体重指数小于平均值2个标准差或使用喂养管)。其他临床表现包括三角脸、小下颌畸形、第五手指弯斜、并指、前囟门延迟闭合、牙齿拥挤、脊柱侧凸、出汗过度、低血糖、泌尿生殖系统异常、牛奶咖啡斑、反流性食管炎等消化系统异常,部分患者出现认知、运动和语言发育迟缓、学习障碍等[37, 39, 42-44]。
11号染色体单亲同二体[isodisomy 11,isoUPD(11)]增加了隐性遗传性疾病的风险。Chang等[45]报道了携带有HBB等位基因杂合突变的UPD可导致β地中海贫血,临床表现为早期严重贫血、需持续性输血及生长发育迟缓等。Damaj和Vinatier等[46, 47]报道了携带有ABCC8基因杂合突变的UPD可导致先天性高胰岛素血症,临床表现为新生儿严重低血糖,持续性反复低血糖可致使脑损伤等。
3.4 UPD(11)的治疗及预后 父源UPD所导致BWS,早发现、早诊断、早治疗对BWS生存至关重要。①产前或刚出生患儿提示或诊断为BWS,应在出生后的最初几天进行低血糖筛查,避免出现严重的新生儿低血糖。BWS患儿在1岁内,舌会随着下颌骨的生长而表现出巨舌,但随着年龄的增长,1~3岁后舌缓慢生长,但仍是被包含在口腔内,大多数不需要治疗。如巨舌程度严重导致进食受阻、发声困难和上呼吸道梗阻致呼吸困难时,需要手术治疗[48]。②生长方面,定期监测生长参数,如半增生累计躯干或双下肢不均衡增长,会造成审美缺陷和躯干背部疼痛。如双肢体长度差小于0.5cm,步态并无明显表现的患儿,可不需手术治疗。双肢体长度差小于2cm,可采用增高垫等方法修正,从而改善步态及平衡性。如双肢体长度差大于2cm,可行手术治疗,并在适当的时候考虑对较长的下肢行骺板阻滞术等治疗方法[35]。③肿瘤监测方面,建议对所有疑似或诊断为BWS患儿,均应行肿瘤筛查及检测,建议每3个月彩超复查一次,直至8岁,日后可每年复查1次。建议每3个月检测肿瘤标志物AFP等、血常规及血糖,直至4岁,日后可每年复查1次[31, 49, 50]。
SRS患者无特殊的治疗方法,主要采取对症处理。通过多学科干预以改善患者的生活质量:①早期喂养和营养支持,早期筛查肠道功能障碍(胃食道反流、便秘等),给予适当的干预治疗、营养支持治疗以预防低血糖发生,但也要避免过度补充营养加速生长可能带来的代谢异常风险,疾病状态下更容易导致低血糖,需早诊断早干预。②生长方面,重组人生长激素是目前改善SRS身高的主要治疗方法。该疗法有助于改善患者机体成分比例、食欲和精神运动发育,同时能够降低低血糖的风险和加快生长速度。多数患者在2~4岁开始接受生长激素治疗,若6个月内身高差小于2cm且骨龄大于14岁(女性)或大于16岁(男性)时,终止治疗,若青春期发育提前的患者可考虑促性腺激素释放激素类似物治疗。③代谢方面,建议监测患者的血糖和胰岛素水平,尤其是生长激素治疗期间,成人期建议坚持科学营养和良好的运动习惯,以降低代谢异常的风险。④骨骼方面,SRS患者身体不对称性可能导致脊柱侧凸,尤其在生长激素治疗前后应由脊柱外科医生评估其侧凸程度和相应的矫正方法。⑤认知方面,定期接受儿科医生评估,早发现语言、学习能力和运动相关的异常,并给予相应的治疗[39, 43, 51, 52]。
3.5 UPD(11)的再发风险评估及遗传咨询意见 大多数患儿是出生后确诊,但产前通过胎儿超声影像可观察到部分临床表现。胎儿超声期如有相关影像学异常特征,建议孕妇行有创检测即羊膜腔穿刺术进一步的诊断,早期宫内诊断可更好告知产妇分娩计划、围产期风险及患儿存在的潜在风险。同时为孕妇及家庭成员提供复发风险的遗传咨询,研究报道,BWS和SRS疾病的再发风险<1%[29, 38, 39, 42,48, 53]。
综上所述,本文结合相关数据库、既往文献报道,分别对11号染色体三体、嵌合型三体以及母源和父源11号单亲二体的发生机理、发生率、临床特征、治疗预后、实验室检查、再发风险评估及遗传咨询等方面进行分析总结,为11号染色体的产前遗传学诊断及进一步遗传咨询提供帮助。

