新型钠-葡萄糖协同转运蛋白2抑制剂鲁格列净治疗2型糖尿病的临床研究进展
彭琴 窦芳 胡冬梅 李韦韦 王明明 张伟 赵先
摘 要 目的:总结新型钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂鲁格列净治疗2型糖尿病(T2DM)的临床研究进展,为鲁格列净的合理应用提供参考。方法:以“SGLT2抑制剂”“鲁格列净”“糖尿病”“SGLT2 inhibitor”“Luseogliflozin”“Diabetes”为主题词,在中国知网、维普、万方数据、PubMed、Elsevier和Web of Science等数据库中组合检索2010年1月1日-2018年12月31日发表的相关文献,对鲁格列净的作用机制、临床药动学、临床药效学、有效性和安全性等方面进行综述。结果与结论:鲁格列净是一种SGLT2抑制剂类降糖药,其作用机制独立于β细胞外的非胰岛素依赖性口服降糖药物,是通过抑制肾脏近曲小管对葡萄糖的重吸收,增加尿中葡萄糖的排泄而达到控制血糖的目的。临床上,鲁格列净无论单药治疗还是联合胰岛素、二肽基肽酶4抑制剂、α-糖苷酶抑制剂等,均表现出显著的降血糖效果,同时还有减轻体质量、降低血压、改善脂质代谢和尿酸代谢的作用。该药的不良反应较轻、持续时间短暂,主要有鼻咽炎、上呼吸道感染、β2微球尿蛋白升高等;单用时不增加低血糖发生的风险,与胰岛素或磺脲类药物联用时,可一定程度降低患者体质量指数(BMI)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)等水平,但会增加低血糖发生风险。
关键词 2型糖尿病;鲁格列净;SGLT2抑制剂;药动学;药效学;疗效;安全性
糖尿病是常见代谢疾病,临床上以2型糖尿病(T2DM)居多,预计全球糖尿病患者人数将从2015年的4.15亿增加到2040年的6.42亿[1]。我国成人糖尿病患者数量高达 1.14 亿,位居世界第一,占全球成人糖尿病患者总数的1/4以上,且这一数据仍在继续增长,预计到 2045 年将增至 1.2 亿[2]。据世界卫生组织估计,2005-2015年中国由于糖尿病及相关心血管疾病导致的经济损失高达5 577亿美元,糖尿病及其并发症已成为我国社会和家庭的严重经济负担[3]。目前,治疗T2DM常用的口服降糖药包括促胰岛素分泌剂类、二甲双胍类、α-糖苷酶抑制剂类、噻唑烷二酮类、二肽基肽酶4(DPP-4)抑制剂等,其中促胰岛素分泌剂类又分为磺脲类和非磺脲类;注射降糖药有胰岛素及类似药物、胰高血糖素样肽1(GLP-1)受体激动剂等[3]。但降糖药常引起不同程度的不良反应,如低血糖、体质量增加、心血管事件等[4]。因此,寻找和开发具有新型作用机制、毒副作用小的T2DM治疗药物,已成为亟待解决的热点问题。
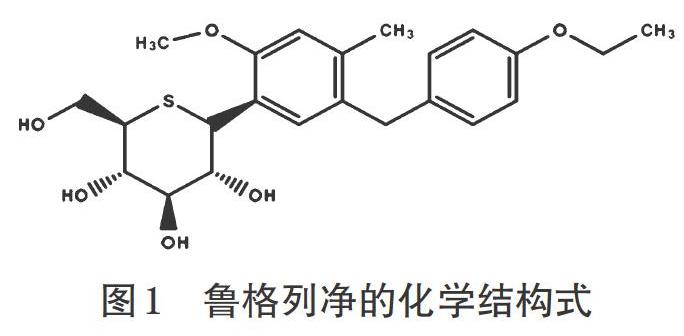
钠-葡萄糖协同转运蛋白2(Sodium-dependent glucose transporters 2,SGLT2)抑制剂为一类治疗2型糖尿病的新药,其可通过在肾脏近曲小管部位抑制葡萄糖的重吸收,增加尿中葡萄糖的排泄,发挥降低血糖的作用[4]。鲁格列净为一种新型SGLT2抑制剂,于2014年3月24日在日本首次被批准用于治疗T2DM[5],目前尚未在中国上市,其化学结构式详见图1。由于鲁格列净目前的上市时间较短,其临床药效学和安全性等方面还需要深入的研究和探讨,因此笔者以“钠-葡萄糖协同转运蛋白2”“SGLT2”“鲁格列净”“糖尿病”“SGLT2 inhibitor”“Luseogliflozin”“Diabetes”为主题词,在中国知网、维普、万方数据、PubMed、Elsevier和Web of Science等数据库中组合检索2010年1月-2018年12月发表的相关文献,就鲁格列净的有效性与安全性进行综述,以期为鲁格列净的合理应用提供参考。
1 作用机制
肾脏在维持人体内葡萄糖平衡中发挥了重要作用,血液中的葡萄糖在经过肾小管时会被全部重吸收,正常情况下尿液中几乎不含葡萄糖;但是,当血液中的葡萄糖浓度升高到一定水平时,肾小管的重吸收能力将达到饱和,不能将过多的葡萄糖重吸收,從而出现尿糖[6]。由于葡萄糖不能自由通过细胞膜,这个重吸收过程是由两类葡萄糖转运蛋白来完成的,其中比较重要的是SGLT2和普通的葡萄糖转运体(GLUT)[7]。SGLT共6种,其中分布于肾脏的主要有SGLT1和SGLT2两种,而SGLT2在葡萄糖的重吸收过程中承担了90%的功能,起主要作用[7]。
鲁格列净作为人肾脏中高选择性的葡萄糖共转运体SGLT2抑制剂,是一种作用机制独立于胰岛B细胞外的非胰岛素依赖性新型口服降糖药物,可通过抑制肾小管中的SGLT2,从而达到降低血糖的作用[3]。该药的耐受性良好,降血糖效果显著且持续时间长;此外,其还可以降低患者体质量、改善新陈代谢,尤其对体质量指数(BMI)高的患者可能更加有益[6]。
2 临床药动学特点
Sasaki T等[8]对日本40名健康志愿者口服鲁格列净的药动学进行了一项随机、单盲、安慰剂对照试验,采用单剂量递增和多剂量递增方法进行研究。单剂量递增:受试者单次口服鲁格列净1~25 mg后,达到最大血浆浓度(cmax)的平均时间为0.667~2.25 h,cmax和浓度-时间曲线下面积(AUC)呈剂量依赖性增加;尿糖排泄率(UGE)随剂量增加而升高,从18.9 ~70.9 g/d不等;未见食物对药动学的影响。多剂量递增:受试者连续7 d口服鲁格列净 5或 10 mg,qd后,其平均血浆半衰期(t1/2)为9.14~10.7 h;5 mg和10 mg鲁格列净的平均日排泄率分别为3.74%~4.69%和3.58%~4.23%。有研究表明,口服鲁格列净后,受试者的cmax、AUClast(从给药时间开始到最后一个点的曲线下面积)和AUCinf(从给药开始到理论外推无穷远时间的曲线下面积)与剂量呈正比,不受食物摄入量的影响,男、女性别之间差异无统计学意义,单次给药(≤9 mg)后平均t1/2(9.23~13.8 h)无剂量依赖性[9]。这提示在服用鲁格列净时,无需将年龄和性别的差异纳入调整剂量的考虑范围。
Sasaki T等[8]对日本T2DM患者采用多剂量递增法口服鲁格列净后的药动学进行了研究,40例T2DM患者被随机分组接受每日0.5、1、2.5、5 mg的鲁格列净或安慰剂,治疗7 d。结果显示,鲁格列净及其活性代谢产物的血浆药物浓度与给药剂量呈正比;与安慰剂组比较,鲁格列净可呈剂量依赖性地增加UGE(分别为49.2、66.5、89.4、101 g/d),而所有患者的餐后血糖AUC和0~16 h平均血糖均显著降低;将鲁格列净给药方案设置为每日1次,可降低T2DM患者的血糖水平(包括轻度T2DM和糖耐量受损患者),且不会增加低血糖的发生风险。
Samukawa Y等[1]研究了57例不同程度肾功能损伤患者服用鲁格列净的药动学和药效学特征。研究将患者分为肾功能正常组(G1)、轻度肾功能损伤组(G2)、轻度至中度损伤组(G3a)、中度至重度损伤组(G3b)、严重损伤组(G4),分别单剂量口服鲁格列净5 mg。结果显示,G2组患者的cmax、AUClast、AUCinf与G1组比较,差异无统计学意义;但肾小球滤过率(eGFR)较低的G3a组、G3b组、G4组患者的血药浓度升高较慢,cmax略有降低;此外,这3组的AUC较G1组变化更小。由此可见,中、重度肾功能损伤的患者可能对鲁格列净治疗反应不充分,因此应用该药时需谨慎。
3 临床药效学特点
3.1 单一用药的疗效评价
在Seino Y等[10]进行的一项为期12周的临床Ⅱ期研究中,将采用饮食控制且糖化血红蛋白(HbA1c)水平为6.9%~10.5%的282例患者随机分为5组,采用双盲法分别给予患者鲁格列净1、2.5、5、10 mg或安慰剂口服,每日1次,治疗12周。结果显示,与安慰剂组比较,鲁格列净各剂量组患者的HbA1c水平、体质量和低血糖发生率均显著降低,且不良事件的发生率组间比较差异无统计学意义,患者耐受性良好。
在上一项研究的基础上,Seino Y等[11]根据日本口服降糖药和长期治疗的临床评价指南,进行了另一项评价鲁格列净单药治疗T2DM患者长期疗效和安全性的试验,对HbA1c水平在6.9%~10.5%的患者进行饮食控制和运动治疗,同时给予口服鲁格列净2.5 mg,qd,疗程52周;对于血糖控制不佳的患者,第24周时可将剂量增加至5 mg,qd。接受治疗的患者共299例,有279例完成了这项研究。52周后,与基线值比较,鲁格列净显著降低了患者HbA1c水平、空腹血糖(FPG)和体质量;当鲁格列净剂量升至5 mg时可进一步改善血糖控制效果。在这项长期研究中,鲁格列净单药治疗降血糖效果显著,患者体质量显著减轻,且耐受性良好。
3.2 联合用药的疗效评价
3.2.1 与胰岛素联用 在Seino Y等[12]进行的一项为期 52周的多中心开放试验中,233例T2DM患者在接受鲁格列净治疗前停用除胰岛素外的所有降糖药12周,随后患者采用随机、双盲的方法分为两组,分别口服鲁格列净2.5 mg,qd或安慰剂,连续服用16周;接下来两组患者同时口服鲁格列净2.5 mg,qd,连续服用36周。在整个试验过程中,所有患者均给予固定剂量的胰岛素进行治疗。在28、32、36、40周时,若检测结果显示患者HbA1c≥7.4%,且无明显药品不良反应,则鲁格列净的剂量可增加至5 mg。研究结果显示,鲁格列净组患者的HbA1c、FPG、餐后2 h血糖及体质量较安慰剂组均显著降低,持续52周。在安慰剂组中,转换为口服鲁格列净后患者的血糖控制良好,体质量减轻,且不良反应较小。采用鲁格列净治疗时,患者低血糖的发生率为33.3%,未见严重的不良反应。由此可见,在胰岛素治疗中联用鲁格列净可显著降低患者血糖、减轻体质量,且耐受性良好。
3.2.2 与DPP-4抑制剂联用 对单药治疗血糖控制不佳的T2DM患者,可同时使用2种或2种以上作用机制不同的降糖药进行治疗。Kusunoki M等[13]对鲁格列净与DPP-4抑制剂(包括西格列汀、阿拉格列汀、维格列汀、利格列汀和阿格列汀)联用能否进一步控制血糖进行了研究。这是一项非随机回顾性研究,其将214例T2DM患者分为两组,一组使用鲁格列净2.5 mg单药治疗,另一组接受鲁格列净2.5 mg+DPP-4抑制剂(西格列汀100 mg或阿拉格列汀200 mg或維格列汀100 mg或利格列汀5 mg或阿格列汀25 mg)联合治疗。每日早餐前或早餐后给药1次,治疗 6个月后,鲁格列净单药治疗组患者BMI值相对于基线值降低了0.5 kg/m2(P<0.01),HbA1c水平降低了0.1%(P>0.05),天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、血清γ-谷氨酸转氨酶(γ-GTP)水平分别降低了8、9、8 U/L(P<0.05);联合用药治疗组患者BMI相对于基线值降低了0.9 kg/m2(P<0.01),HbA1c水平降低了0.2%(P<0.01),AST、ALT、γ-GTP水平分别降低了3、7、6 U/L(P<0.05)。研究结果表明,单药治疗组和联合用药治疗组患者BMI、AST、ALT、γ-GTP水平均有一定程度下降,但单药治疗组HbA1c水平未显著降低,而联合用药治疗组HbA1c水平显著降低,说明DPP-4抑制剂联用鲁格列净治疗效果良好。
3.2.3 与α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类药物联用 Seino Y等[14]进行了一项为期52周的Ⅲ期临床试验,比较了单用鲁格列净与鲁格列净联合α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类降糖药的疗效。首先采用随机、双盲的方法将274例受试者分为两组,分别口服鲁格列净 2.5 mg,qd或安慰剂,疗程为24周;接下来28周为非盲期,两组患者在口服鲁格列净2.5 mg,qd的基础上,联用α-糖苷酶抑制剂、双胍类、噻唑烷二酮类或格列奈类降糖药。24周双盲期结束时,鲁格列净组患者HbA1c水平较安慰剂组显著降低(P<0.001),低血糖的发生率为8.7%;28周非盲期结束后,与基线值比较,采用鲁格列净联用α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类降糖药患者的HbA1c水平均显著降低(P<0.001),体质量均减轻(包括联用了可能引起体质量增加的噻唑烷二酮类药物的患者),低血糖的发生率为10.7%。该研究结果表明,鲁格列净与不同作用机制(α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类)的口服降糖药联用时,可通过降低HbA1c、FPG水平来改善血糖的控制情况;而且,无论鲁格列净是单用还是联合其他口服降糖药,均能显著且持续地减轻患者体质量。
4 安全性
多项临床试验结果表明,鲁格列净具有良好的安全性和耐受性,其不良反应较轻、持续时间短暂,且与剂量无关[8-14]。在单药治疗时,服用鲁格列净2.5 mg的患者不良事件的发生率与服用磺酰脲类降糖药的对照组相近,而严重不良反应发生率及停药率显著低于对照组;其中最常见的不良反应为鼻咽炎和低血糖,绝大多数不良反应较轻,均未出现死亡病例[14]。
在一项为期52周的鲁格列净单药治疗试验中,299例患者口服鲁格列净2.5 mg;对于血糖控制不佳的患者,第24周时可将剂量增加至5 mg。结果显示,受试者不良事件和不良反应的发生率分别为75.3%、16.7%,多数不良反应较轻,且无死亡病例;严重不良事件发生率和停药率分别为5.4%、3.7%,其中大部分严重不良事件被判定为与试验药物无关,且未观察到任何特殊不良事件有增加趋势。其中,常见的不良反应(发生率≥5%)为鼻咽炎、上呼吸道感染、β2微球尿蛋白升高和C反应蛋白增加;特殊不良事件包括低血糖、尿道生殖器感染、尿频及血容量下降等。除1例患者发生中度低血糖外,其余均为轻度;发生泌尿系统和生殖系统感染的均为女性;此外,与非老年患者相比,老年患者尿频和血容量下降的发生率无增加趋势。在第24周上调鲁格列净剂量后,不良事件的发生率与未上调组相近,药物不良反应发生率与未上调组相比轻微下降[11]。
Seino Y等[14]进行的一项为期52周的Ⅲ期临床试验显示,鲁格列净与α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类降糖药联用时,各联合用药组间不良事件和不良反应发生率分别为71.2%~84.2%、12.4%~25.4%;其中常见的不良事件为便秘、鼻咽炎、上呼吸道感染、β2微球尿蛋白升高、C反應蛋白增加、尿白细胞阳性、低血糖、腰痛等,多为轻度;每组有3~11例患者发生了严重不良事件;不良事件导致每组4~8例受试者停止服药。该研究共观察到4例严重不良反应,分别为不稳定性心绞痛(联用α-糖苷酶抑制剂时发生)、急性心肌梗死(联用α-糖苷酶抑制剂时发生)、前列腺炎(联用噻唑烷二酮类时发生)。与单药治疗组比较,鲁格列净与α-糖苷酶抑制剂、双胍类、噻唑烷二酮类、格列奈类降糖药联用时,低血糖的发生率相近。已知噻唑烷二酮类和双胍类的常见不良反应分别为水肿和乳酸酸中毒,但在上述联合用药治疗中均未出现该不良反应;胃肠道症状如便秘、腹泻、呕吐和胃炎是α-糖苷酶抑制剂和双胍类降糖药常见的不良反应,但在所有联合用药组中,与胃肠道相关的不良反应较轻。该项研究结果还表明,鲁格列净与其他口服降糖药联用时,并未加重联用药物原有的不良反应,如尿道和生殖器感染、尿频和尿容量衰竭等,其具体原因还需要进一步研究。
5 其他
肥胖与糖代谢异常密切相关,肥胖人群的增加已经成为一个全球性健康问题。此外,某些降糖药不适用于肥胖患者,如磺脲类药物有增加体质量的风险。鲁格列净有减轻体质量的作用,可能对肥胖的糖尿病患者有益,但目前临床证据有限。Sakai S等[15]使用鲁格列净单药治疗基线BMI不同的T2DM患者,探讨该药对不同程度肥胖患者的疗效和安全性。试验共纳入1 031例患者,按照BMI分为5组:低至中组(BMI<22.5 kg/m2,n=222)、中组(BMI 22.5~25 kg/m2,n=270)、高1组(BMI 25~27.5 kg/m2,n=262)、高2组(BMI 27.5~30 kg/m2,n=142)和极高组(BMI≥30 kg/m2,n=135)。所有患者于早餐前口服鲁格列净2.5 mg(qd),共52周。结果显示,在安全性方面,各组间不良事件和不良反应发生率相近,且大多数程度较轻。常见的不良事件为鼻咽炎、C反应蛋白增加、上呼吸道感染、便秘、背部疼痛、β2微球尿蛋白升高、咽炎、腹泻等。各组与心血管疾病相关的不良反应发生情况相近:低到中组、中组、高1组、高2组、极高组分别有4、4、1、2、2例;其中严重不良反应分别为急性心肌梗死(低到中组、高2组各1例,共2例)、脑梗死(低到中组、中组各2例,共4例)。在各组中,尿路感染和生殖器感染的发生率相近,女性患者发生率高于男性,且多数感染程度较轻。在BMI较高的人群中,体质量下降、空腹胰岛素水平和新陈代谢的改变(包括高血压和三酰甘油血症)尤为明显。该项研究表明,鲁格列净是一种有效且耐受良好的药物,且对BMI较高的患者可能更有益。Zhang Y等[16]研究表明,对于由近端小管葡萄糖摄取功能障碍引起的缺血/再灌注损伤,鲁格列净可以防止缺血/再灌注后血管内皮细胞减少和肾纤维化,发挥保护肾损伤的作用。
6 结语
综上所述,鲁格列净作为一种针对新靶点的新型作用机制的降糖药,可为T2DM的治疗提供更多的选择,无论单药治疗还是联合用药均有较好的疗效和安全性。目前,SGLT2抑制剂的作用正在被不断认可,2015年美国内分泌学会(American Association of Clinical Endocrinologists,AACE)糖尿病综合管理方案、美国糖尿病协会(American Diabetes Association,ADA)糖尿病诊疗标准中都对鲁格列净作了更高等级的推荐[17]。但是,目前鲁格列净还未在我国上市,其安全性还需更多的临床研究加以验证。
参考文献
[ 1 ] SAMUKAWA Y,HANEDA M,SEINO Y,et al. Pharmacokinetics and pharmacodynamics of luseogliflozin,a selective SGLT2 inhibitor,in Japanese patients with type 2 diabetes with mild to severe renal impairment[J]. Clin Pharmacol Drug Dev,2018,7(8) :820-828.
[ 2 ] 杨文英.中国糖尿病的流行特点及变化趋势[J].中国科学:生命科学,2018,48(8):812-819.
[ 3 ] MARIN-PEALVER JJ,MARTIN-TIMON I,SEVILLANO- COLLANTES C,et al. Update on the treatment of type 2 diabetes on the mellitus[J]. World J Diabetes,2016,7(17):354-395.
[ 4 ] 杨君义.钠-葡萄糖共转运体2抑制剂鲁格列净[J].中国新药与临床杂志,2016,35(5):322-325.
[ 5 ] MARKHAM A,ELKINSON S. Luseogliflozin:first glo- bal approval[J]. Drugs,2014,74(8):945-950.
[ 6 ] GALLO LA,WRIGHT EM,VALLON V. Probing SGLT2 as a therapeutic target for diabetes:basic physiology and consequences[J]. Diab Vasc Dis Res,2015,12(2):78-89.
[ 7 ] KANAI Y,LEE WS,YOU G,et al. The human kidney low affinity Na+/glucose cotransporter SGLT2. Delineation of the major renal reabsorptive mechanism for D-glucose[J]. J Clin Invest,1994,93(1):397-404.
[ 8 ] SASAKI T,SEINO Y,FUKATSU A,et al. Pharmacokine- tics,pharmacodynamics,and safety of luseogliflozin in Japanese patients with type 2 diabetes mellitus:a rando- mized,single-blind,placebo-controlled trial[J]. Adv Ther,2015,32(4):319-340.
[ 9 ] KUMAGAI Y,HASUNUMA T,SAKAI S,et al. Rando- mized,controlled,thorough QT/QTc study shows absence of QT prolongation with luseogliflozin in healthy Japanese subjects[J]. PLoS One,2015. DOI:10.1371/journal.pone.0139873.
[10] SEINO Y,SASAKI T,FUKATSU A,et al. Dose-finding study of luseogliflozin in Japanese patients with type 2 diabetes mellitus:a 12-week,randomized,double-blind,placebo-controlled,phase Ⅱ study[J]. Curr Med Res Opin,2014,30(7):1231-1244.
[11] SEINO Y,KAKU K,INAGAKI N,et al. Fifty-two-week long-term clinical study of luseogliflozin as monotherapy in Japanese patients with type 2 diabetes mellitus inadequately controlled with diet and exercise[J]. Endocr J,2015,62 (7):593-603.
[12] SEINO Y,SASAKI T,FUKATSU A,et al. Efficacy and safety of luseogliflozin added to insulin therapy in Japanese patients with type 2 diabetes:a multicenter,52-week,clinical study with a 16-week,double-blind period and a 36-week,open-label period[J]. Curr Med Res Opin,2018,34(6):981-994.
[13] KUSUNOKI M,NATSUME Y,MIYATA T,et al. Effects of concomitant administration of a dipeptidyl peptidase-4 inhibitor in Japanese patients with type 2 diabetes showing relatively good glycemic control under treatment with a sodium glucose co-transporter 2 inhibitor[J]. Drug Res,2018,68(12):704-709.
[14] SEINO Y,INAGAKI N,HANEDA M,et al. Efficacy and safety of luseogliflozin added to various oral antidiabetic drugs in Japanese patients with type 2 diabetes mellitus[J]. J Diabetes Investig,2015,6(4):443-453.
[15] SAKAI S,KAKU K,SEINO Y,et al. Efficacy and safety of the SGLT2 inhibitor luseogliflozin in Japanese patients with type 2 diabetes mellitus stratified according to baseline body mass index:pooled analysis of data from 52- week phase Ⅲ trials[J]. Clin Ther,2016,38(4):843-862.
[16] ZHANG Y,NAKANO D,GUAN Y,et al. A sodium-glucose cotransporter 2 inhibitor attenuates renal capillary injury and fibrosis by a vascular endothelial growth factor-dependent pathway after renal injury in mice[J]. Kidney Int,2018,943(3):1-12.
[17] HANDELSMAN Y,BLOOMGARDEN ZT,GRUNBE- RGER G,et al. American association of clinical endocrinologists and American college of endocrinology-clinical practice guidelines for developing a diabetes mellitus comprehensive care plan 2015[J]. Endocr Pract,2015,21(Suppl 1):S1-S87.
(收稿日期:2020-04-27 修回日期:2020-09-15)
(編辑:罗 瑞)

