口服索马鲁肽治疗2型糖尿病疗效和安全性的系统评价
覃渝 左丹妮 高倩 夏培元

摘 要 目的:系统评价口服胰高血糖素样肽1受体激动药索马鲁肽治疗2型糖尿病(T2DM)的疗效与安全性,为临床治疗T2DM提供循证参考。方法:计算机检索PubMed、Embase、Cochrane图书馆、ClinicalTrials.gov、中国生物医学文献数据库、中国期刊全文数据库、中文科技期刊数据库,收集各数据库建库起至2020年5月间发表的口服3、7、14 mg索马鲁肽(试验组)对比安慰剂或其他降糖药(对照组)治疗T2DM的疗效与安全性的随机对照试验(RCT)。对符合纳入标准的临床研究进行资料提取,并采用Cochrane系统评价手册5.1.0进行质量评价后,采用Rev Man 5.3统计软件进行Meta分析。结果:共纳入6项RCT,合计5 334例患者。Meta分析结果显示,与对照组比较,试验组方案可显著降低HbA1c水平{治疗26周[MD=-0.62,95%CI(-0.88,-0.36),P<0.001]、52周[MD=-0.51,95%CI(-0.72,-0.29),P<0.001]}、FPG水平{治疗26周[MD=-0.89,95%CI(-1.31,-0.48),P<0.001]、52周[MD=-0.68,95%CI(-1.05,-0.31),P<0.001]},显著提高HbA1c<7.0%达标率{治疗26周[RR=2.22,95%CI(1.68,2.93),P<0.001]、52周[RR=2.02,95%CI(1.51,2.70),P<0.001]},同时可显著降低治疗26、52周的自测血糖水平、体质量和收缩压(DBP),治疗26周的自测餐后血糖水平和治疗52周的舒张压(SBP)(P<0.05)。索馬鲁肽不同剂量的亚组分析中,与对照组比较,3 mg亚组方案可显著降低治疗26、52周的体质量以及治疗52周的DBP;7 mg亚组方案可显著降低治疗26、52周的HbA1c水平以及体质量,治疗26周的FPG水平、自测血糖水平以及治疗52周的SBP,提高治疗26周的HbA1c<7.0%达标率;14 mg亚组方案可显著降低治疗26、52周的HbA1c、FPG、自测血糖水平、体质量和SBP以及治疗26周的自测餐后血糖水平,提高治疗26、52周的HbA1c<7.0%达标率(P<0.05)。试验组患者低血糖事件发生率[RR=0.84,95%CI(0.72,0.97),P=0.02]显著低于对照组,但不良事件发生率[RR=1.23,95%CI(1.09,1.40),P=0.001]和胃肠道不良事件发生率[RR=1.99,95%CI(1.55,2.57),P<0.001]显著高于对照组。两组患者严重不良事件发生率和感染发生率比较,差异均无统计学意义(P>0.05)。结论:口服索马鲁肽可有效降低T2DM患者血糖水平、提高HbA1c<7.0%达标率、减轻体质量、降低血压水平,其中以14 mg亚组疗效最优。但在使用索马鲁肽时应注意不良事件尤其是胃肠道不良事件的发生。
关键词 索马鲁肽;2型糖尿病;疗效;安全性;系统评价
ABSTRACT OBJECTIVE: To systematically evaluate the efficacy and safety of glucagon-like peptide 1 receptor agonists semaglutide in the treatment of type 2 diabetes mellitus (T2DM), and to provide evidence-based reference for clinical treatment of T2DM. METHODS: Retrieved from PubMed, Embase, the Cochrane library, ClinicalTrials.gov, CBM, CNKI and VIP, randomized controlled trials (RCT) about oral semaglutide 3 mg, 7 mg and 14 mg (trial group) versus placebo or other glucose-lowering drugs (control group) in the treatment of T2DM were selected during the inception to May 2020. After extracting data from clinical studies that met the inclusion criteria, quality evaluation was carried out with Cochrane systematic evaluation manual 5.1.0, Meta-analysis was performed by using Rev Man 5.3 statistical software. RESULTS: A total of 6 RCTs involving 5 334 patients were included. Results of Meta-analysis showed that compared with control group, trial group could significantly decreased HbA1c level {26 weeks [MD=-0.62,95%CI(-0.88, -0.36),P<0.001], 52 weeks [MD=-0.51,95%CI(-0.72, -0.29),P<0.001]}, FPG level {26 weeks [MD=-0.89, 95% CI (-1.31, -0.48), P<0.001], 52 weeks [MD=-0.68,95%CI(-1.05,-0.31), P<0.001]}; significantly increased the compliance rate of HbA1c<7% {26 weeks [RR=2.22,95%CI(1.68,2.93),P<0.001], 52 weeks [RR=2.02,95%CI(1.51,2.70),P<0.001]}; significantly decreased the self-measured plasma glucose, body weight and diastolic blood pressure (DBP) after 26 and 52 weeks of treatment, self-measured postprandial glucose after 26 weeks of treatment and systolic blood pressure (SBP) after 52 weeks of treatment (P<0.05). Subgroup analysis of different doses showed that compared with control group, 3 mg subgroup could significantly decreased the body weight after 26 and 52 weeks of treatment and DBP after 52 weeks of treatment; 7 mg subgroup could significantly decreased the HbA1c levels and body weight after 26 and 52 weeks of treatment, the FPG levels and the self-measured plasma glucose after 26 weeks of treatment and the SBP after 52 weeks of treatment, increased the compliance rate of HbA1c<7% after 26 weeks of treatment. The 14 mg subgroup could significantly decreased the HbA1c levels, the FPG levels, the self-measured plasma glucose levels, the body weight and the SBP after 26 and 52 weeks of treatment, and self-measured postprandial glucose after 26 weeks of treatment, while increased the complication rate of HbA1c<7% after 26 and 52 weeks of treatment (P<0.05). The incidence of hypoglycemia events in trial group [RR=0.84,95%CI(0.72,0.97), P=0.02] was significantly lower than control group, but the incidence of adverse events [RR=1.23, 95%CI(1.09,1.40), P=0.001] and gastrointestinal reaction [RR=1.99,95%CI(1.55,2.57), P<0.001] were significantly higher than control group. There was no significant difference in the incidence of serious adverse events or infection between 2 groups (P>0.05). CONCLUSIONS: Oral semaglutide can effectively decrease blood glucose level, increase the compliance rate of HbA1c<7.0%, reduce the body weight and blood pressure level of T2DM patients, and the 14 mg subgroup has the best effect. When using somaluptide, we should pay attention to the occurrence of adverse events, especially gastrointestinal adverse events.
KEYWORDS Semaglutide; Type 2 diabetes mellitus; Efficacy; Safety; Systematic review
据国际糖尿病联盟(International Diabetes Federation,IDF)2019年发布的数据显示,全球约有4.63亿成年人患有糖尿病,预计2045年这一数字将增至7亿[1]。2019年,我国糖尿病患者约有1.16亿,且呈现逐年增加的趋势,预计2030年将达到1.43亿。我国已成为世界上糖尿病患者最多的国家,其中约95%为2型糖尿病(Type 2 diabetes mellitus,T2DM)患者[2-3]。长期有效控制血糖对于预防和减少糖尿病并发症有重大意义。虽然目前治疗T2DM有很多药物和可行的给药方案,但仍有相当部分患者不能有效控制血糖,且糖尿病患者數量并没有因此得到有效控制,同时很多患者服用降糖药后发生体质量增加、低血糖及心血管死亡风险升高等不良反应。因此,迫切需要更多疗效好且不良反应少的降血糖药。
胰高血糖素样肽1受体激动剂(Glucagon-like peptide 1 receptor agonists,GLP-1RA)可以激动GLP-1受体,刺激胰岛素分泌和抑制胰高血糖素释放[4],并能延缓胃排空,通过中枢性的食欲抑制来减少进食量,且呈葡萄糖浓度依赖性[5]。此外,GLP-1RA还具有显著降低体质量和改善血脂、血压的作用[6]。目前,全球已有9种GLP-1RA上市,我国上市的品种有艾塞那肽、利拉鲁肽等,给药方式均为皮下注射[7]。索马鲁肽口服制剂是世界上首个GLP-1RA口服制剂,于2019年9月被美国FAD批准上市用于治疗T2DM。相较于注射剂,口服剂型的疗效、安全性、适用人群、药物相互作用方面均有较大优势,会大大增加患者的依从性[8]。同时相关的血糖控制成本研究结果显示,相较于度拉鲁肽、利拉鲁肽、艾塞那肽等GLP-1RA注射剂,索马鲁肽14 mg口服制剂可能具有成本-效益优势[9]。且有研究报道,索马鲁肽口服制剂可降低主要心血管不良事件风险,提示其有望成为第2个具有心血管获益的GLP-1RA类药物[10]。目前,该药在我国尚未上市。国内外均没有关于索马鲁肽口服制剂对比安慰剂或其他降糖药物治疗T2DM的疗效和安全性比较的系统评价,特别是在不同剂量对疗效与安全性的影响方面。因此,本研究拟采用Meta分析方法,系统评价索马鲁肽口服制剂对比安慰剂或其他降糖药治疗T2DM的随机对照试验(RCT),以期为该药在我国的上市和临床应用提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的中、英文RCT,无论是否采用盲法均纳入研究。
1.1.2 研究对象 诊断为T2DM的患者,诊断依据符合世界卫生组织(WHO)或美国糖尿病学会(ADA)标准。筛选前90天未行降糖药物治疗,或接受不超过2种口服降糖药治疗加或不加基础/预混胰岛素。患者性别、种族、国籍、病程、并发症不限,年龄≥18岁。
1.1.3 干预措施 试验组患者口服索马鲁肽,剂量为3、7、14 mg,每日1次;对照组采用安慰剂或其他降糖药物治疗。
1.1.4 结局指标 疗效指标:①糖化血红蛋白(HbA1c)降低值;②HbA1c<7.0%达标率;③空腹血糖(FPG)降低值;④体质量降低值;⑤自测血糖降低值;⑥自测餐后血糖降低值;⑦血压降低值,包括收缩压(SBP)和舒张压(DBP)。安全性指标:⑧低血糖事件发生率;⑨不良事件(AE)发生率;⑩严重不良事件(SAE)发生率;11胃肠道反应发生率;12感染发生率。
1.1.5 排除标准 ①重复发表或数据重复的文献;②报道信息太少、质量差或数据无法利用或错误的文献。
1.2 检索策略
计算机检索PubMed、Embase、Cochrane图书馆、中国生物医学文献数据库、中国期刊全文数据库、中文科技期刊数据库,并在此基础上进行手工检索及追溯纳入文献的参考文献,同时手工检索临床试验注册网(ClinicalTrials.gov)上已发表的研究。检索时限为各数据库建库起至2020年5月。为避免漏检,设置中文检索词为“索马鲁肽”“塞马鲁肽”,英文检索词为“Oral semaglutide”。
1.3 资料提取与质量评价
由两名研究者通过阅读题目和摘要对检索所得文献进行初选和去重,再阅读全文并按照纳入与排除标准确定纳入文献。如有分歧则讨论解决,必要时请第三方仲裁。提取数据包括第一作者及发表年限;纳入人群的基本特征(干预措施及样本量、年龄、性别、病程和HbA1c、FPG、体质量水平等);背景治疗;疗程及结局指标。
按照Cochrane系统评价手册5.1.0版评价纳入文献的RCT质量[11],包括:(1)随机序列生成;(2)分配隐藏;(3)受试者及研究人员的盲法;(4)结果评价人员的盲法;(5)结局数据的完整性;(6)选择性报告研究结果;(7)其他偏倚。评价结果分别以“偏倚低风险”“偏倚风险未知”“偏倚高风险”来表示。同时,采用改良Jadad评分量表进行文献质量评价[12],总分为1~7分,其中1~3分为低质量研究、4~7分为高质量研究。
1.4 统计学方法
采用Rev Man 5.3统计软件进行Meta分析。连续性变量采用均方差(MD)和95%置信区间(CI)表示,二分类变量采用相对危险度(RR)和95%CI表示。采用χ2检验分析各研究结果间的统计学异质性,若各研究结果间无统计学异质性(P>0.10或I 2<50%),则采用固定效应模型合并效应量进行Meta分析;反之,则采用随机效应模型合并效应量进行Meta分析。P<0.05为差异有统计学意义。同时,根据疗程和试验组给药剂量的不同进行亚组分析。对部分指标进行敏感性分析。
2 结果
2.1 纳入研究基本信息
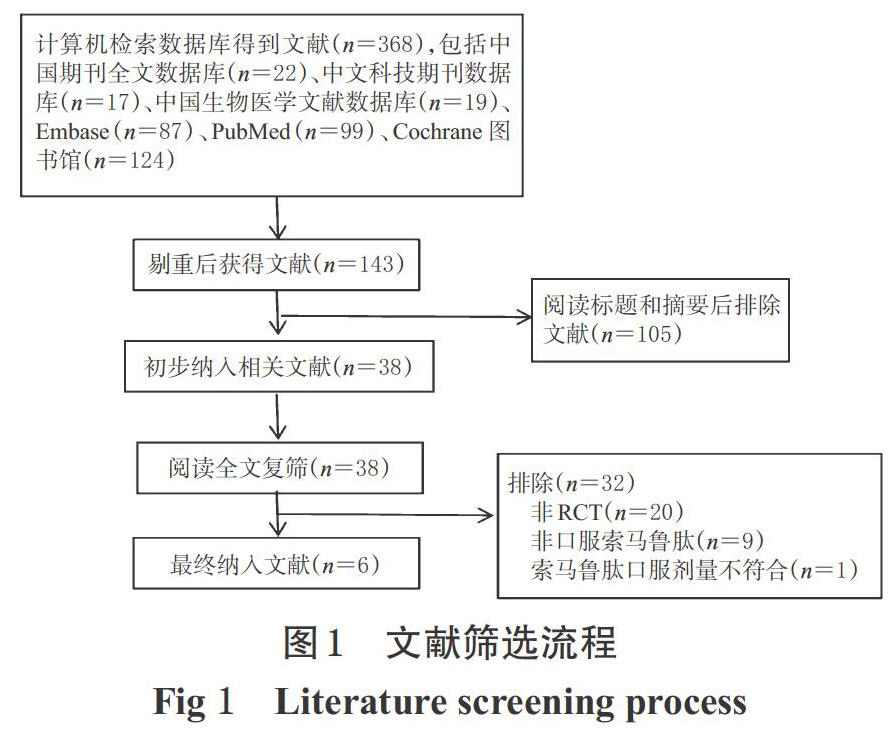
初步检索获得文献368篇,按照纳入与排除标准,最终纳入符合要求的RCT 6篇(项)[13-18],均为英文研究,共计患者5 334例,其中试验组3 418例、对照组1 916例。文献筛选流程见图1,纳入研究基本信息见表1。
2.2 方法学质量评价结果
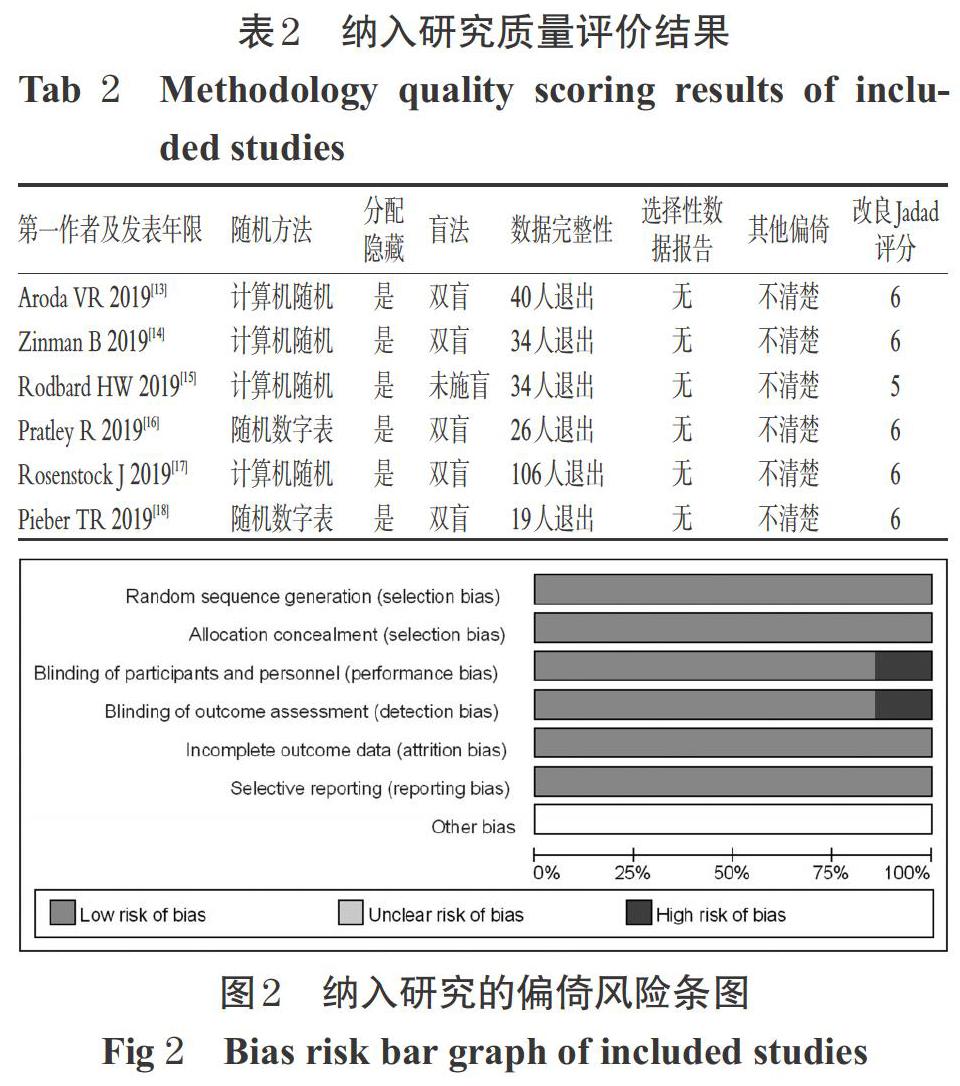
6项研究[13-18]均描述了具体的随机序列产生方法和分配隐藏;5项研究[13-14,16-18]为双盲试验,1项研究[15]未采用盲法;纳入研究均报道了退出人数,退出率均小于10%;纳入研究均无选择性报告数据,其他偏倚均不清楚。纳入研究的改良Jadad评分为5~6分,均为高质量文献。方法学质量评价结果见表2、图2。
2.3 Meta分析结果
本研究先按疗程不同分成26、52周2个亚组,再按照试验组给药剂量不同分成3、7、14 mg 3个亚组,分别进行Meta分析。
2.3.1 HbA1c降低值 分别各有5项研究报道了治疗26周[13-17]和52周[14-18]的HbA1c降低值,各研究间均有统计学异质性(P<0.01,I 2≥94%),采用随机效应模型合并效应量进行分析,结果见图3、图4。Meta分析结果显示,试验组患者治疗26周[MD=-0.62,95%CI(-0.88, -0.36),P<0.001]、52周[MD=-0.51,95%CI(-0.72, -0.29),P<0.001]的HbA1c水平降低值显著大于对照组,差异有统计学意义。根据给药剂量不同进行亚组分析,结果,7 mg亚组患者治疗26周[MD=-0.73,95%CI(-1.21,-0.25),P=0.003]、52周[MD=-0.74,95%CI (-1.10,-0.39),P<0.001],14 mg亚组患者治疗26周[MD=-0.49,95%CI(-0.89,-0.10),P=0.01]、52周[MD=-0.63,95%CI(-0.88,-0.38),P<0.001]时,试验组患者的HbA1c水平降低值均显著大于对照组,差异均有统计学意义;3 mg亚组患者治疗26周[MD= -0.26,95%CI (-0.77,0.26),P=0.32]、52周[MD= -0.15,95% CI (-0.64,0.34),P=0.56]的HbA1c水平降低值与对照组比较,差异无统计学意义。
2.3.2 HbA1c<7.0%达标率 分别各有5项研究报道了治疗26周[13-17]和52周[14-18]的HbA1c<7.0%达标率,各研究间均有统计学异质性(P<0.01,I 2均为94%),采用随机效应模型合并效应量进行分析,结果见图5、图6。 Meta分析结果显示,试验组患者治疗26周[RR=2.22,95%CI(1.68,2.93),P<0.001]、52周[RR=2.02,95%CI(1.51,2.70),P<0.001]的HbA1c<7.0%达标率均显著高于对照组,差异均有统计学意义。根据给药剂量不同进行亚组分析,结果,7 mg亚组患者治疗26周的HbA1c<7.0%达标率显著高于对照组 [RR=2.45,95%CI(1.28,4.70),P=0.007],14 mg亚组患者治疗26周[RR=2.44,95%CI(1.63,3.66),P<0.001]、52周[RR=2.20,95%CI(1.55,3.12),P<0.001]的HbA1c<7.0%达标率显著高于对照组,差异均有统计学意义。3 mg亚组患者治疗26周[RR=1.75,95%CI(0.79,3.88),P=0.17]、52周[RR=1.57,95%CI(0.42,5.88),P=0.51],7 mg亚组患者治疗52周[RR=2.21,95%CI(0.64,7.58),P=0.21]的HbA1c<7.0%达标率与对照组比较,差异均无统计学意义。
2.3.3 FPG降低值 FPG降低值等其余有效性指标的Meta分析结果见表3。由表3可知,试验组患者治疗26周、52周的FPG降低值均显著大于对照组,差异有统计学意义(P<0.05)。根据给药剂量不同进行亚组分析,结果,7 mg亚组、14 mg亚组患者治疗26周,14 mg亚组治疗52周的FPG降低值均显著大于对照组,差异均有统计学意义(P<0.05);其余亚组与对照组比较差异均无统计学意义。
2.3.4 体质量降低值 由表3可知,试验组患者治疗26周、52周的体质量降低值均显著大于对照组,差异均有统计学意义(P<0.05)。根据给药剂量不同进行亚组分析的结果与总体Meta分析结果一致。
2.3.5 自测血糖降低值和自测餐后血糖降低值 由表3可知,试验组患者治疗26周、52周的自测血糖降低值,以及治疗26周的自测餐后血糖降低值均显著大于对照组,差异均有统计学意义(P<0.05)。根据给药剂量不同进行亚组分析,结果,7 mg亚组患者治疗26周的自测血糖降低值,14 mg亚组患者治疗26周、52周的自測血糖降低值和治疗26周的自测餐后血糖降低值均显著大于对照组,差异均有统计学意义(P<0.05);其余亚组与对照组比较差异均无统计学意义。
2.3.6 血压降低值 由表3可知,试验组患者治疗26周、52周的SBP降低值,治疗52周的DBP降低值均显著大于对照组,差异均有统计学意义(P<0.05)。根据给药剂量不同进行亚组分析,结果,3 mg亚组患者治疗52周的DBP降低值,7 mg亚组患者治疗52周的SBP降低值,14 mg亚组患者治疗26周、52周的DBP降低值均显著大于对照组,差异均有统计学意义(P<0.05);其余亚组与对照组比较差异均无统计学意义。
2.3.7 安全性指标 安全性指标的Meta分析结果见表4。由表4可知,试验组患者低血糖事件发生率显著低于对照组,AE发生率和胃肠道反应发生率显著高于对照组,差异均有统计学意义(P<0.05);其余指标比较差异均无统计学意义。根据给药剂量不同进行亚组分析,结果,3 mg亚组、14 mg亚组患者胃肠道反应发生率,14 mg亚组患者的AE发生率显著高于对照组,7 mg亚组患者的胃肠道反应事件发生率显著低于对照组,差异均有统计学意义(P<0.05);其余亚组与对照组比较差异均无统计学意义。
2.4 敏感性分析
对治疗52周的HbA1c降低值、HbA1c<7.0%达标率、FPG降低值和体质量降低值进行敏感性分析,结果见表5。敏感性分析结果显示,与之前Meta分析结果相比没有出现翻转,提示Meta分析结果较为稳定、可靠。
3 讨论
本研究系统评价了首个口服GLP-1RA索马鲁肽治疗T2DM的疗效和安全性。Meta分析结果显示,疗效方面,与对照组比较,索马鲁肽组能更有效降低患者HbA1c水平、FPG水平、自测血糖水平及自测餐后血糖水平,同时能显著提高患者HbA1c<7.0%达标率,说明索马鲁肽口服制剂具有良好且稳定的降糖效果。这与皮下注射索马鲁肽的相关系统评价[19-20]的结论基本一致。根据给药剂量不同进行亚组分析的结果显示,疗效上,索马鲁肽14 mg>7 mg>3 mg,说明索马鲁肽口服制剂呈剂量依赖性。值得注意的是,纳入的6项研究中,只有2项研究的对照组患者使用的是安慰剂,另外4项研究均使用其他降糖药(包括西格列汀、钠-葡萄糖共转运体蛋白2抑制剂恩格列净和同属于GLP-1RA的利拉鲁肽),同时敏感性分析提示Meta分析结果稳定,说明口服索马鲁肽3、7、14 mg均有较好的降糖疗效。索马鲁肽与天然GLP-1有94%同源性,与利拉鲁肽相似,口服剂型采用8-(2-羟基苯甲酰胺基)辛酸钠作为促吸收剂,可提高生物利用度且不影响其药理作用[21],同时避免了注射剂带来的不便和心理压力[22],大大提高了患者的用药依从性。纳入的研究结果显示,口服索马鲁肽降低患者HbA1c水平、FPG水平、自测血糖水平及自测餐后血糖水平和增加HbA1c<7.0%达标率的疗效不劣于利拉鲁肽注射剂[15]。索马鲁肽可能通过减轻体质量从而改善患者体内胰岛B细胞功能并增加胰岛敏感性[23],进而增强其降血糖的作用。本研究结果显示,索马鲁肽能显著降低患者体质量,也佐证了以上可能。同时,索马鲁肽还能显著降低SBP,对DBP也有降低作用。这提示,索马鲁肽口服制剂对伴有肥胖和高血压的T2DM患者有更大获益,长期来看,降低体质量和血压可能有利于降低心血管及微血管病变的发生、发展,提高患者的生存质量,但在低体质量的老年T2DM患者使用过程中应谨慎。
安全性方面,与对照组比较,索马鲁肽组低血糖事件发生率显著降低,但AE发生率尤其是胃肠道不良事件发生率显著增加,不过胃肠道反应以轻中度较多,且大部分可随着时间推移而自行缓解。SAE发生率和胰腺炎及胆石症发生率无显著差异。纳入研究中报道了糖尿病视网膜病变的发生[13,18],其原理和机制尚不清楚,有报道认为与胰岛素依赖型糖尿病患者血糖的快速降低有关[19]。此外,有研究发现索马鲁肽可能会降低鼻咽炎的发病风险[20]。鉴于口服索马鲁肽制剂上市时间太短,且主要用于糖尿病患者的终生治疗,该药的安全性还有待更大样本的RCT进一步评估。
本研究纳入的6项研究均为多中心研究,研究质量相对较高,结果较可靠,且对各个疗效和安全性指标按照不同剂量进行了亚组分析。但因存在以下局限性,结论仍应被谨慎对待。首先,部分Meta分析结果存在较大异质性,原因可能与各项研究的基线特征不一致,且各研究中对照组药物不尽相同有关。因此,尽管笔者进行了亚组分析,但结果的异质性仍然无法消除。其次,研究只纳入了英文文献,存在选择性偏倚。再次,索马鲁肽上市时间较短、相关临床数据有限、样本量较少、试验周期较短,其长期疗效和安全性无法评价。此外,纳入研究均为RCT,严格的纳入排除标准限制了研究结果的外推性和适用性。
综上所述,口服索马鲁肽可有效改善T2DM患者的血糖水平,提高HbA1c<7.0%达标率,减轻体质量和降低血压水平,且疗效呈剂量依赖性。低血糖事件和SAE发生较少,但应注意AE和胃肠道不良事件的发生。鉴于该药上市和进入临床的时间尚短,同时考虑到本次系统评价的结果可能受到各方面潜在的限制和干扰,该结论尚需更多设计严格、长期随访的大样本RCT加以验证。
参考文献
[ 1 ] International Diabetes Federation. The 9th edition of the dia- betes atlas[EB/OL].(2019-11-15)[2020-05-28]. http://www.diabetesatlas.org.
[ 2 ] INZUCCHI SE,BERGENSTAL RM,BUSE JB,et al. Ma- nagement of hyperglycemia in type 2 diabetes,2015:a patient-centered approach:update to a position statement of the American Diabetes Association and the European Association for the study of diabetes[J]. Diabetes Care,2015,38(1):140-149.
[ 3 ] 中華医学会糖尿病学分会.中国2型糖尿病防治指南:2017年版[J].中华糖尿病杂志,2018,10(1):4-67.
[ 4 ] DUGAN JA. Standards of care and treatment in diabetes[J]. Phys Assist Clin,2017,2(1):13-23.
[ 5 ] GENTILELLA R,PECHTNER V,CORCOS A,et al. Glucagon-like peptide-1 receptor agonists in type 2 diabetes treatment:are they all the same?[J]. Diabetes Metab Res Rev,2019,35(1):3070-3082.
[ 6 ] LOVSHIN JA. Glucagon-like peptide-1 receptor agonists:a class update for treating type 2 diabetes[J]. Can J Diabetes,2017,41(5):524-535.
[ 7 ] LU JM. The role of glucagon-like peptide-1 receptor agonists in type 2 diabetes in Asia[J]. Adv Ther,2019,36(4):798-805.
[ 8 ] ABBASI J. Oral GLP-1 analog for type 2 diabetes on the horizon[J]. JAMA,2018,320(6):539-556.
[ 9 ] HANSEN BB,NUHOHO S,ALI AN,et al. Oral semaglutide versus injectable glucagonlike peptide-1 receptor agonists:a cost of control analysis[J]. J Med Econ,2020,23(6):650-658.
[10] MARSO SP,BAIN SC,CONSOLI A,et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes[J]. N Engl J Med,2016,375(19):1834-1844.
[11] GREEN S,HIGGINS JPT,ALDERSON P,et al. Cochrane handbook for systematic reviews of interventions[EB/OL]. [2020-01-15]. http://www.cochrane-handbook.org.
[12] BANARES R,ALBILLOS A,RINCON D,et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding:a meta-analysis[J]. Hepatology,2002,35(3):609-615.
[13] ARODA VR,TERAUCHI Y,ALTUNTAS Y,et al. PIONEER 1:randomized clinical trial of the efficacy and safety of oral semaglutide monotherapy in comparison with placebo in patients with type 2 diabetes[J]. Diabetes Care,2019,42(9):1724-1732.
[14] ZINMAN B,ARODA VR,BUSE JB,et al. Efficacy,safety,and tolerability of oral semaglutide versus placebo added to insulin with or without merformin in patients with type 2 diabetes:the PIONEER 8 trial[J]. Diabetes Care,2019,42(12):2262-2271.
[15] RODBARD HW,ROSENSTOCK J,CANANI LH,et al. Oral semaglutide versus empagliflozin in patients with type 2 diabetes uncontrolled on metformin:the PIONEER 2 trial[J]. Diabetes Care,2019,42(12):2272-2281.
[16] PRATLEY R,AMOD A,HOFF ST,et al. Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4):a randomised,double-blind,phase 3a trial[J]. Lancet,2019,394(10192):39-50.
[17] ROSENSTOCK J,ALLISON D,BIRKENFELD AL,et al. Effect of additional oral semaglutide vs sitagliptin on glycated hemoglobin in adults with type 2 diabetes uncontrolled with metformin alone or with sulfonylurea:the PIONEER 3 randomized clinical trial[J]. JAMA,2019,321(15):1466-1480.
[18] PIEBER TR,BODE B,MERTENS A,et al. Efficacy and safety of oral semaglutide with flexible dose adjustment versus sitagliptin in type 2 diabetes (PIONEER 7):a multicentre,open-label,randomised,phase 3a trial[J]. Lancet Diabetes Endocrinol,2019,7(7):528-539.
[19] ANDREADIS P,KARAGIANNIS T,MALANDRIS K, et al. Semaglutide for type 2 diabetes mellitus:a systema- tic review and meta-analysis[J]. Diabetes Obes Metab,2018,20(9):2255-2263.
[20] 卢志伟,孙浩,李莹,等.长效GLP-1受体激动药索马鲁肽治疗2型糖尿病疗效和安全性的系统评价[J].中国药房,2019,30(7):969-975.
[21] BUCHEIT JD,PAMULAPATI LG,CARTER N,et al. Oral semaglutide:a review of the first oral glucagon-like peptide-1 receptor agonist[J]. Diabetes Technol Ther,2020,22(1):10-18.
[22] BUCKLEY ST,BAEKDAL TA,VEGGE A,et al. Transcellular stomach absorption of a derivatized glucagon- like peptide-1 receptor agonist[J]. Sci Translat Med,2018,10(467):7047-7056.
[23] FONSECA VA,CAPEHORN MS,GARG SK,et al. Reductions in insulin resistance are mediated primarily via weight loss in subjects with type 2 diabetes on semaglutide[J]. J Clin Endocrinol Metab,2019,104(9):4078- 4086.
(收稿日期:2020-06-30 修回日期:2020-08-11)
(編辑:刘明伟)

