CD56 在急性白血病和骨髓增生异常综合征诊断中的作用
韩春生 伍学强
流式细胞学技术在急性白血病(acute leukemia,AL)和骨髓增生异常综合征(myelodysplastic syndrome,MDS)诊断中的作用日益突出。用流式细胞仪检测细胞表面抗原的变化,已成为AL 和MDS 诊断的基本标志,但是哪些抗原才是诊断不同类型白血病的最佳标志物,临床工作者的意见尚不统一。AL 和MDS 的发病都是一些原本正常的细胞出现了分化紊乱,所以细胞表面抗原的变化有助于AL 和MDS的诊断。我们在临床中发现CD56 在AL 和MDS 的诊断和预后判断方面具有重要意义。
CD56 是一种粘附分子,又被称为神经细胞粘附分子,属免疫球蛋白超家族成员,主要存在于自然杀伤细胞(natural killer cell,NK)中,也可表达于T细胞亚群、单核细胞、浆细胞[1];单核细胞异常表达CD56,常被认为与MDS、骨髓增殖性肿瘤(myeloproliterative neoplasms,MPN)相关。浆细胞表达CD56有利于多发性骨髓瘤的诊断。CD56 可表达于包括AML、急性髓/NK 细胞白血病、急性淋巴性白血病(ALL)、淋巴瘤、骨髓瘤在内的多种血液系统肿瘤。CD56 表达与B-ALL 高风险中枢神经系统浸润相关;与T-ALL 低完全缓解率相关[2]。在AML 中,特别是AML-M2 中CD56+被认为是预后较差的指标[3]。研究提示[4~6],CD56+血液肿瘤预后不良,临床疗效差,预后差,易复发,总体生存期较短,易发生髓外浸润。CD56 表达于MDS 和CMPN 的原始粒细胞、成熟粒细胞和单核细胞[7]。CD56 表达往往提示MDS 为高危MDS,预后较差,易于向AL 转化。表达CD56 的血液系统肿瘤常被认为是具有高度侵袭性的恶性疾病[8],所以有研究者建议初诊时监测CD56表达以判断预后,并将CD56 作为监测微小残留病(minimal residual disease,MRD)的重要指标[9,10]。CD56+的AML 患者预后目前仍存在争议[11]。我们用含有CD56 单抗的五色流式方案研究了142 例初诊的AL 和MDS 的免疫表型患者以期发现CD56 在这些疾病中的表达规律,为临床诊断和判断预后提供参考。
1 材料与方法
1.1 一般资料选择2013 年9 月~2019 年9 月收治的142 例初诊AL 和MDS 患者。依据临床表现、流式免疫表型、骨髓形态学、细胞遗传学、骨髓活检进行确诊。AL、MDS 均按照FAB 分型分类,MDS 根据骨髓原始细胞数量分成原始细胞增高组(RAEB-1、RAEB-2、CMML;骨髓原始细胞>5%)和不增高组(RA、RAS;骨髓原始细胞<5%)。其中AL 107 例,MDS 35 例;男69 例,女73 例,年龄2~82 岁。
1.2 材料应用贝克曼流式细胞仪(库尔特Cytomics FC 500),胞内染色试剂和单克隆抗体购自美国BD 公司,抗原包括髓系、淋巴细胞系、巨核细胞系和红细胞系的代表性抗原,具体包括CD2、cCD3、CD3、CD4、CD5、CD7、CD8、CD10、CD20、CD19、CD79a、CD11b、CD13、CD14、CD15、CD33、CD34、CD45、CD56、CD61、CD64、CD71、CD117、HLA-DR、GlyA、MPO。
1.3 方法
1.3.1 标本制备严格按照流式样本操作流程制备细胞悬液以备上机检测。
1.3.2 流式检测按照贝克曼(库尔特Cytomics FC 500)流式细胞仪的操作手册开机,用Cell Quest 软件获取数据,每管检测100 000 个细胞,用CD45/侧向散射光(SSC)设门收集骨髓单个核细胞。用Cell Quest 软件分析检测结果,以抗原表达量>20%作为抗原表达阳性的界限。
1.4 统计学方法采用SPSS 16.0 统计软件分析数据,两组之间比较采用方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 CD56 在AL 患者中表达情况用Cell Quest软件分析检测结果,在CD45/SSC 点图上根据细胞CD45 和SSC 值将所研究细胞划分为淋巴细胞群、单核细胞群、粒细胞群、CD45 弱表达群(主要为原始/幼稚细胞)、CD45 阴性表达细胞群(主要为有核细胞和细胞碎片)分别研究,进一步了解不同细胞群抗原表达情况。107 例AL 患者中1 例M1、34例M2、12 例M3、4 例M4、27 例M5、2 例M6、17 例B-ALL、10 例T-ALL。以CD56 细胞>20%计为阳性,107 例AL 中有29 例(27.10%)的细胞群异常表达CD56。80 例AML 中有28 例表达CD56,阳性率为35.00%,27 例ALL 中有1 例表达CD56,阳性率为3.70%;CD56 在AML、ALL 中的表达差异有统计学意义(χ2=10.01,P<0.05)。CD56 在AML 各亚型中的阳性率依次为:M2(52.94%)、M5(37.04%),M1、M3、M4、M6 未检出CD56 表达,见表1。AL 中CD56 在原始细胞、粒细胞、单核细胞中的检出率依次为75.86%、48.28%、13.79%。
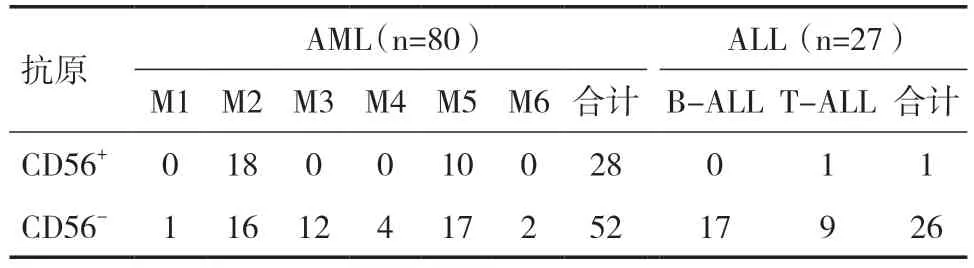
表1 CD56 在AL 患者中的表达情况(n)
2.2 CD56 在MDS 中的表达情况在MDS 中CD56可异常表达于原始细胞(28.57%)、粒细胞(20.00%)、单核细胞(5.71%)。CD56 在原始细胞中表达比例最高。
35 例MDS 患者中原始细胞增高组的MDS 患者CD56 阳性率为54.55%,原始细胞不高组的MDS患者CD56 阳性率为53.85%,差异无统计学意义(χ2=0.05,P>0.05)。原始细胞增高组和原始细胞不增高组:原始细胞CD56 阳性率为27.27%、30.77%,两组之间差异无统计学意义(χ2=0.05,P>0.05);粒细胞CD56 阳性率为22.73%、15.38%,差异无统计学意义(χ2=0.28,P>0.05);单核细胞CD56 阳性率为4.55%、7.69%,两组差异无统计学意义(χ2=0.15,P>0.05)。见表2。

表2 CD56 在MDS 中的表达情况(n)
2.3 AL 患者的染色体异常情况107 例AL 中检出41 例存在染色体异常,染色体异常率约为38.32%。29 例CD56+的AL 患者19 例存在染色体异常;78例CD56-的AL 患者中检出22 例存在染色体异常。在AL 患者中CD56+与CD56-的染色体异常检出率为65.52%、28.21%,差异有统计学意义(χ2=12.45,P<0.05)。29 例CD56+的AL 患者包括28 例AML和1 例T-ALL。28 例CD56+的AML 患者中可见到t(8;21)、-X、+8、t(9;22)、复杂核型、del(3-MLL)、+19 等细胞遗传学改变,最常见的染色体异常是t(8;21)。即CD56+的AML 患者更易发生t(8;21),多见于M2。见表3。

表3 28 例CD56+的 AML 患者染色体异常情况(n)
2.4 AL 患者中融合基因形成情况107 例AL 患者中检出41 例存在融合基因,融合基因检出率为38.32%。在29 例CD56+的AL 患者中检出17 例存在融合基因,78 例CD56-的AL 患者中检出24例存在融合基因,AL 患者中CD56+与CD56-融合基因检出率为58.62%、30.77%,差异有统计学意义(χ2=6.94,P<0.05)。28 例CD56+的AML 患者中可见到AML1/ETO、BCR/ABL、FLT3/ITD、WT1 等融合基因形成,AML1/ETO 融合基因在CD56+的AML 患者中的检出率最高,为50.00%;主要见于AML-M2。即CD56+的AL 患者更易形成AML1/ETO 融合基因,多见于M2。见表4。
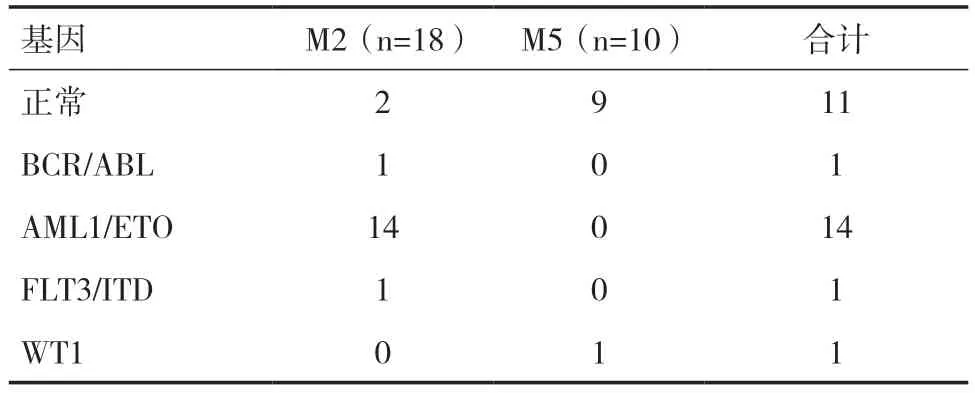
表4 28 例CD56+的AML 患者融合基因形成情况(n)
2.5 MDS 患者的染色体情况35 例MDS 患者中检测出存在5q-、-7、20q-、+3q、+8、+18、+mar、t(13;21)、复杂核型(3 种及以上异常核型)等染色体异常,染色体异常检出率为60.00%。CD56+的MDS患者中11 例存在染色体异常,IPSS 平均积分为8分。CD56-的MDS 患者中10 例存在染色体异常,IPSS 平均积分为5 分。CD56+的MDS 与CD56-的MDS 染色体异常检出率为64.71%、55.56%,差异无统计学意义(χ2=0.31,P>0.05)。影响预后的积分CD56+的MDS 患者高于CD56-的MDS 患者。见表5。

表5 35 例MDS 患者染色体情况(n)
3 讨论
我们用流式细胞仪检测了107 例急性白血病和35 例MDS 患者骨髓单个核细胞CD56 的表达情况,流式检测的优势在于可以同时用不同的抗体确定这些疾病中的不同细胞群,从而确定CD56 在不同细胞群上的表达情况。本研究发现107 例急性白血病患者中有29 例CD56 表达阳性(>20%)。CD56在AML-M2、AML-M5、T-ALL 的白血病细胞上均有不同程度表达,而CD56 更常表达于AML,且CD56在AML-M2 中的表达比其他类型急性白血病高。CD56 是区别AML 和ALL 的标志之一。文献报道[3]CD56 在AML 中的检出率为13%~29%,其中主要在AML-M2、AML-M3、AML-M5、AML-M7 中 检 出CD56 阳性表达。本研究CD56 检出率较国外报道稍高。有报道[12]称CD56+的AML-M3 患者,多伴随t(11;17),也可见t(15;17)。CD56+的AML-M3 患者尽管总体存活期无显著差异,但缓解持续时间和无病生存期更短,预后、疗效更差[13]。本研究未检出M3 表达CD56,可能与样本量有限有关。
MDS 是一种以一系或多系病态造血为特征的髓系肿瘤,具有向AL 转化的高风险。免疫分型在MDS 诊断和预后判断中的作用逐渐被人们所肯定。CD56 在MDS 诊断、疾病进展、预后判断中的作用也不断被认可。MDS 诊断目前仍属于排他性诊断,诊断MDS 尚无明确手段。流式细胞学是诊断MDS 的重要辅助性方法。选择何种抗原来诊断MDS 及判定预后成为亟待解决的问题。相关研究提示CD56在诊断MDS 及判断预后方面具有重要参考价值。我们用流式检测的方法更直观地证明了CD56 可做为AL 和MDS 的恶性细胞分化的标志。
CD56 异常表达常伴随染色体和/或融合基因形成。即CD56 可预测融合基因和染色体情况。在AML 中CD56+多伴随有t(8;21)和/或AML1/ETO融合基因形成。本研究MDS 染色体异常检出率为60.00%,与文献报道的40%~70%基本一致[10],但是影响预后的积分,CD56+的MDS 患者高于CD56-的MDS 患者,CD56+的MDS 患者预后更差。Hu 等[14]报道尽管CD56 表达对无病存活率、总生存期无显著影响,但是CD56+的AML 患者完全缓解率更低。我们发现CD56 异常表达时多存在细胞遗传学及分子生物学的异常。检测CD56 表达情况可能有利于疾病的疗效观察、疾病分层治疗及预后判定。
在AL 和MDS 中CD56 常表达于原始细胞(早期阶段细胞)。由于CD56 被广泛认为是恶性、具有侵袭性的标志,所以在高度增殖的所有系列来源的异常细胞上均应表达,但是CD56 似乎更常表达于原始细胞,其次为粒细胞、单核细胞。该现象我们在AL 和MDS 病例中均有发现。在AL、MDS 中异常表达CD56 的原始细胞检出率分别为75.86%、28.57%,均高于成熟粒细胞、单核细胞。CD56+更常表达于原始细胞,可能与AL、MDS 中的原始细胞似乎更易发生恶变有关,MDS 中CD56 表达与原始细胞是否增高有关,具体机制有待继续研究。
综上所述,我们认为CD56 作为诊断AML 和MDS 的重要标志,可用于预后判断,但在实际应用中仍需进一步研究。

