以鲢、鳙养殖为主的长江中下游武山湖浮游植物群落结构特征*
张佳敏,高 健,杨 诚,张泽慧,潘 超,廖明军,赵以军,王和云,杨雨慧
(湖北工业大学河湖生态修复与藻类利用湖北省重点实验室,土木建筑与环境学院,武汉 430068)
武山湖地处湖北省武穴市北郊,位于长江北岸,距长江约4 km,属长江中游中型浅水通江湖泊. 1949年,武山湖水位16.0 m时,水面面积25.0 km2[1],现实测面积15.2 km2. 武山湖渔场属国营渔场,专业养殖已历时60余年. 20世纪80年代初,武山湖水质清澈、水生高等植物多样性丰富,但自1987年以来其周围6家工厂向其排污,以及湖泊本身放养量逐渐增大,再加上施肥和投饵养殖,使湖泊水生生态系统日趋退化,水生高等植物种类相继消失,全湖变为富营养化藻型生态系统[2-3],其鱼类养殖品种逐渐变成以单一的鲢、鳙为主. 近年来,为贯彻落实国家和湖北省对长江大保护的重大决策部署,针对武山湖水污染实施了一系列基础建设工程,对流域实施了控污、工厂搬迁和禁止施肥、投饵养殖等措施. 但由于控污不彻底(表1),武山湖水质长期处于富营养化水平,水体主要超标因子为总磷、总氮以及高锰酸盐指数,同时水体透明度低,藻类水华暴发的风险较大.
近年武山湖冬捕渔获量中鲢(Hypophthalmichthysmolitrix)和鳙(Aristichthysnobilis)占90%以上(表2),由于鲢、鳙主要以浮游生物为食,鲢、鳙养殖是否能够对武山湖浮游植物的过度增长或蓝藻水华的发生起到控制作用备受湖泊管理部门关注. 鲢、鳙控藻技术即“非经典生物操纵”已经广为研究者和湖泊管理部门熟知[4-6],但对鲢、鳙控藻问题在富营养化湖泊中的应用效果仍存在争议[7]. 本研究基于对武山湖水体营养盐浓度持续维持在较高水平和入湖河流污染仍然较高的认知前提下,于2017-2018年对武山湖浮游植物群落结构及其环境因子首次开展较系统的调查,分析了武山湖浮游植物物种组成及对其产生影响的关键环境因子. 研究假设以鲢、鳙养殖为主的武山湖浮游植物种群在滤食性鱼类牧食压力下其优势种主要为小型藻类,但其密度和丰度仍将维持在较高水平. 本研究结果将为合理评估鲢、鳙放养在富营养湖泊中的控藻作用增添原位资料.
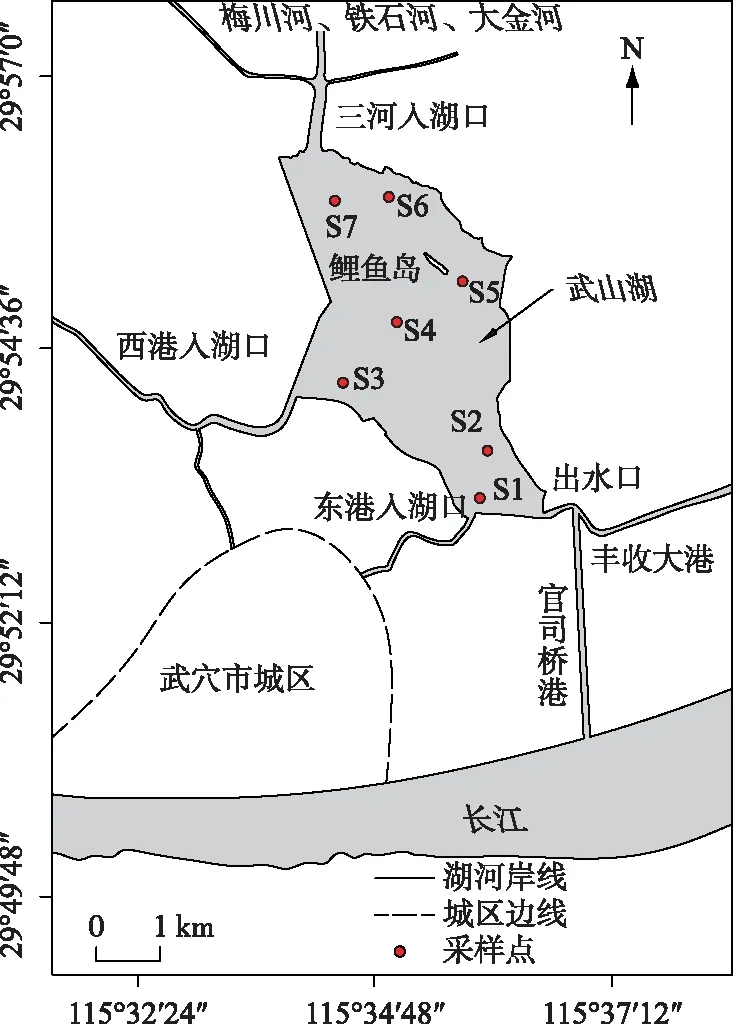
图1 武山湖采样点位置Fig.1 Location of sampling sites in Lake Wushan
1 材料与方法
1.1 研究地点和采样时间
武山湖(29°53′03″~29°56′23″N, 115°33′57″~115°36′40″E)水域面积为15.2 km2,常水位湖容约2690×104m3,最大水深为2.46 m,平均水深为1.27 m. 武山湖位于华阳水系源头,入湖河流主要有三部分:梅川河、大金河和铁石河在近湖处(即三河入湖口)汇水,城区东港来水和西港来水. 武山湖出口在同一地方分叉,一是经丰收大港连通太白湖,经梅济港流入黄梅县龙感湖,再经安徽省华阳闸入长江;二是经官司桥大港通过闸入长江(图1).
采样时间为2017年9月-2018年8月,水样及浮游植物样品1个月采集1次. 武山湖3个主要入湖河口水样3个月采集1次.
2017-2018年对武山湖三大入湖河口水质监测的结果表明(表1),武山湖来水的氮、磷污染严重. 东港入湖口在2017年8月、11月和2018年2月总氮(TN)浓度均大于10.0 mg/L,总磷(TP)浓度大于1.30 mg/L. 西港入湖口在2017年8月和2018年2月TN浓度大于10.0 mg/L,TP浓度大于0.80 mg/L. 2018年2月三河入湖口的氮、磷污染最严重,TN和TP浓度分别为3.0和0.30 mg/L. 根据查得的3个入湖河口的年均流量可计算3个入湖口汇入武山湖的氮、磷总量,其中东港一年排入武山湖的TN总量约为54.96 t,TP约为5.79 t;西港汇入的TN总量约为36.6 t,TP约为3.09 t. 三河入湖口汇入氮、磷最多,TN约为240.22 t,TP约为32.11 t.

表1 2017年8月-2018年5月武山湖3个主要入湖河口不同季节的水质特征
武山湖养殖投放鱼苗主要是鳙和鲢(表2);近四年渔获量约在1300~2000 t/a,其中鲢约占20%,鳙约占70%(表2),其他鱼类包括鲤(Cyprinuscarpio)、鳊(Parabramispekinensis)、鲫(Carassiusauratus)、青鱼(Mylopharyngodonpiceus)、鲌(Culters)、草鱼(Ctenopharyngodonidella)、黄颡鱼(Pelteobagrusfulvidraco)、鳑鲏(RhodeussinensisGunther)、条(HemicculterLeuciclus)等.

表2 武山湖2014-2018年鱼类捕捞量统计*
*投放鳙鱼苗约0.25~0.5 kg/尾,鲢鱼苗约0.1~0.15 kg/尾. 投放量和捕捞量的单位均为万kg;数据来源于武山湖武黄渔场. “-”表明无详细统计数据.
1.2 样本采集及分析
透明度(SD)采用塞氏盘(Secchi-disk)现场测定. 水温(WT)、pH值和溶解氧(DO)等参数采用YSI ProPlus多参仪(美国)现场测定.
用5 L有机玻璃采水器采集水表面下0.5 m处水样,共计20 L水样放置在用湖水洗净的塑料桶内,混合后取约2.5 L水样低温保存,带回实验室分析水质. TN、TP和高锰酸盐指数(CODMn)等水质指标的检验方法依据《水和废水监测分析方法(第四版)》[8].
取上述混合水样1 L置于广口塑料瓶中用于浮游植物定量分析,现场加入约水样体积1%的鲁哥试剂固定,带回实验室静置沉淀24 h以上后浓缩并在尼康倒置显微镜下计数,浮游植物鉴定参照《中国淡水藻类——系统,分类及生态》[9]尽量鉴定到种,其中部分硅藻鉴定到属. 计数方法为目镜视野法,用0.1 mL浮游植物计数框在10×40倍光学显微镜下进行,一般计数50个视野,使所得到的细胞数在300以上,每个样品至少计数2片,对量小而个体大的种类在10×10倍下全片计数. 根据浓缩倍数换算为每升水样中的细胞数(cells/L),即浮游植物的丰度. 由于浮游植物的比重接近1,故可以直接由浮游植物的体积换算为生物量(鲜重),即生物量为浮游植物的丰度乘以各自的平均体积[10],单位为mg/L.
1.3 数据处理及分析
1.3.1 综合营养状态指数评价 参考湖泊富营养化评价方法及分级标准[11],依据Chl.a、TP、TN、SD和CODMn监测结果,运用综合营养状态指数法对武山湖生态系统健康状况进行评价. 综合营养状态指数计算公式如下:
TLI(∑)=∑Wj·TLI(j)
(1)
式中,TLI(∑)表示综合营养状态指数;TLI(j)代表第j种参数的营养状态参数;Wj为第j种参数的营养状态指数的相关权重,详细计算公式见参考文献[11].
参考《中国水资源公报》[12]中湖泊、水库富营养化评分与分类标准将湖泊营养状态分成5级,同一营养状态下,指数值越高,其营养程度越严重:贫营养TLI(∑)<30,中营养30≤TLI(∑)≤ 50,轻度富营养50
1.3.2 优势种 浮游植物优势种根据种的Mcnaughton优势度指数(Y)来确定[13]:
(2)
式中,ni为第i种的个体数;N为所有种类总个体数;fi为出现频率;Y值>0.02的种类视为优势种. 优势种的变化在一定程度上可直接反映水体污染程度和环境条件的改变[14-15].
1.3.3 统计分析 浮游植物丰度和生物量与TN、TP、WT、DO、pH、SD和TLI指数的Pearson相关性分析用SPSS Statistics 22.0软件进行. 所有数据分析前首先进行正态分布检验,不符合正态分布的数据用ln(x)处理后分析.
冗余分析通过CANOCO 4.5进行,在分析前,先对物种丰度矩阵进行DCA去趋势分析,用于排序的浮游植物物种满足以下3个条件:(1)Y≥0.02的优势属;(2)该物种在不同采样点的不同时期出现频率>12.5%;(3)该物种至少在1个采样点的相对密度≥1%. 对筛选后的武山湖浮游植物物种进行DCA分析,本研究中最大轴小于3,因此采用冗余分析(RDA)[16]探讨武山湖浮游植物丰度与环境因子(包括WT、DO、pH、TN、TP和SD,而CODMn值受浮游植物浓度的影响而被排除在外)的关系. 为了获得数据正态分布,将浮游植物和环境因子(除pH)均进行ln(x+1)转换. 物种及环境因子选取12个月7个采样点共84个数据进行RDA分析. 在线性排序图,从样方的点在物种箭头及其延长线的投影点可以表示它们之间的关系. 由样方到物种箭头线的垂点可以判断样方物种的多度值,垂点在物种箭头方向越远位置代表其物种多度越高,反之越低[16].
聚类分析利用大型多元统计软件PRIMER 5.0进行,对武山湖浮游植物优势种分别进行时间和空间的聚类分析.
2 结果与分析
2.1 武山湖水体理化特征和季节变化规律
采样期间,武山湖WT范围在7.8~34℃. 水体DO浓度均值在5.57~15.03 mg/L,其中2、3月各采样点DO波动较大. 水体pH值的范围在7.41~9.12之间,其中2、3和5月各采样点pH波动较大. 武山湖水体SD 12月最高,均值为132.7 cm;而在4月最低,均值为27.7 cm,其中有8个月的SD在40 cm以下,水体除12月外均浑浊(图2).
武山湖TP浓度均值范围为0.17~1.05 mg/L,其值冬季低、夏季高,最低值在12月,最高值在8月. TN浓度均值变化范围在1.34~3.14 mg/L之间,其值冬季高、夏季低,最低值在9月,最高值在2月,与TP季节变化相反;尽管2月TN均值最高,但各采样点浓度有明显差异,其中S6最高(4.51 mg/L),S2最低(2.09 mg/L). 武山湖CODMn12月最低,均值为4.44 mg/L,而2月最高,均值为8.88 mg/L. 武山湖不同采样点Chl.a浓度差别很大,12月值最低,平均6.22 μg/L;7月Chl.a浓度最高,达125.08 μg/L(图2). 武山湖富营养指数TLI均值变化范围在51.09~73.1之间,全湖全年处于轻度富营养到重度富营养水平,其中12月和1月处于轻度富营养,7月、8月和11月为重度富营养化,其他月份为中度富营养化.

图2 武山湖水体理化指标的时空变化Fig.2 Spatial-temporal change of physicochemical parameters in Lake Wushan
2.2 武山湖浮游植物特征
2.2.1 浮游植物种类组成及优势种 采样期间武山湖共鉴定出浮游植物100种(属),隶属于7门62属. 其中绿藻门种类数最多,有28属50种,占总种数的50%. 硅藻门其次,有11属19种,占总数的19%. 蓝藻门有10属14种,甲藻门和隐藻门分别有4属5种和3属6种,裸藻门和金藻门最少,分别有4属4种和2属2种.
浮游植物优势种共有23种,其中蓝藻门有9种,绿藻门有8种,硅藻门和隐藻门各有3种. 其中绿藻门的四尾栅藻(Scenedesmusquadricauda)在12次调查中作为优势种出现了11次,硅藻门的小环藻属一种(Cyclotellasp.)出现了9次,蓝藻门的伪鱼腥藻属一种(Pseudanabaenasp.)与细小平裂藻(Merismopediatenuissima)均出现7次. 夏季和秋季蓝藻门优势种最多且优势度高,秋季和春季绿藻门和硅藻门优势种多且优势度高,隐藻门的种类仅在2018年1-3月为优势种. 从秋季、冬季、春季到夏季,武山湖最优势种的演替过程为细小平裂藻、小环藻一种(Cyclotellasp. )、小球藻一种(Chlorellasp.)再到微囊藻一种(Microcystissp.)、细小平裂藻(表3).
以武山湖浮游植物优势种群的丰度进行时间聚类分析(图3a),在相似水平47%时,2018年1月和其他月份分为两类;在相似水平63%时,2018年1月为一类,2018年2-4月和2017年12月为一类,2017年9-11月和2018年5-8月为一类. 以武山湖浮游植物优势种群的丰度进行空间聚类分析(图3b),结果表明7个采样点相似度很高,在相似水平为93.5%时仅分为两大类,一类为S1、S2和S3,一类为S4、S5、S6和S7.
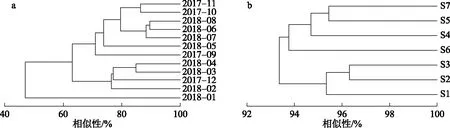
图3 武山湖浮游植物优势种丰度的时间(a)和空间(b)聚类分析Fig.3 Temporal(a) and spatial(b) cluster analysis of phytoplankton dominant species in Lake Wushan
2.2.2 浮游植物丰度和生物量 武山湖采样期间各采样点浮游植物丰度在0.41×106~341.46×106cells/L之间,其中2017年12月全湖浮游植物平均丰度最低,为1.10×106cells/L;2018年7月浮游植物平均丰度最高,为230.10×106cells/L. 在5-11月,蓝藻门的丰度占比最高,占总丰度的65.14%~88.76%. 绿藻门的丰度在2017年12月、2018年1月和4月较高,其中2018年1月浮游植物丰度突然增加,尤其是绿藻门丰度达100.11×106cells/L,占总丰度的93.01%. 2018年2月,浮游植物优势种逐渐从绿藻门演替成硅藻门,其丰度(15.72×106cells/L)占浮游植物总丰度的75.17%. 硅藻门丰度在2017年12月和2018年3-4月也比较高,分别占总丰度的37.68%、35.03%和30.49%. 隐藻门只在2018年3月丰度比较高,为6.08×106cells/L,占总丰度的20.14%. 其他门的浮游植物丰度均很低(图4).
武山湖采样期间浮游植物生物量在0.061~34.77 mg/L之间,其中12月浮游植物生物量最低,6月浮游植物生物量最高. 7月蓝藻门的生物量达4.83 mg/L,占比最多(32.55%). 11月硅藻门生物量最高,达10.71 mg/L,全年有9个月硅藻门生物量占总生物量的比例最高(图4). 绿藻门1月生物量占比最多(达35.46%),而在6月份生物量最高(3.49 mg/L). 隐藻门生物量3月最高(3.26 mg/L),裸藻门生物量最高出现在6月(2.73 mg/L)(图4).
从丰度数据来看,夏、秋季蓝藻门占优,冬、春季以硅藻和绿藻为主;从生物量数据来看,春、秋、冬硅藻门占优,夏季硅藻、蓝藻和绿藻均较高(图4).
2.3 武山湖浮游植物与环境因子的关系
Pearson相关性分析结果(表4)表明,TP浓度分别与浮游植物丰度和生物量、蓝藻门丰度、绿藻门生物量呈显著正相关,与蓝藻门生物量呈极显著正相关. 水温与蓝藻门的生物量呈极显著正相关,与浮游植物总丰度、总生物量以及绿藻门生物量呈显著正相关. pH与浮游植物总丰度、总生物量及绿藻门和硅藻门的丰度、生物量均呈极显著正相关. 透明度与浮游植物总丰度和总生物量、硅藻门的丰度和生物量呈极显著负相关,与绿藻门生物量显著负相关. 除绿藻门丰度外,浮游植物及其主要类群丰度和生物量均与综合营养状态指数TLI呈显著或极显著正相关. 蓝藻丰度与DO浓度呈显著负相关,浮游植物及其类群丰度和生物量与TN浓度均不相关.

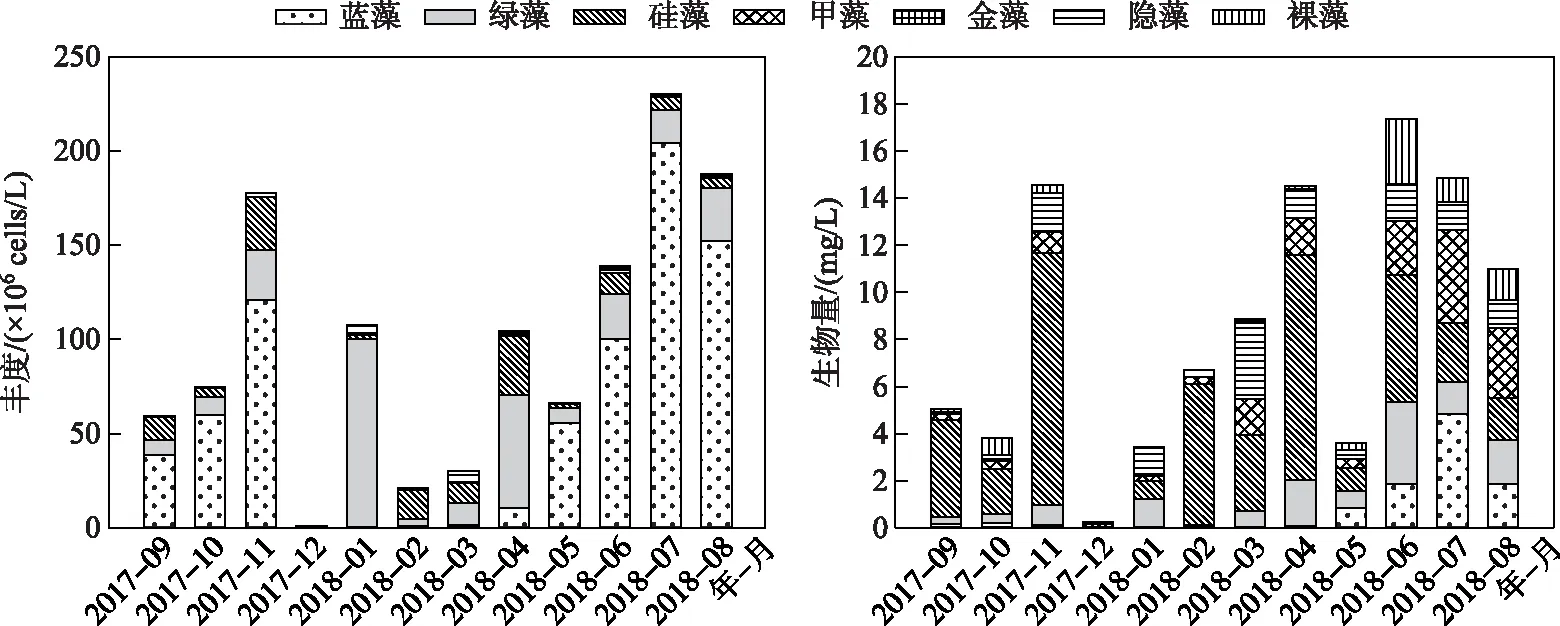
图4 武山湖浮游植物丰度和生物量变化Fig.4 Variations of phytoplankton abundance and biomass in Lake Wushan

表4 武山湖浮游植物丰度、生物量与环境因子相关性分析(n=84)
通过冗余分析(RDA)对浮游植物各优势属的丰度和生物量与环境因子之间的关系进行分析. 基于丰度数据,主成分轴1和轴2特征值分别是0.361和0.095,即前两个轴共解释了45.6%的浮游植物各优势属的丰度变化(图5a). 主成分轴1和轴2的物种与环境因子相关性分别为86.6%和74.9%,两轴累计百分比变化率为88.4%,表明前两个轴的物种与环境因子相关性高. RDA蒙特卡罗前向选择检验表明,TP浓度和WT对浮游植物丰度变化影响最大,这两个变量共解释了36.0%(图5a). TP和WT与蓝藻门各优势属(Z1~Z6)丰度、绿藻门Z9、Z10和硅藻门Z13、Z14呈正相关;而TN浓度与蓝藻门所有优势属丰度均呈负相关. 透明度与各优势属丰度均呈负相关. TN、TP、pH、WT、DO和SD与轴1相关性系数分别为-0.33、0.81、0.38、0.76、-0.39 和-0.53,而与轴2的相关性系数分别为0.08、-0.07、-0.53、-0.04、-0.49和0.39.
基于生物量数据,主成分轴1和轴2特征值分别是0.346和0.114,即前两个轴共解释了46.0%的浮游植物各优势属的生物量变化(图5b). 主成分轴1和轴2的物种与环境因子相关性分别为91.4%和77.7%,两轴累计百分比变化率为88.4%,表明前两个轴的物种与环境因子相关性高. RDA蒙特卡罗检验前向选择检验表明,WT和TP浓度对浮游植物生物量变化影响最大,这两个变量共解释了36.0%(图5b). WT、TP和pH与蓝藻门各优势属(Z1~Z6)生物量呈正相关,与绿藻门Z9、Z10、Z11和硅藻门Z13、Z14呈正相关;而TN浓度与蓝藻门所有优势属生物量均呈负相关. 透明度与各优势属均呈负相关. 浮游植物各优势属丰度和生物量与环境因子的相互关系分析结果相似. TN、TP、pH、WT、DO和SD与轴1相关性系数分别为0.33、-0.77、-0.62、-0.87、0.12和0.69,而与轴2的相关性系数分别为-0.02、0.16、-0.47、0.12、-0.70和0.27.
从RDA三元图(图5)可以看出浮游植物样方四季分布明显,夏季和冬季样方分布轴2两侧,其中夏季样方更集中,而冬季样方分布在一、四象限(丰度)或二、三象限. 秋季和春季的样方多分布在轴2附近. 蓝藻门夏季样方的多度值靠近物种箭头的延长线上,表明其多度值在夏季高,而绿藻门、硅藻门和隐藻门在10月和11月以及4月的样方多度值较其他月份高.

图5 武山湖浮游植物、环境变量和采样点的冗余分析(RDA)三元图Fig.5 Redundancy analysis (RDA) triplot (phytoplankton, environmental variables and sampling sites) in Lake Wushan
3 讨论
藻类大量增长特别是蓝藻水华的暴发以及死亡,会严重影响湖泊水质和生态系统的健康,因此成为湖泊治理的一个重要问题. 根据相关湖泊富营养评价标准,尽管武山湖各采样点由于距离入湖河口不同导致营养盐指标存在差异(图2),但从整体上来讲,武山湖TN(1.34~3.14 mg/L)、TP(0.17~1.05 mg/L)、Chl.a浓度(峰值达125.08 μg/L)以及藻类丰度和生物量均可指示武山湖水体处于富营养化水平[17],具有藻类大量生长的营养条件,再加上武山湖藻类优势种主要是蓝藻和绿藻,藻类水华尤其是蓝藻水华发生的风险高. 本次调查中12次采样共鉴定出23种优势种,其中蓝藻门占39.1%、绿藻门占34.9%,夏季和秋季蓝藻门优势种最多且优势度高,冬季和春季绿藻门和硅藻门优势种多且优势度高. 在长江中下游类似富营养水平湖泊中,浮游植物通常都是以绿藻和蓝藻为主. 如长江中游的长湖[18]、沙湖[19]、太平湖[20]、巢湖[21]、青山湖[22]以及下游的太湖梅梁湾[23]、滆湖[24]、淀山湖[25]等湖泊,常见的优势种有微囊藻、平裂藻、小球藻、栅藻等属的种类,其中蓝藻主要以群体性如微囊藻、鱼腥藻等占优势,绿藻以栅藻等为主. 与上述这些湖泊相比,武山湖的氮、磷水平接近甚至略高,其藻优势种及其季节变化与这些已研究报道的湖泊呈现类似特征. 然而,从丰度和生物量上来看,武山湖浮游植物丰度在0.41×106~341.46×106cells/L之间,峰值已经远高于太平湖(6.41×106cells/L)[20]、淀山湖(102×106cells/L)[25]浮游植物丰度峰值,但小于青山湖(726×106cells/L)[22]和巢湖浮游植物丰度峰值(约800×106cells/L)[21]. 根据报道,淀山湖、青山湖和巢湖均曾暴发成片藻类水华,而武山湖目前Chl.a浓度、丰度等均达到很高水平,但是在监测过程中,没有成片藻类聚集现象发生.
RDA分析表明武山湖的WT、TP和pH是影响浮游植物增长及其种群分布的关键理化因子. 温度是影响浮游植物的最重要理化因子之一,温度不仅会影响浮游植物生长率,而且会影响其群落结构变化[26-28]. 在武山湖,水温是影响浮游植物季节变化的最重要环境因子,与蓝藻、绿藻和硅藻均呈正相关,并可独立解释28%的浮游植物丰度和32%的生物量变化. 武山湖夏季(6-8月)浮游植物以蓝藻门微囊藻、细小平裂藻等蓝藻为主,高温和高磷浓度可能是导致其大量生长的主要原因,大量研究也表明夏季藻类种群分布的主要影响因子是温度和磷[21,23]. 聚类分析(图3a)和RDA分析(图5)可清晰表明,武山湖浮游植物群落结构的变化具有明显的季节特征,当水温升高时绿藻和蓝藻的丰度和生物量均显著增高,原因为蓝藻、绿藻喜高温,其主要出现在温度较高的季节[29-32]. 一般来说,蓝藻、绿藻的生长最适温度为25~35℃[33],15℃以下其生长受到限制[34]. 本研究中蓝藻的生长与上述研究结果一致,但绿藻部分优势种的生长与其不一致,如绿藻门小球藻一种曾在1月份成为优势种,可能受到冬季捕捞等因素的影响. 小球藻在温度较低的季节易成为优势种[19,23],武山湖冬季捕捞后浮游植物面临的牧食压力大大降低,而小球藻生长繁殖速度又快,这可能是其在1月份成为最优势种的原因. 武山湖冬季和春季隐藻、硅藻占优势与多数研究结果一致[34].
而对于氮磷来说,其往往是浮游植物生长和分布的限制因子[35]. 本研究中磷浓度的增加有利于蓝藻、绿藻和硅藻的生长,其对蓝藻增长的影响尤为明显. 磷是浮游植物存活的必要条件,浮游植物的物种多样性、丰度和生物量与营养盐的组成和浓度是密不可分的,浮游植物的增长一般与磷呈正相关[35]. 但对于氮来说,RDA分析表明武山湖TN与浮游植物生长呈负相关且相关性不显著,出现负相关的原因可能是因为武山湖TN浓度因外源污染排入所出现的峰值与藻类的生长峰值季节上不同步,同时温度升高在促进藻类生长的同时会造成水体脱氮能力增加[36]. 在一些研究中也发现TN浓度与浮游植物生长呈负相关[15,37-38],水体中氮浓度峰值一般出现在初春,由于温度低限制了藻类生长,使得氮浓度峰值和藻类生物量峰值产生了季节错位. 例如,在太湖水体中氮、磷浓度就存在类似武山湖的季节变化,氮在春季和冬季浓度较高,而在夏季和秋季浓度较低;磷浓度的季节变化与氮相反,春季和冬季浓度较低,而夏季和秋季相对较高[39]. pH对浮游植物群落也有着重要影响,当pH>8.0时,蓝藻往往成为主要优势种[40]. 同时,蓝藻可通过一系列的生理生化反应来调节水体pH,使其维持在适宜藻类生长的范围内[41]. 藻类种群分布与水体pH值的相关性也可能是由于不同环境条件下藻类种群的生长繁殖变化导致水体pH值变化所致[42].
此外,在武山湖,浮游植物群落结构及现存量对以鲢、鳙尤其是鳙为主的鱼类结构的响应值得讨论. 采样期间武山湖放养的鱼类主要是鲢(约21%)、鳙(约70%),其中鲢现存量约为12.6 g/m3、鳙约为33.8 g/m3,二者比值约3:7. 一般认为鲢主要摄食浮游植物,而鳙主要摄食浮游动物[43];但刘恩生等研究发现在以水华蓝藻为主要初级生产力的富营养化湖泊中,鲢、鳙的食性会根据环境的变化而发生改变,它们均以微囊藻为主要食物[44];王媛等基于稳定同位素技术也证实鲢、鳙的主要食物来源为悬浮颗粒有机物,而悬浮颗粒有机物的主要来源为水华蓝藻[45]. 本研究同期采集的鱼类同位素测定结果也显示鲢和鳙的δ15N值均接近13.0‰[46],无显著区别,表明武山湖鲢、鳙鱼食性可能类似. 在调查中发现,武山湖2018年夏季浮游植物最优势种为微囊藻,丰度也很高,但是从2017-2018年周年监测期间并没有出现大规模的水华及藻类聚集在水面的现象. 李林春对南湾水库投放鲢、鳙研究表明,当鲢与鳙的比值在4:6的情况下,能显著降低浮游植物的数量和生物量,同时也大大降低了蓝藻在藻类群落中所占的比例及其生物量,有效地避免了南湾水库蓝藻水华的暴发[5]. 在1998和1999年,千岛湖连续暴发了2次大面积的蓝藻水华,据研究,鲢、鳙生物量的减少可能是其主要原因[47]. 冯超群等于2016年7月,在太湖三国城水域设置孔径为1.5 cm的大型尼龙网围栏,面积约866.7 hm2,鲢、鳙比例为1:1,初始鲢、鳙约2.9 g/尾,生物量约3.27 g/m3,捕捞时围网内鲢、鳙生物量约82.85 g/m3,结果表明单纯放养鲢、鳙适合控制蓝藻水华而非藻类总量,试验期间围栏内大型藻类如束丝藻、假鱼腥藻属等生物量显著下降,到试验结束时几乎消失[48]. 刘其根等综合分析众多鲢、鳙控藻研究结果,认为无论是基于稳定性同位素或PCR-DGGE食性分析,还是通过合理的围隔实验,以及大量的养殖实践,均证实了鲢、鳙是能够控制蓝藻过度生长,但其应用效果受多种因素影响[7]. 因此,尽管对鲢、鳙放养是否能把浮游植物的数量和生物量控制在较低水平目前还存在很多争议,但是对当鲢、鳙养殖密度达到一定程度时可有效控制富营养水体中蓝藻的过度生长,且鲢、鳙的滤食作用会阻止藻类在水面聚集成片这一观点得到较多研究验证.
4 结论
1)综合理化因子、营养状态指数及浮游植物丰度、生物量等指标,采样期间武山湖水质营养程度处于中度-重度富营养水平.
2)武山湖夏季和秋季蓝藻门优势种最多且优势度高,冬季和春季绿藻门和硅藻门优势种多且优势度高,每月优势度最大的种类主要有蓝藻门的微囊藻一种和细小平裂藻、绿藻门的小球藻一种与硅藻门的小环藻一种,表明武山湖浮游植物优势种主要是小型藻类.
3)武山湖浮游植物丰度和生物量在夏季均较高,夏季发生大规模藻类水华的风险较高. RDA和线性相关分析结果表明影响浮游植物丰度和生物量的主要营养元素是磷,磷浓度增加与蓝藻和绿藻的丰度和生物量呈正相关,表明外源磷输入和内源磷释放的控制应引起重视. 在武山湖目前外源污染量还较大的情况下,鲢、鳙的放养对浮游植物过度生长的控制具有积极意义.

