桑叶生物碱对D-半乳糖诱导氧化损伤模型小鼠肾脏的改善作用
杨忠敏,沈以红,王祖文,黄先智,丁晓雯,
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,食品科学与工程国家级实验教学示范中心,重庆 400716;2.西南大学科技处,重庆 400716)
正常生理状况下,机体会产生少量的活性氧自由基(reactive oxygen species,ROS),在抗氧化剂的作用下维持氧代谢平衡,对促进细胞增殖分化、激活转录因子、调控某些生理活性物质等具有重要的生理意义[1]。当细胞受到外源性或内源性因素刺激后,使机体氧化剂的生成异常增加,导致内源性抗氧化剂相对不足,进而发生氧化应激[2]。肾脏参与了机体水、电解质及酸碱平衡调节和多种生物活性物质分泌等重要功能,是重要的排泄器官[3]。机体发生氧化应激会使肾脏抗氧化能力下降,引起氧化损伤,其损伤反应主要包括:蛋白氧化、脂质氧化、DNA氧化等[4]。研究已证实氧化应激是导致慢性肾功能衰竭[5]、急性肾损伤[6]、糖尿病肾病[7]等的主要致病因素之一,在各种肾病的发生发展中起重要作用。因此,寻找可以降低机体氧化应激的有效抗氧化剂,对预防肾相关疾病的发生具有重要意义。
桑叶是国家卫生健康委员会公布的药食两用植物资源。桑叶生物碱作为桑叶的一种特征活性成分,是一类以1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)为主的多羟基哌啶类化合物,具有抗氧化、降糖、降脂、保肝等作用[8]。姚佳等[9]研究表明,DNJ能显著降低糖尿病肾病大鼠肾肥大指数、尿蛋白/肌酐比值,能较好地减轻肾损伤。还有研究证实DNJ能显著改善肾脏脂质氧化损伤进而达到降低肾氧化应激的目的[10-11]。但目前有关桑叶总生物碱从改善蛋白、DNA氧化损伤角度全方位降低肾脏氧化应激的研究国内外无相关报道。笔者前期研究结果表明,桑叶生物碱在体外模拟消化体系表现出较好的抗氧化潜力及其对生物大分子氧化损伤具有显著的改善作用[12-13]。因此,本研究采用D-半乳糖(D-galactose,D-Gal)诱导小鼠建立氧化损伤模型,通过比较评价各组小鼠肾脏脂质、DNA、蛋白质氧化损伤水平、抗氧化酶及ROS产生相关酶活力指标的变化,探讨桑叶生物碱对氧化应激小鼠肾脏的保护作用及其机制,旨在为桑叶生物碱相关保健食品的开发提供理论依据,为氧化应激导致肾损伤的预防和治疗提供新方向。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明种小鼠60 只(体质量18~20 g),4 周龄,购自重庆医科大学实验动物中心,生产许可证号:SCXK(渝)2018-0003。基础饲料,购于重庆医科大学实验动物中心。
干燥桑叶粉,重庆市蚕业科学技术研究院提供。
桑叶生物碱,实验室自制[14],采用硅钨酸沉淀法[5]测定总生物碱含量为93.57%。
D-Gal(纯度≥99%)、谷胱甘肽(glutathione,GSH)(纯度≥98%) 上海阿拉丁生化科技股份有限公司;8-异前列腺素F2α(8-iso-prostaglandin F2α,8-iso-PGF2α)、蛋白羰基(protein carbonyl,PCO)、晚期蛋白氧化产物(advanced oxidation protein products,AOPP)、8-羟基鸟嘌呤(8-hydroxy-2’-desoxyguanosine,8-OH-dG)、5-羟基胞嘧啶(5-hydroxy-2’-deoxycotosine,5-OH-dC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶(NADPH oxidase,NOX)、蛋白激酶C(protein kinase C,PKC)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒 厦门慧嘉生物科技有限公司;其他试剂均国产分析纯。
1.2 仪器与设备
S y m e r g y H 1 酶标仪 美国基因有限公司;RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂;811DK高速冷冻离心机 德国Eppendorf AG公司;KQ5200DB超声波清洗仪 昆山市超声仪器有限公司;F6/10型均浆机 上海弗鲁克流体机械制造有限公司。
1.3 方法
1.3.1 动物饲养、造模及分组
小鼠按照西南大学实验动物保护和使用规则饲养,室温(23±2)℃,相对湿度40%~60%,整个实验期间室内通风条件良好, 1 2 h 明暗交替(9∶00 a.m.~21∶00 p.m.),所有小鼠均喂饲基础饲料,自由觅食、饮水。
70 只雄性SPF级昆明种小鼠,饲养7 d适应环境后,随机分出1 0 只小鼠为正常对照组,腹腔注射与造模试剂等体积的生理盐水;其余小鼠腹腔注射D-Gal(1 000 mg/kgmb),连续注射20 d后,颌下采血,测定造模组、正常对照组小鼠血清中丙二醛(malondialdehyde,MDA)、SOD水平是否存在显著性差异,若存在则判断小鼠造模成功,用于后续实验。
保留正常对照组小鼠10 只。剔除造模未成功的以及造模过程中死亡的10 只小鼠,剩余造模成功的50 只小鼠,随机分为模型对照组、阳性药物组(灌胃200 mg/kgmbGSH)以及桑叶生物碱低、中、高剂量组(分别灌胃50、100、200 mg/kgmb桑叶生物碱,剂量根据预实验所确定),每组10 只。所有小鼠每天灌胃1 次,连续4 周。
1.3.2 肾脏样本采集及制备
4 周实验结束后,各实验组小鼠禁食不禁水12 h,摘取小鼠眼球取血,然后颈椎脱臼处死,快速取出肾脏,用冷生理盐水漂洗除去表面血液,于-80 ℃保存备用。
肾脏组织按照试剂盒说明书上的方法,以质量比1∶9的比例加入生理盐水,用均浆机均浆,3 000 r/min离心20 min,取上清液于-80 ℃保存备用。
1.3.3 相关指标测定
肾脏中8-iso-PGF2α、PCO、AOPP、8-OH-dG、5-OH-dC的水平,抗氧化酶系统中SOD、GSH-Px活力,NOX、PKC活力检测,均按照试剂盒说明书进行操作。
1.4 数据统计分析
2 结果与分析
2.1 造模成功时小鼠血清中SOD、MDA水平变化

表1 D-Gal对小鼠血清中MDA、SOD水平的影响(n=10)Table 1 Effect of D-Gal on malondialdehyde and SOD levels in serum of mice (n = 10)
由表1可知,造模成功时,与正常对照组相比,模型对照组中的MDA水平极显著增加(P<0.01),SOD活力极显著降低(P<0.01),表明小鼠造模成功。
2.2 桑叶生物碱对D-Gal模型小鼠肾组织蛋白氧化损伤指标的影响
蛋白的羰基化是蛋白质侧链基团与金属离子和H2O2反应发生的不可逆蛋白氧化修饰,PCO水平是反应细胞发生氧化损伤的重要标志[15]。AOPP是氧化应激过程中双络氨酸蛋白氧化产物,其水平与慢性肾病的发展密切相关[16]。本研究测定小鼠肾脏组中PCO、AOPP水平,以考察桑叶生物碱对肾组织蛋白氧化损伤的影响。

表2 桑叶生物碱对D-Gal模型小鼠肾组织PCO、AOPP水平的影响(n=10)Table 2 Effects of mulberry leaf alkaloids on PCO and AOPP in the kidney of D-Gal-induced model mice (n= 10)
由表2可知,与正常对照组相比,模型组小鼠肾组织中PCO、AOPP水平分别增加了70.66%、79.77%(P<0.01),表明模型组小鼠肾脏发生蛋白氧化损伤;与模型组对照组相比,阳性药物组PCO、AOPP水平分别极显著减少了38.33%、43.75%(P<0.01);桑叶生物碱各剂量组可以显著降低PCO、AOPP水平,其中高剂量组的PCO、AOPP水平分别减少了37.27%、42.71%(P<0.01),且均恢复至正常对照组水平(P>0.05)。结果表明,实验剂量范围内,桑叶生物碱对小鼠肾脏组织中PCO、AOPP水平有明显下调作用。
2.3 桑叶生物碱对D-Gal模型小鼠肾组织脂质氧化损伤指标的影响
8-iso-PGF2α是生物膜上磷脂中花生四烯酸受到ROS攻击后发生的脂质氧化产物,其结构稳定,是反应自由基脂质过氧化的理想指标[17]。本研究测定小鼠肾脏中8-iso-PGF2α水平,以考察桑叶生物碱对肾组织脂质氧化损伤的影响。
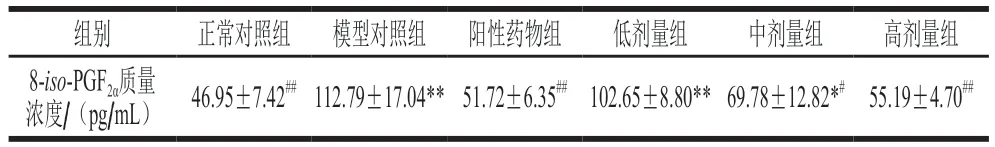
表3 桑叶生物碱对D-Gal模型小鼠肾组织中8-iso-PGF2α的影响(n=10)Table 3 Effects of mulberry leaf alkaloids on 8-iso-PGF2α in the kidney of D-Gal-induced model mice (n= 10)
由表3可知,与正常对照组相比,模型组小鼠肾组织中8-iso-PGF2α质量浓度增加了140.23%(P<0.01),表明模型组小鼠肾脏发生严重的脂质氧化损伤;与模型对照组相比,阳性药物组、桑叶生物碱高剂量组的8-iso-PGF2α质量浓度分别极显著减少了54.14%、51.07%(P<0.01)。结果表明,实验剂量范围内的桑叶生物碱对小鼠肾脏组织中8-iso-PGF2α水平有明显的下调作用,且高剂量桑叶生物碱可使该指标恢复至与正常对照组无显著差异的水平(P>0.05)。
2.4 桑叶生物碱对D-Gal模型小鼠肾组织DNA氧化损伤指标的影响
8-OH-dG是DNA分子中鸟嘌呤第8位C原子受到ROS攻击形成的氧化性加合物,是目前公认的评价DAN氧化损伤的指标[18]。已有研究表明5-OH-dC是另一类重要的DNA氧化损伤产物[19]。本研究测定小鼠肾脏组织中8-OH-dG、5-OH-dC水平的变化,以考察桑叶生物碱对肾组织DNA氧化损伤的影响。

表4 桑叶生物碱对D-Gal模型小鼠肾组织中8-OH-dG、5-OH-dC质量浓度的影响(n=10)Table 4 Effects of mulberry leaf alkaloids on 8-OH-dG and 5-OH-dC in the kidney of D-Gal-induced model mice (n= 10)
由表4可知,与正常对照组相比,模型对照组小鼠肾组织中8-OH-dG、5-OH-dC质量浓度分别增加了51.46%、27.17%(P<0.01),表明模型组小鼠肾脏发生DNA氧化损伤;与模型组对照组相比,阳性药物组的8-OH-dG、5-OH-dC质量浓度分别减少33.06%、20.10%(P<0.01);桑叶生物碱高剂量组的8-OH-dG、5-OH-dC质量浓度分别减少了31.66%、18.91%(P<0.01)。结果显示,实验剂量范围内,桑叶生物碱对小鼠肾脏组织中8-OH-dG、5-OH-dC质量浓度有明显下调作用,且剂量桑叶生物碱可使这2个指标恢复至与正常对照组无显著差异的水平(P>0.05)。
2.5 桑叶生物碱改善D-Gal模型小鼠肾组织损伤的作用机制
2.5.1 桑叶生物碱对D-Gal模型小鼠肾组织SOD、GSH-Px活力的影响
SOD能有效清除机体超氧阴离子,使ROS维持在一定水平,被认为是抗氧化系统的第一道防线[20]。GSH-Px在催化还原型谷胱甘肽转变为氧化型谷胱甘肽方面发挥重要作用,且可清除机体中H2O2及脂质过氧化产物[21]。本研究测定小鼠肾脏组中SOD、GSH-Px活力,以考察桑叶生物碱对肾组织抗氧化能力的影响与作用途径。

图1 桑叶生物碱对D-Gal模型小鼠肾组织中SOD(a)、GSH-Px(b)活力的影响(n =10)Fig. 1 Effects of mulberry leaf alkaloids on the activity of SOD (a) and GSH-Px (b) in the kidney of D-Gal-induced model mice (n = 10)
由图1可知,与正常对照组相比,模型组小鼠肾组织中SOD、GSH-Px活力分别降低了48.06%、38.52%(P<0.01),表明模型组小鼠肾脏抗氧化能力减弱;与模型对照组相比,阳性药物组的SOD、GSH-Px活力分别升高了87.26%、60.89%(P<0.01);桑叶生物碱高剂量组SOD、GSH-Px活力分别升高了83.74%、59.31%(P<0.01)。结果显示,实验剂量范围内,桑叶生物碱能增加小鼠肾脏组织中SOD、GSH-Px活力,且高剂量能使这两个指标恢复至与正常对照组无显著差异的水平(P>0.05)。
2.5.2 桑叶生物碱对D-Gal模型小鼠肾组织NOX、PKC活力的影响
NOX能将细胞内NADPH的电子传递给氧分子以生成ROS,是ROS的主要来源酶[22]。PKC属于丝氨酸/苏氨酸激酶家族,是细胞内重要的信号转导分子。在机体氧化应激情况下,ROS可以诱导并激活PKC,从而又促进ROS的产生,形成恶性循环,导致氧化损伤不断扩大。因此,寻找PKC特异性抑制剂对保证机体健康,特别是保护氧化应激诱导肾损伤具有重要意义[23]。

图2 桑叶生物碱对D-Gal模型小鼠肾组织中NOX(a)、PKC(b)活力的影响(n =10)Fig. 2 Effects of mulberry leaf alkaloids on the activity of NOX (a) and PKC (b) in the kidney of D-Gal-induced model mice (n = 10)
由图2可知,与正常对照组相比,模型组小鼠肾组织中NOX、PKC活力分别升高了77.82%、79.96%(P<0.01),表明模型组小鼠肾脏ROS生成量增加;与模型对照组相比,阳性药物组NOX、PKC活力分别降低了42.77%、42.92%(P<0.01);桑叶生物碱高剂量组NOX、PKC活力分别降低了41.21%、40.65%(P<0.01)。结果显示,在实验剂量范围内,桑叶生物碱能抑制小鼠肾脏组织中NOX、PKC活力,且高剂量能使这两个指标恢复至与正常对照组无显著差异的水平(P>0.05)。
3 讨 论
D-Gal在醛糖还原酶的作用下生成半乳糖醇,而半乳糖醇不能被细胞代谢,进而造成细胞代谢紊乱,破坏并消耗机体的抗氧化物质,进而产生大量的ROS[24]。脂质、蛋白质、DNA等物质是构成生命的基础物质,而ROS高活泼且具有极强的氧化能力,能够通过连锁反应不断攻击体内的脂质、蛋白质、DNA等物质,使它们发生氧化修饰[4]。这些化学修饰会打破机体氧化还原平衡,并且会依据损伤程度改变相应的生物学功能,最终导致病理障碍的发生和发展[25]。本研究通过注射D-Gal建立氧化应激小鼠模型,从脂质、蛋白质及DNA氧化损伤角度探究桑叶生物碱对氧化应激导致的肾功能异常的改善作用及机制。目前已有大量研究证实许多天然化合物从脂质氧化角度对肾脏氧化应激损伤具有改善作用[26-27]。马志等[28]研究表明了桑叶总生物碱能显著下调糖尿病肾病小鼠尿白蛋白含量及肌酐清除率,改善其肾脏组织病理损伤。本研究结果表明,200 mg/kg mb桑叶生物碱能显著下调肾组织中PCO、AOPP、8-iso-PGF2α、8-OH-dG和5-OH-dC水平(P<0.01),进一步从氧化应激角度证实了桑叶生物碱能有效改善肾损伤。前期研究已表明桑叶生物碱对血浆中生物大分子的氧化损伤具有明显改善作用[12],本研究将肾脏组织中评价蛋白质、脂质、DNA氧化损伤与血浆中指标作相关性分析,血浆与肾脏组织中PCO、AOPP、8-iso-PGF2α、8-OH-dG、5-OH-dC水平之间的相关系数分别为0.912、0.972、0.986、0.975、0.911(P<0.01)。表明血浆与肾脏组织氧化应激损伤具有极显著相关性,则可考虑检测血浆中氧化损伤指标来反应肾脏氧化损伤情况,不必进行肾脏组织的活体检测,有利于活体动物的保存。
机体内的抗氧化还原酶系统能降低ROS的生成及其导致的损害作用,从而维持细胞的正常功能和氧化还原平衡。这些抗氧化酶能直接参与ROS的清除并通过结合ROS生产时所需要的金属离子来抑制ROS的产生。内源性抗氧化酶如SOD、GSH-Px等,是生物体中抗氧化酶系统的重要组成部分,在保护细胞免受氧化损伤的过程中起着重要作用[29]。本研究结果表明,模型组小鼠SOD、GSH-Px的活力明显受抑制,给予桑叶生物碱后,肾组织内抗氧化酶活力有升高趋势,且高剂量组能使这两种酶活力恢复到与正常组无显著性差异(P>0.05)的水平,说明桑叶生物碱能通过上调内源性抗氧化酶的活力来缓解肾脏氧化损伤。
NOX被认为是机体氧化还原信号的关键酶,可通过NADPH依赖的单电子还原系统将机体氧分子还原成超氧负离子,通过质膜传递电子而生成化学性质活泼、含氧功能基团的化合物ROS[30-31]。已有研究表明,使用NOX抑制剂或敲除NOX的基因,能明显减轻氧化损伤[32]。因此,抑制NOX活性是预防机体ROS过量产生的有效途径之一。正常肾组织中,N末端作为假底物与C末端催化区的底物结合位点相结合,使PKC以无活性的形式存在于胞浆内,当受到外源性刺激时,在特异性底物蛋白的作用下向包膜转移而被活化,进而催化NADPH发生氧化反应,产生H2O2[33-34]。已有研究证实了生物碱化合物可抑制NOX、PKC的活性[35]。本研究结果表明,200 mg/kg mb桑叶生物碱能显著抑制NOX、PKC活性(P<0.01),表明桑叶生物碱能作为NOX、PKC的有效抑制剂进而控制机体ROS大量生成。
综上所述,桑叶生物碱能有效改善氧化应激导致的肾损伤,其机制可能与升高抗氧化酶和抑制NOX、PKC活力,进而减少机体ROS过量产生有关。该研究结果有助于氧化应激诱导的肾损伤的预防和治疗,有助于桑叶生物碱的综合开发利用。

