嗜酸乳杆菌在初始弱酸碱条件下对HT-29细胞免疫因子的调节作用
张秋月,王 刚,陈坤朋,潘道东,,*,曾小群,吴 振,郭宇星
(1.宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211;2.南京师范大学食品与制药工程学院,江苏 南京 210097)
益生菌被定义为当宿主摄入一定的量时,能通过调节肠道菌群的平衡来维持宿主消化系统和肠道健康的一类活的微生物[1-2]。近年来,有关益生菌的特性、功能和对人体益生作用的研究和应用逐渐增多[3]。乳酸菌作为一种益生菌,对一些人类疾病如肠功能障碍、炎症性肠病和结肠癌等起到预防和治疗效果[4],其对人体免疫系统的调节作用也备受关注。
乳酸菌通过对宿主黏膜和肠上皮细胞的黏附定植在肠道中,并刺激机体的免疫系统[5],通过调节细胞因子和趋化因子的产生来增强宿主的免疫能力[6]。目前体外实验用肠道细胞模型来模拟人体肠上皮细胞的免疫效应,是一种有效的实验方法,常用的细胞有人结肠癌HT-29、Caco-2、Lovo等。黄怡等[7]用乳酸乳球菌和屎肠球菌分别与Caco-2细胞共同培养1 h,再分别与大肠杆菌K882孵育培养2 h,结果发现这两株乳酸菌可以通过抑制促炎因子增殖诱导配体的分泌,促进抗炎因子白细胞介素(interleukin,IL)-10的产生,来减弱Caco-2细胞对大肠杆菌的炎症应答,表现出抗炎作用。Lin Qiuye等[8]先用瑞士乳杆菌R0052和嗜热链球菌R0083发酵的大豆发酵液处理HT-29细胞16 h,再加入肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)孵育培养3 h,结果发现40 个促炎基因中有33 个基因下调,该发酵液可以通过减弱编码多种促炎因子基因的表达来发挥免疫调节的作用。对肠上皮细胞黏附能力强的乳酸菌,延长了其在胃肠道的驻留时间,促进了其与宿主的相互作用,使其在胃肠道环境中拥有竞争优势[9],有利于其发挥益生特性。Garriga等[10]发现肠道菌株鼠李糖乳杆菌CTC1679能通过置换作用抑制单核增生李斯特菌对HT-29细胞的黏附,维持肠道的健康。丙酸杆菌Q4能抑制大肠杆菌C3和肠炎沙门氏菌90/390对HT-29细胞的黏附,可用于开发含有丙酸杆菌的功能性食品,有助于抵抗肠道病原体的感染[11]。
嗜酸乳杆菌(Lactobacillus acidophilus)作为一种具有良好特性的益生菌,已被报道具有提高动物生产性能和增强免疫反应的作用[12-14]。Fallingborg[15]研究了健康人体的胃肠道pH值,小肠和大肠的pH值分别在4.92~7.52和5.60~8.66之间,证明L. acidophilus可以通过胃部酸性环境进入小肠[16],同时王刚等[17]报道了pH 5.5~7.5培养条件下L. acidophilus的黏附特性,结果表明pH 5.5和pH 7.5条件下培养的L. acidophilus的黏蛋白黏附特性和细胞黏附特性均存在显著性差异。在pH 5.5和pH 7.5的弱酸、弱碱性肠道环境中,L. acidophilus能否促进肠上皮细胞的免疫效应还是未知,哪种肠道环境对L. acidophilus调节肠道免疫更有利,其调节机制还有待研究。基于上述问题,本实验将pH 5.5和pH 7.5培养条件下的L. acidophilus与HT-29细胞共同培养,初步探讨在类似肠道的弱酸、弱碱性条件下,具有显著性黏附差异的L. acidophilus对肠道细胞的免疫影响,以期为今后研究L. acidophilus和不同黏附特性的乳酸菌对肠道细胞的免疫调节及维持肠道健康机制提供参考。
1 材料与方法
1.1 材料与试剂
Lactobacillus acidophilusATCC 4356购自中国科学院菌种保藏中心;HT-29细胞购自中国科学院上海细胞库。
McCoy’s 5A培养基 上海源培生物科技股份有限公司;胎牛血清 上海依科赛生物制品有限公司;青链霉素混合液 上海碧云天生物技术有限公司;质量分数0.25%胰蛋白酶溶液-乙二胺四乙酸 美国Life Technologies公司;pH 7.2~7.4、10 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS) 北京酷来搏科技有限公司;细胞总RNA提取试剂盒 美国Omega公司;目的基因及内参基因引物 上海英潍捷基贸易有限公司;DNA Marker、反转录聚合酶链式反应(reverse transcriptase polymerase chain reaction,RT-PCR)试剂盒、反转录实时荧光定量聚合酶链式反应(RT-quantitative real-time PCR,RT-qPCR)试剂盒 北京全式金生物技术有限公司;IL-8、IL-10、TNF-α酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 杭州联科生物技术股份有限公司。
1.2 仪器与设备
M200 Pro型酶标仪 瑞士Tecan公司;IX53型倒置式荧光显微镜 日本Olympus公司;MCO-18AIC型CO2培养箱 日本Sanyo电机株式会社;Thermal Cycler型PCR仪 美国莱伯特公司;Universal Hood II型凝胶成像分析系统 美国Bio-Rad公司;超微量分光光度计上海依科赛生物制品有限公司;Light Cycler 96型荧光定量PCR仪 瑞士Roche公司;5415R型台式高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 HT-29细胞的培养
将在液氮中保存的HT-29细胞取出,37 ℃水浴迅速解冻复苏,在培养皿中加入现配的含有双抗(青链霉素混合液1×)和胎牛血清的McCoy’s 5A细胞培养基,5%(体积分数,下同)的CO2培养箱中37 ℃培养4 h,观察细胞贴壁状况,待细胞长满培养皿底面积的80%后,将细胞用质量分数0.25%的胰酶消化处理,并转移到6 孔培养板中,连续培养至细胞长满培养板底面积的90%以上时进行L. acidophilus的干预实验,干预实验过程中使用生长活力较好的对数期细胞。
1.3.2L. acidophilus的培养
将L. acidophilus在50 mL MRS肉汤培养基中37 ℃培养7 h后,按体积分数2%的接种量分别接种到初始pH值为5.5和7.5的100 mL MRS肉汤培养基中,37 ℃培养10 h,6 000 r/min离心10 min,弃上清液。菌体用无菌PBS清洗3 次,最终调整菌液OD600nm=1.0(约109CFU/mL)。取2 mL均匀后的菌液,10 000 r/min离心1 min,弃上清液,加入等体积的无双抗细胞培养液,4 ℃备用。
1.3.3L. acidophilus与HT-29细胞的共培养
空白对照组:在6 孔细胞培养皿中加入2 mL无双抗细胞培养液。
实验处理组:在6 孔细胞培养皿中分别加入2 mL含有pH 5.5和pH 7.5的L. acidophilus细胞培养液。均置于5%的CO2培养箱中37 ℃培养3 h。
1.3.4 HT-29细胞总RNA的提取与琼脂糖凝胶电泳的测定
用无菌PBS多次洗涤6 孔培养板中的HT-29细胞,去除L. acidophilus,按照细胞总RNA提取试剂盒的操作说明,向6 孔培养板中加入裂解液,吹打,以充分裂解细胞,随后加入等体积的70%(体积分数,下同)乙醇,将混合物转移到离心柱中,室温10 000×g离心60 s,弃掉流出液,向离心柱中加入RNA缓冲液I,10 000×g离心60 s,弃掉流出液。向离心柱中央加入无RNA的核酸内切酶消化液,室温(25~30 ℃)放置15 min,重复加入RNA缓冲液I,10 000×g离心60 s,弃掉流出液。向离心柱中央加入RNA缓冲液II,10 000×g离心60 s,弃掉流出液,并重复一次。将离心柱转入一个新的1.5 mL无RNA酶的离心管中,并向离心柱中央加入预热的DEPC水10 000×g离心60 s,洗脱RNA。在-80 ℃保存备用。将提取的细胞总RNA进行2%琼脂糖凝胶电泳,同时测定提取的细胞总RNA的浓度,确定RNA的纯度是否符合下一步的实验要求(具有清晰且单一的条带)。
1.3.5 ELISA实验
将6 孔培养板中的细胞培养上清液10 000×g离心1 min,取上清液分装到无酶PE管中,液氮淬灭后于-80 ℃下贮存待测样品。样品检测前于4 ℃解冻,实验中应避免样品反复冻融。
1.3.6 HT-29细胞免疫因子的基因相对表达量测定
反转录按照RT-PCR说明书进行。实验细胞总RNA为1 000 ng,反转录体系组分包括5×TransScript®All-in-One SuperMix for qPCR 10 μL、gDNA去除剂2.5 μL,以无RNA酶水补足50 μL。
将各组分混匀置于PCR仪中,参数设置为:42 ℃、15 min,85 ℃、5 s,使TransScript®RT/RI和gDNA去除剂失活,迅速将cDNA于4 ℃保存备用。
在NCBI及UniProt数据库中获得目的基因和内参基因的基因序列,利用Primer 5.0软件设计相应引物,RT-PCR引物序列见表1。

表1 RT-qPCR引物序列Table 1 Primer sequences used for RT-qPCR
加入1 μL cDNA模板,将各目的基因和内参基因GAPDH同时扩增,使用qPCR仪,RT-qPCR体系组分包括模板cDNA 1 μL、10 μmol/μL正向及反向引物各0.4 μL、2×TransStart®Top/Tip Green qPCR Super Mix 10 μL,以ddH2O补足20 μL。加样后进行RT-qPCR扩增反应,扩增参数为:预变性94 ℃、30 s,循环一次;变性94 ℃、5 s,退火60 ℃、30 s,循环45 次。在60 ℃退火30 s时采集荧光值,熔解曲线分析步骤为:变性95 ℃、10 s,退火65 ℃、60 s,变性97 ℃、1 s,循环一次。冷却阶段参数为:37 ℃保温600 s,不采集荧光值。以GAPDH基因为内参基因,采用2-ΔΔCt法计算实验处理组相对于空白对照组HT-29细胞各免疫因子基因的相对表达量。
1.3.7 HT-29细胞免疫因子质量浓度测定
将IL-8、IL-10、TNF-α标准品按免疫因子标准品说明书梯度稀释,细胞培养基作为各个标准曲线的零浓度。具体步骤按照ELISA试剂盒说明书进行操作,反应结束后迅速用酶标仪测定在450 nm和570 nm波长处的OD值,OD值的校准用OD450nm-OD570nm表示。
1.4 数据统计与分析
实验设置3 组平行,数据以平均值±标准差表示,采用SAS V8软件完成统计分析,并利用Origin 8.5软件绘图。差异显著性比较采用单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 HT-29细胞RNA琼脂糖凝胶电泳分析结果
为确定提取的HT-29细胞总RNA的质量,对提取的RNA进行2%的琼脂糖凝胶电泳(图1),HT-29细胞的28S RNA和18S RNA条带较为清晰且单一,表明提取的RNA纯度较高,可用于后期实验。
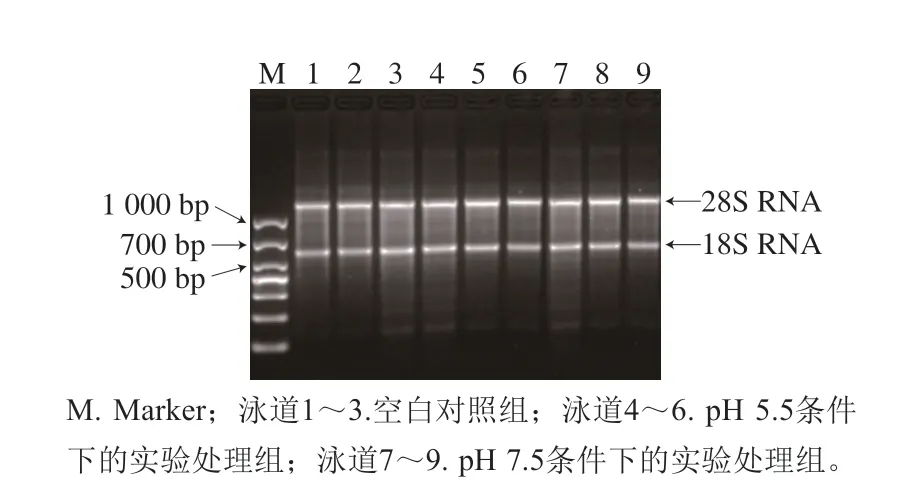
图1 HT-29细胞RNA琼脂糖凝胶电泳图Fig. 1 Agarose gel electrophoresis analysis of total RNA extracted from HT-29 cells
2.2 HT-29细胞免疫因子基因相对表达量测定结果
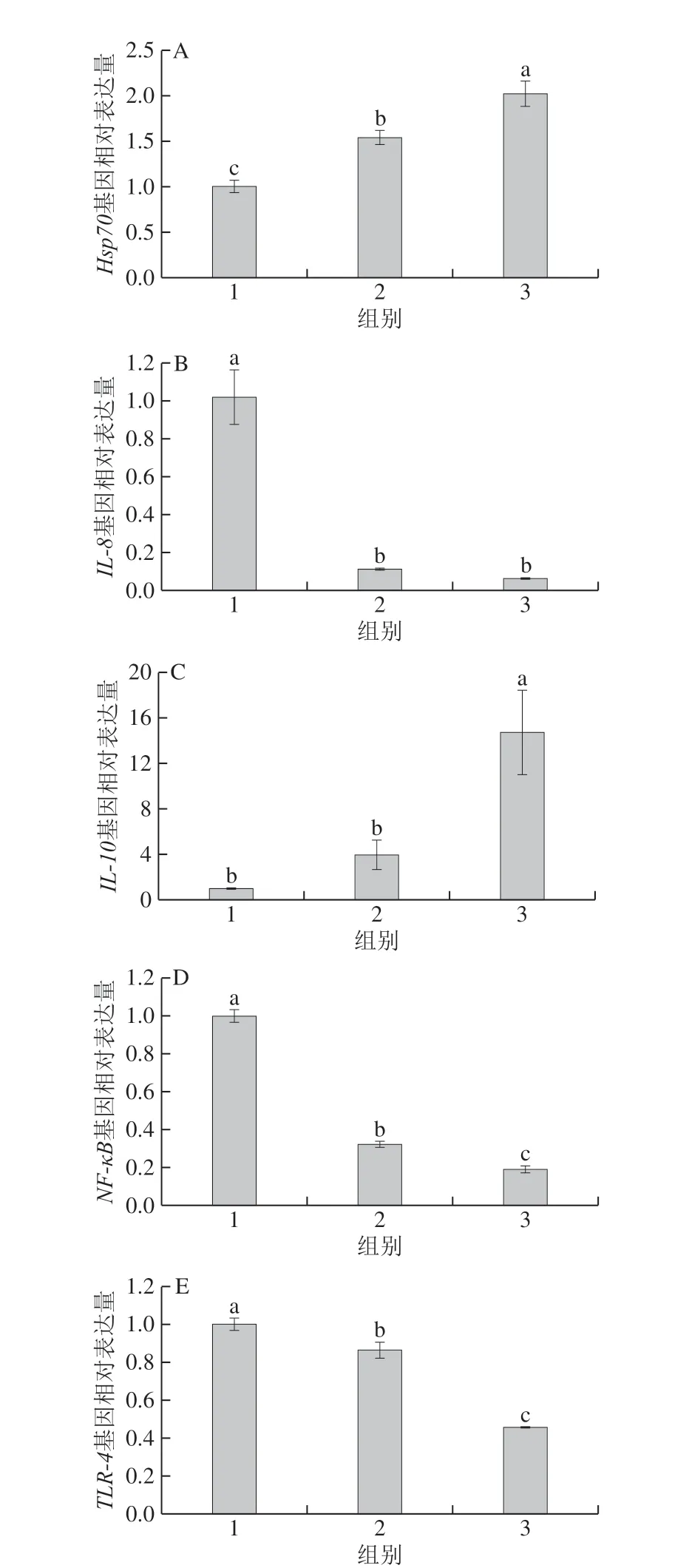

图2 3 组HT-29细胞免疫因子基因相对表达量Fig. 2 Relative gene expression levels of immune factors in HT-29 cells from three groups
如图2 所示,与空白对照组相比,实验处理组H s p 7 0 和T N F-α 基因的相对表达量极显著上调(P<0.01),IL-8、NF-κB和TLR-4基因的相对表达量极显著下调(P<0.01),表明在共培养过程中L. acidophilus的加入对HT-29细胞产生了显著的免疫刺激,通过产生各种细胞因子,引起肠黏膜系统的先天性免疫和获得性免疫反应。IL-8是一种促炎趋化因子,在正常生理条件下,上皮细胞在受到感染或组织损伤时会产生IL-8,IL-8可诱导中性粒细胞向受感染部位趋化,通过诱导吞噬作用、氧化爆发来降低感染的几率[18]。处理组中HT-29细胞IL-8基因的相对表达量极显著下调(P<0.01),表明L. acidophilus能降低HT-29细胞感染和组织损伤的程度,对肠上皮细胞起到一定的保护作用。
与空白对照组相比,实验处理组在p H 5.5 条件下Hsp70和TNF-α基因的相对表达量极显著上调(P<0.01),分别是空白对照组的1.54 倍和11.9 倍,IL-8、NF-κB和TLR-4基因的相对表达量极显著下调(P<0.01),分别是空白对照组的0.11、0.33 倍和0.86 倍,IL-10基因的相对表达量呈现上调的趋势,但与空白对照组相比无显著性差异(P>0.05)。大量研究表明Hsp,特别是保守的Hsp70,能够激活免疫反应,在调节先天免疫应答中起着重要作用。Lan Cheng等[19]研究表明Hsp70可以改善小鼠感染性肠易激综合征的副反应和肠蠕动异常,通过促进抑炎因子IL-10的产生提高小鼠的肠道免疫力。本实验也得到了相似的结果,HT-29细胞经pH 5.5培养的L. acidophilus刺激后,Hsp70基因的相对表达量极显著上调(P<0.01),同时IL-10基因的相对表达量呈现上升的趋势,表明弱酸条件下的L. acidophilus能提高肠道细胞抵抗外界不良环境的能力,维护肠道健康。
用pH 7.5条件下培养的L. acidophilus和HT-29细胞共同培养,Hsp70、IL-8、IL-10、NF-κB、TLR-4和TNF-α基因的相对表达量分别是空白对照组细胞的2.02、0.06、14.70、0.19、0.46 倍和24.9 倍,均与空白对照组存在显著性差异(P<0.05)。NF-κB通路是一个典型的炎症信号通路,可被TLR-4激活,促进促炎细胞因子的表达,引发强直性脊柱炎等多种疾病[20]。TLRs是对抗病原体的第一道防线,可诱导机体对受损组织自身产生的抗原产生免疫反应,从而导致许多自身免疫性和炎性疾病[21]。目前主要利用小分子的拮抗剂选择性地与TLRs结合,抑制TLRs信号的转导,逆转TLRs在自身免疫性和炎性疾病中的破坏作用[22]。T L R-N F-κ B 是一个典型的炎症通路,T L R 可通过下游的信号分子如髓样分化因子8 8(m y e l o i d differentiation factor 88,MyD88)激活NF-κB通路,本研究表明HT-29细胞与pH 7.5条件下的L. acidophilus共同培养后,NF-κB和TLR4基因的相对表达量极显著降低(P<0.01),减少了整个TLR-NF-κB炎症信号转导过程的产物,有利于保护肠道细胞免受自身免疫反应和炎症性疾病的影响[21]。
HT-29细胞与pH 7.5实验处理组的L. acidophilus共同培养后,Hsp70、IL-10和TNF-α基因的相对表达量极显著高于p H 5.5 实验处理组(P<0.01),同时N F-κ B 和T L R 4 基因的相对表达量极显著下调(P<0.01)。对肠上皮细胞的黏附能力是评价菌株益生性的重要指标,有研究表明Lactobacillus casei CRL431与Lactobacillus paracasei CNCMI-1518可通过TLRs黏附于肠上皮细胞,并刺激相关免疫细胞引起细胞因子IL-6和巨噬细胞趋化蛋白1增加,从而引起机体的先天免疫应答[23]。Zhou Mingxu等[24]用甲基-β-环糊精去除Caco-2和IPEC细胞的胆固醇,可明显减少大肠杆菌和沙门氏菌对肠上皮细胞的黏附和侵袭,并且降低了纯化重组大肠杆菌鞭毛蛋白激活肠上皮细胞TLR-5信号的能力。Reti等[25]研究表明空肠弯曲杆菌可显著提高大肠杆菌HB101对T84细胞的黏附,同时下调T84细胞TLR-4基因的表达,上调IL-8基因的表达。Wu Zhen等[26]对L. acidophilus在类似肠道的pH值环境中生长时的黏附活性进行了蛋白组学分析,发现pH 5.5和pH 7.5组的黏附相关表面蛋白PrtP和FmtB的表达上调,且差异蛋白数高达207 个。在以上研究的基础上,本实验结果表明弱碱条件下黏附能力强的L. acidophilus对上皮细胞免疫因子的产生具有显著性的影响,通过减少TLR-NF-κB炎症信号的转导,促进抗炎因子IL-10的产生,更利于L. acidophilus发挥肠道益生作用,提高肠道的免疫力。
2.3 HT-29细胞免疫因子的质量浓度测定结果
如表2所示,IL-8在空白对照组中质量浓度极显著高于实验处理组(P<0.01)。在实验处理组中,pH 5.5处理组IL-8的质量浓度低于pH 7.5处理组,但两组之间并无显著性差异(P>0.05),其差异分析的结果与IL-8基因转录水平测定结果具有一致性。研究表明IL-8与多种炎症性疾病和肿瘤的发展密切相关,目前临床上开发的相关受体抑制剂对相关疾病有明显的治疗作用[27]。实验结果表明L. acidophilus的加入,可极显著提高肠道细胞抵抗炎症性疾病和肿瘤的免疫能力(P<0.01)。
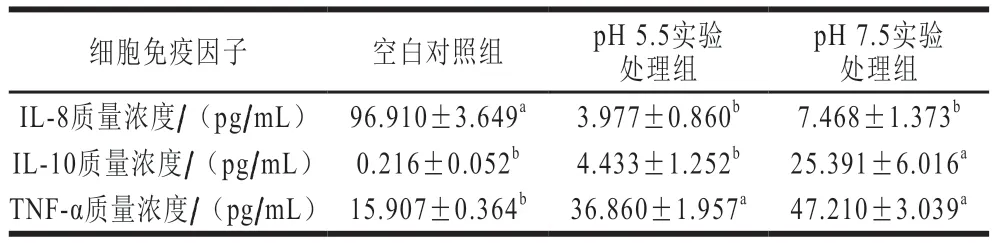
表2 不同处理组HT-29细胞免疫因子的质量浓度Table 2 Concentrations of immune factors in HT-29 cells
IL-10在实验处理组中的质量浓度极显著高于空白对照组(P<0.01)且pH 7.5处理组相对于pH 5.5处理组,IL-10的质量浓度极显著增加(P<0.01),和IL-10基因转录水平结果一致。IL-10是一种有效的抗炎细胞因子,对保护宿主免受过度炎症和免疫反应至关重要。人类遗传学研究也证实了IL-10对预防肠道内的有害炎症发挥着重要的作用[28]。Xiao Zuoxiang等[29]研究表明IL-10可保护小鼠胰岛细胞免受致糖尿病T细胞的侵袭。动物肠道中巨噬细胞IL-10受体(IL-10Rα)的表达缺失后,易引发自发性的溃疡性结肠炎[30]。实验结果表明弱碱条件下(pH 7.5)培养的L. acidophilus能极显著提高HT-29细胞抗炎因子IL-10的质量浓度(P<0.01),降低机体的肠道炎症。
实验处理组中TNF-α的质量浓度极显著高于对照组(P<0.01),pH 7.5实验组和pH 5.5实验组TNF-α的质量浓度无显著性差异(P>0.05),与TNF-α基因转录水平测定结果有一定偏差,可能的原因是基因的表达和翻译过程存在时间差,或者是TNF-αmRNA水平的提高,激活了TNF-α基因表达的负调控因素,从而抑制了TNF-α的表达。TNF-α是具有多种生物学效应的细胞因子,适量的TNF-α在抵抗病原菌和肿瘤预防中起着重要的作用,当其超过一定量时可与其他炎症因子一起促进癌症的发生及多种病理性损伤[31]。董雨龙[32]报道,TNF-α可通过激活NF-κB信号通路和抗凋亡基因的高表达参与大鼠急性肝损伤的调节,适量质量浓度的TNF-α对急性肝损伤具有保护作用。同时Djaldetti等[33]研究发现益生菌能促进人类外周血单核细胞分泌TNF-α、IL-1β、IL-6和干扰素γ,其中TNF-α质量浓度达1.81 ng/mL,同时降低脂多糖(lipopolysaccharide,LPS)对细胞的炎症反应。Hu Naihua等[34]利用LPS建立人肝星状细胞炎症模型,研究连翘脂素的炎症干预效果,结果表明连翘脂素能通过抑制TLR4/MyD88/NF-κB信号通路降低LPS的促炎反应,TNF-α的质量浓度降至约为80 pg/mL。本实验结果表明在添加L. acidophilus以后,细胞因子TNF-α在转录水平和蛋白相对表达水平均极显著提高(P<0.01),质量浓度达47.21 pg/mL。TNF-α能通过激活NF-κB信号通路,引发肠道炎症,实验结果显示TNF-α、TLR-4和NF-κB的基因相对表达量未出现同步变化,可能的原因是L. acidophilus对肠道细胞TNF-α质量浓度的提高主要是增强肠道细胞的免疫活性,不会引起肠道的炎症疾病。
3 结 论
本实验对具有黏附性差异的L. acidophilus对肠道细胞免疫因子的影响做了初步分析,表明L. acidophilus在正常肠道弱碱性环境(pH 7.5)中黏附性较强,能够抑制肠道细胞炎症因子IL-8的表达,同时促进抗炎因子IL-10的表达,显著降低肠道细胞的炎症反应。此外NF-κB、TLR-4、Hsp70基因相对表达量的改变也均会对肠道产生有利的影响。整体来看,在正常的弱碱性肠道环境中L. acidophilus可提高肠道细胞的抗炎能力。

